二甲双胍抑制mTOR/HIF-1α通路减轻实验性自身免疫性脑脊髓炎小鼠中的Th17细胞反应①
2018-10-12孙雅菲刘晓倩侯慧清
孙雅菲 刘晓倩 侯慧清 田 甜 郭 力
(河北医科大学第二医院,河北省神经病学重点实验室,石家庄050000)
多发性硬化(Multiple sclerosis,MS)是以中枢神经系统髓鞘脱失进而继发轴索变性为特征的自身免疫性疾病[1]。MS的发病机制尚不完全清楚,越来越多的研究表明,抗原特异性Th17细胞能通过多种免疫反应在其中起重要作用[2,3]。二甲双胍(Metformin,MET)是临床常用的降糖药物,除了降糖作用外,它在抗炎、抗氧化中的作用也逐渐被人们发现[4,5],并用于糖尿病的外的其他疾病的实验研究[6,7]。本研究利用MS的动物模型,观察给予MET治疗是否对实验性自身免疫性脑脊髓炎(Experimental autoimmune encephaomyelitis,EAE),小鼠起保护作用,并对MET针对Th17细胞的影响和可能机制进行探讨。
1 材料与方法
1.1材料
1.1.1实验动物 采用8~10周龄C57BL/6雌性小鼠(北京维通利华实验动物技术有限公司)建立EAE模型。将实验动物随机分为对照组、EAE组和MET治疗组,每组20只。
1.1.2主要试剂和材料 百日咳毒素(Pertussis toxin,PTX)、二甲双胍(ENZO corporation);MOG35-55(西安美联生物科技有限公司);结核菌素H37Ra(DIFCO公司);小鼠IL-17A-PE抗体、Cell Stimulation Cocktail(plus protein transport inhibitors)(美国eBioscience);小鼠IL-17A定量分析酶联免疫试剂盒(上海巧伊生物科技有限公司);HiFiScript first-strand cDNA synthesis kit及UltraSYBR mixture(北京康为世纪生物技术有限公司);PCR引物由复能基因公司合成,引物序列见表1。
1.2方法
1.2.1动物模型建立 用生理盐水将MOG35-55稀释为10 mg/ml终浓度,并按 1∶1等体积加入完全弗氏佐剂充分混合乳化。抗原混合物中结核杆菌H37Ra终浓度为4 mg/ml。再以每只0.1 ml抗原于小鼠背部皮下分4点进行注射。免疫当天和第2天分别每只小鼠腹腔注射PTX 500 ng,对照组小鼠不作任何处理。
1.2.2药物干预 MET治疗组小鼠自免疫后第1天开始,将MET按100 mg/kg每天给予腹腔注射。对照组及EAE组小鼠同时给予等量的生理盐水腹腔注射作为对照。
1.2.3发病动物神经功能评分 每日上、下午各2次分别由2名实验者观察记录小鼠体重、神经功能评分。评分标准(Knoz评分法)如下:0分无症状;1分尾部失去张力;2分后肢力弱;3分后肢瘫痪;4分后肢及前肢瘫痪;5分濒临死亡或死亡。
1.2.4组织病理HE染色 于免疫后第20天(发病高峰期)对各组小鼠脊髓腰膨大组织进行病理取材,5 μm切片,HE染色。每只小鼠取不连续3张组织切片,在光学显微镜下观察每张切片5个400×视野中炎性细胞浸润情况。HE染色炎症评分标准如下:0分,无炎性细胞浸润;1分,散在炎性细胞浸润;2分,血管周围炎性细胞浸润;3分,“血管套袖”形成并累及周围组织。
1.2.5流式细胞学检测脾细胞中Th17细胞比例 于免疫后第20天(发病高峰期),随机在对照组、EAE组和MET治疗组各取5只小鼠,无菌条件下脱颈处死,分离小鼠脾脏。用玻璃注射器针芯于200目细胞筛上将剪碎的脾脏反复研磨,RPMI1640液冲洗制备细胞悬液,在其中加入无菌MOG35-55(10 μg/ml)后置于37℃ 5%CO2培养箱培养。8 h后加入PMA 50 ng/ml、Ionomycin 500 ng/ml和Brefeldin A 3 μg/ml,继续培养14 h,按照ebioscience流式检测方法检测CD4+IL-17A+细胞比例。
1.2.6ELISA方法检测细胞因子水平 将脾细胞悬液500 μl加入无菌24孔细胞培养板中,加入无菌MOG35-55(10 μg/ml)溶液置于37℃ 5%CO2恒温培养箱培养48 h,之后收集细胞培养液备用。小鼠摘除眼球取血,静置后离心分离收集血清备用。按照IL-17A酶联免疫检测试剂盒说明书检测培养上清及血清中蛋白浓度。
1.2.7qPCR检测mRNA转录水平 于免疫后第20天(发病高峰期)分别在各组随机取5只小鼠,Trizol提取脾组织中总RNA,HiFiScript first-strand cDNA synthesis kit反转录合成cDNA,应用实时定量PCR检测技术检测IL-17、RORγt、低氧诱导因子-1α(Hypoxia ducible factors-1 alpha,HIF-1α)mRNA转录水平。以β-actin作为内参。采用2-ΔΔCT法进行数据的相对定量分析。
1.2.8WB检测核糖体S6激酶(Ribosomal S6 protein kinase 1,S6K1)、pS6K1、HIF-1α蛋白表达 于免疫后第20天(发病高峰期)分别在各组随机取5只小鼠,分离脾组织,提取脾组织中蛋白,应用BCA检测试剂盒检测蛋白浓度,取50 μg蛋白在SDS-PAGE凝胶进行电泳,PVDF膜转膜,HIF-1α(1∶500),S6K1(1∶1 000),pS6K1(1∶200),β-actin(1∶3 000)抗体孵育,PVDF膜在Odyssey Infrared Imaging System 扫描成像系统成像保存。用软件Image J测出目的蛋白条带灰度相对值,与对应内参对比得出比值。
表1RORγt、IL-17A和HIF-1α引物序列
Tab.1RORγt,IL-17andHIF-1αoligonucleotideprimersusedforreal-timePCR
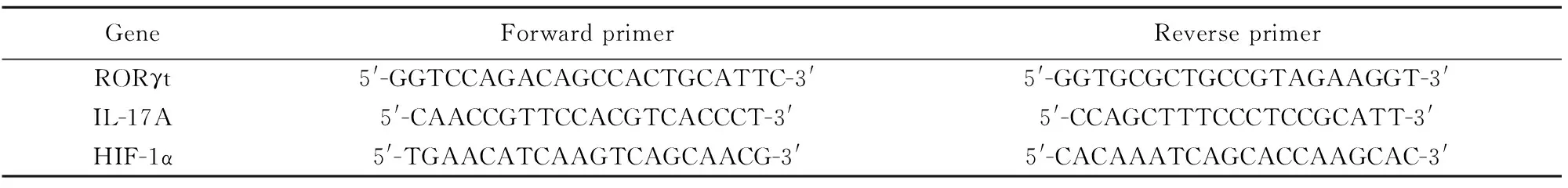
GeneForward primerReverse primerRORγt5'-GGTCCAGACAGCCACTGCATTC-3'5'-GGTGCGCTGCCGTAGAAGGT-3'IL-17A5'-CAACCGTTCCACGTCACCCT-3'5'-CCAGCTTTCCCTCCGCATT-3'HIF-1α5'-TGAACATCAAGTCAGCAACG-3'5'-CACAAATCAGCACCAAGCAC-3'
2 结果
2.1神经功能评分比较 整个实验过程中对照组小鼠均未发病。EAE组和MET治疗组小鼠免疫后出现不同程度的被毛不光滑、食欲减退,于免疫后第10天左右,体重下降,继而出现程度不同的尾部无力、单或双后肢无力、截瘫,甚至四肢瘫。EAE组发病率100%,而MET治疗组发病率76%,较EAE组发病率减低(P<0.05)。MET组小鼠发病时间较EAE组小鼠推迟[(15.25±1.48)d vs(12.40±1.83)d,P<0.05]。两组具体神经功能评分比较见图1。
2.2MET减轻EAE小鼠脊髓组织中炎性细胞浸润 发病高峰期,EAE组小鼠脊髓中可见大量炎性细胞在脊膜、脊髓前角、侧索和灰白质交界区浸润,并形成大量“血管袖套”。MET治疗组炎性细胞则多分布于小血管周围及脊膜处,“血管袖套”形成数量也较EAE组减少(P<0.01)。见图2。
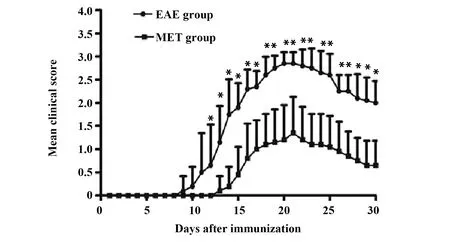
图1 EAE组和MET组神经功能评分Fig.1 Clinical signs of mice in EAE and MET treat-ment groupNote: Compared with the MET-treatment group,*.P<0.01.
2.3MET减少Th17细胞的产生和浸润 应用流式细胞学检测技术比较各组脾细胞中Th17细胞比例。EAE组较对照组Th17细胞比例升高[(0.27±0.15)% vs(1.03±0.15)%,P<0.01]。而MET治疗组Th17细胞比例较EAE组减低[(0.41±0.08)% vs(1.03±0.15)%,P<0.01]。见图3。
2.4MET减少细胞因子IL-17A生成 ELISA法检测脾细胞培养上清液及血清中IL-17A含量。细胞培养上清中,EAE组较对照组IL-17A含量增加[(281.17±4.01)pg/ml vs(149.91±15.89)pg/ml],而MET治疗组IL-17A含量较EAE组降低[(226.06±4.01)pg/ml vs(281.17±4.01)pg/ml,P<0.01]。血清中IL-17A含量EAE组较对照组增加[(248.08±8.62)pg/ml vs(169.82±15.86)pg/ml],MET治疗组较EAE组降低[(219.51±14.12)pg/ml vs(248.08±8.62)pg/ml,P<0.01]。见图4。
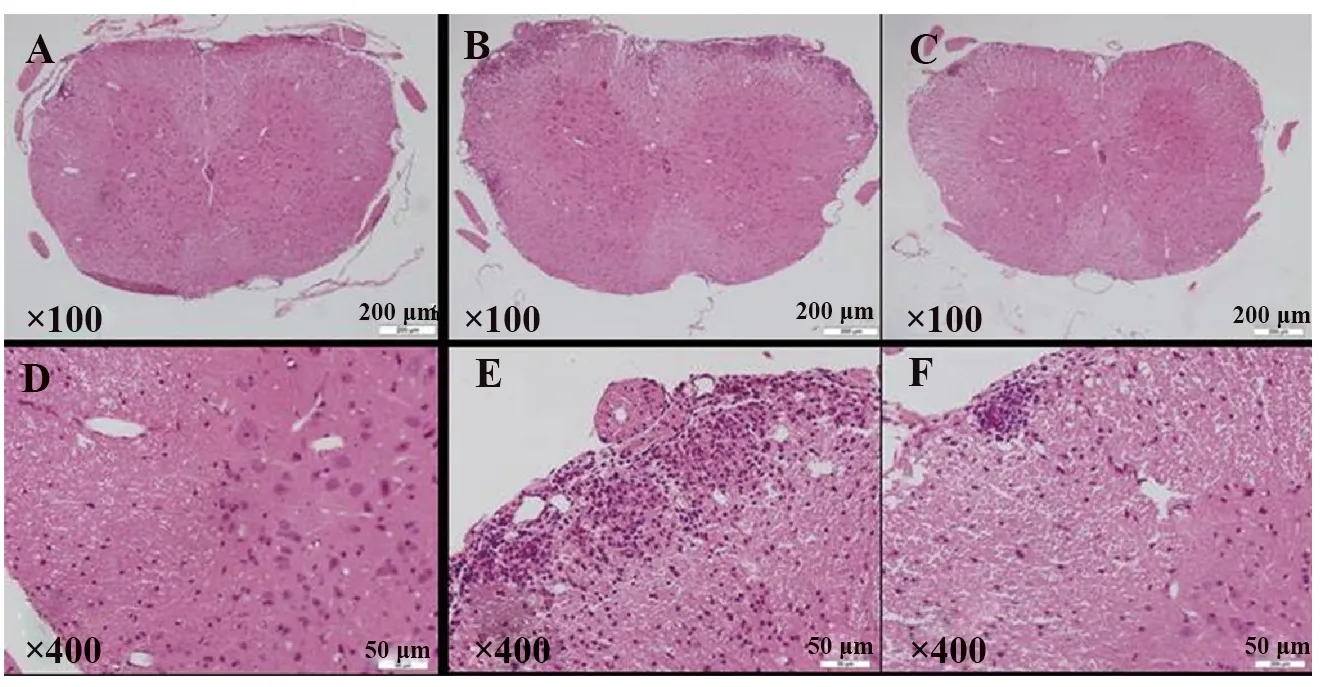
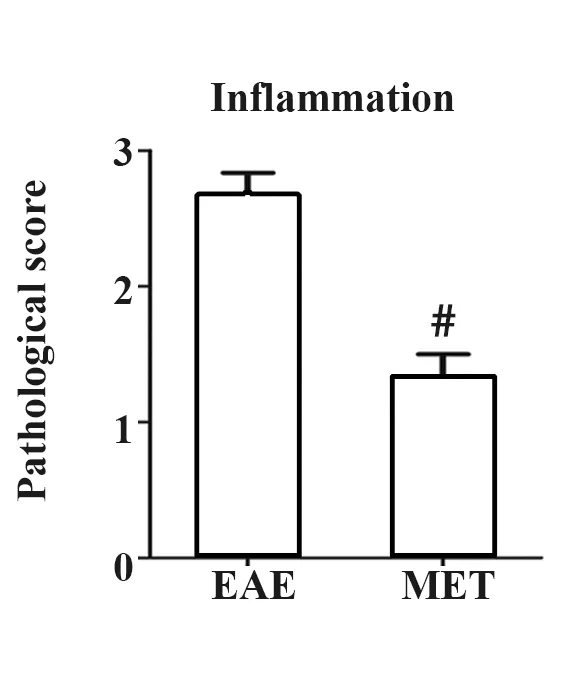
图2二甲双胍减轻EAE脊髓炎性细胞浸润程度
Fig.2METmitigatesinflammationinEAEmice
Note: A,D.Control group;B,E.AZ group;C,F.ET treatment group;compared with the EAE group,#.P<0.01.
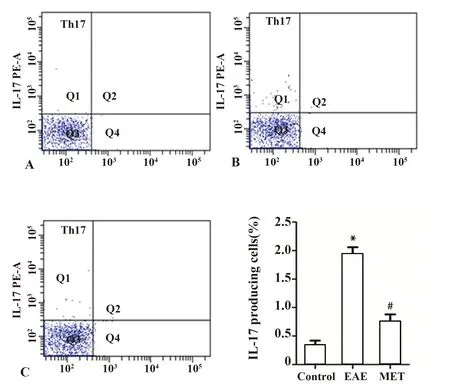
图3 二甲双胍减轻EAE中Th17细胞比例Fig.3 MET reduces propotion of Th17 cells in EAE miceNote: A.Control group;B.EAE group;C.MET treatment group.Compared with control group,*.P<0.01;compared with the EAE group,#.P<0.01.
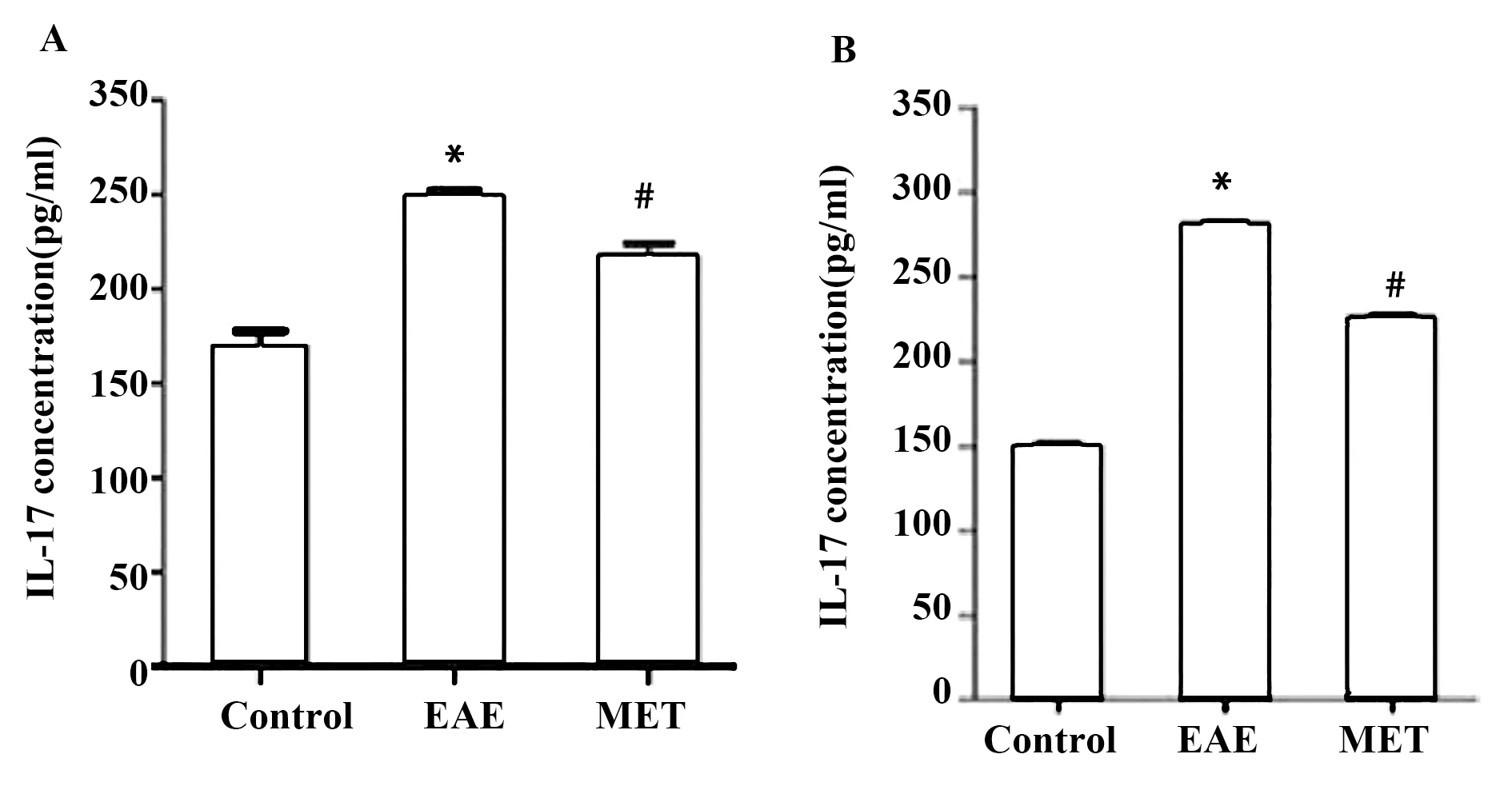
图4 血清及脾细胞培养上清中IL-17A含量Fig.4 Concentration of IL-17A in serum and supernatantsNote: A.Serum;B.Supernatants.Compared with control group,*.P<0.01;compared with the EAE group,#.P<0.01.
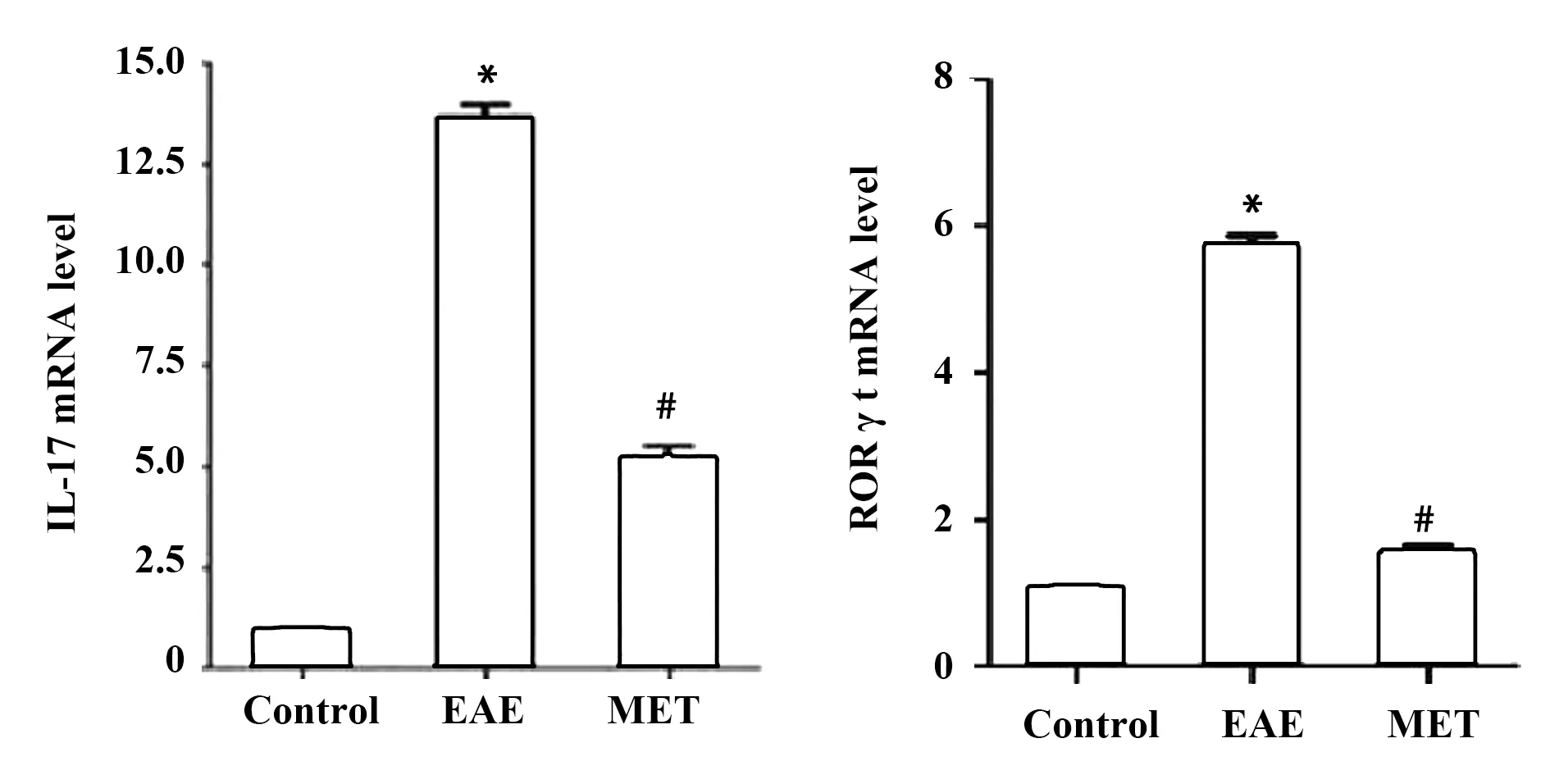
图5 qPCR检测脾中IL-17A,RORγt转录水平Fig.5 Expression of IL-17A,RORγt mRNA in spleen tissueNote: Compared with control group,*.P<0.01;compared with the EAE group,#.P<0.01.
2.5MET抑制脾组织中RORγt、IL-17AmRNA转录 在脾组织中,MET治疗组IL-17A转录水平较EAE组降低[(226.06±4.01)vs(281.17±4.01),P<0.01]。MET组RORγt mRNA转录水平较EAE组降低[(1.54±0.20)vs(5.73±0.24),P<0.01]。见图5。
2.6MET抑制脾组织中S6K1活化及HIF-1α表达 S6K1活化程度用pS6K1/S6K1表示。EAE组较对照组S6K活化程度提高(0.76±0.09 vs 0.46±0.12,P<0.01)。MET治疗组较EAE组S6K活化程度降低(0.54±0.05 vs 0.76±0.09,P<0.05)。见图6。
EAE组与对照组相比,HIF-1α蛋白表达增加(0.79±0.12 vs 0.49±0.05,P<0.01)。MET治疗组较EAE组HIF-1α蛋白表达降低(0.53±0.07 vs 0.79±0.12,P<0.01)。见图7。HIF-1α mRNA的转录水平也呈现出相同的变化趋势,EAE组vs对照组(1.87±0.12 vs 0.82±0.11);MET组vs EAE组(1.37±0.25 vs 1.87±0.12,P<0.01)。见图7。
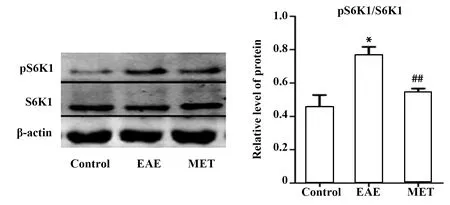
图6 脾中S6K1活化程度比较Fig.6 Degree of S6K1 activation in spleen tissueNote: Compared with control group,*.P<0.01;compared with the EAE group,##.P<0.05.
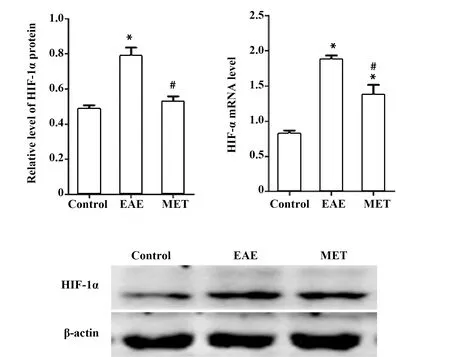
图7 脾中HIF-1α蛋白表达及mRNA转录水平Fig.7 Relative levels of HIF-1α expression and mRNA transcripts in spleen tissuesNote: Compared with control group,*.P<0.01;compared with the EAE group,#.P<0.01.
3 讨论
MS病因及发病机制尚未阐明,环境及遗传易感性参与疾病的发生发展。随着人们的不断研究认识到抗原特异性Th17细胞参与的免疫反应在MS和EAE的发病中起重要作用[2]。Th17细胞及其分泌的细胞因子在多个环节参与MS发病及病理损伤。IL-17可以直接作用于内皮细胞破坏血脑屏障,促进炎性细胞向中枢神经系统浸润,诱导IL-1、IL-6等其他促炎因子生成加重异常免疫反应造成对组织的破坏[3,8]。在大量的临床研究中也发现IL-17水平在MS 患者中明显高于健康人群[9]。
不同的T细胞亚群具有不同的生物功能,在T细胞产生、活化、分化和决定功能中细胞代谢起着重要作用,受到外界刺激活化时,淋巴细胞的代谢功能方式由静止时的有氧氧化代谢方式转化为以糖酵解代谢为主的方式[10]。
在维持T细胞生长及其在抗原刺激下的活化、分化这些生理过程中,哺乳动物的雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号途径起到重要作用,尤其在细胞代谢水平,对T细胞功能起到至关重要的作用。mTOR通过诱导c-Myc、HIF-1α转录而活化T细胞中糖酵解这一代谢途径[11],还可以通过转录后修饰促进这一代谢方式从而协调细胞生长[12]。同时在T细胞活化后能量代谢方式转化过程中,共刺激信号CD28对于PI3K/Akt/mTOR途径的活化是至关重要的[13]。雷帕霉素可以阻碍T细胞生长、增殖,使其处于无效能状态,就是通过其对于mTORC1的抑制进而抑制细胞内糖酵解而实现的[14]。
HIF-1α是mTOR下游编码参与糖酵解过程基因的重要的靶分子,对于细胞适应外界能量变化起作用[15],在T淋巴细胞中葡萄糖转运蛋白1、己糖激酶、葡萄糖-6-磷酸异构酶、乳酸脱氢酶等多种糖酵解酶的基因表达受到HIF-1α的影响[16]。有研究报道HIF-1α在Th17细胞分化、增殖过程中起到重要作用,而这种作用是通过对细胞能量代谢方式设定而达到的。在HIF-1α功能缺陷的细胞中,参与糖酵解过程的基因的数量和功能相对野生型均受到影响,进而影响糖酵解代谢过程,影响Th17细胞分化[16]。
腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)与mTOR在调节免疫信号联系和细胞代谢中有相反的作用[17],AMPK可以通过对TSC2磷酸化,还可以对mTORC1的结构蛋白raptor磷酸化进而阻止mTORC1活化。在AMPKα1功能缺陷的T细胞中可以表现出mTORC1和糖酵解代谢的高活性[18]。同时亦有缺乏AMPK的小鼠胚胎成纤维母细胞中HIF-1α表达上调的研究结果证实这一观点[19]。
二甲双胍作为临床常用的降糖药物,可以激活AMPK[20],也被作为AMPK激活剂在多个实验研究中使用。正是基于上述现有研究,我们将二甲双胍应用于EAE,观察其对于EAE小鼠是否具有保护作用,并探索其可能的保护机制。在本研究中应用二甲双胍干预EAE小鼠,可以减轻动物发病的严重程度,推迟动物发病时间,减少了炎性细胞向中枢神经系统的浸润。给予MET干预后,在小鼠脾中的Th17细胞的数量减少,其分泌的IL-17A降低。我们还应用PCR技术检测了EAE外周免疫器官脾中Th17细胞特异性转录因子RORγt和其分泌的特征性细胞因子IL-17A的mRNA转录水平,mRNA转录水平表现出和蛋白表达同样的结果。mTORC1的激活可以通过检测S6K1的磷酸化来判定,我们通过检测S6K1的磷酸化程度来明确二甲双胍对于mTOR的抑制作用,在实验中发现,MET对S6K1的激活程度起到抑制作用,进一步说明了其可以降低mTOR的活性。我们又进一步检测了mTOR下游涉及细胞代谢的HIF-1α的蛋白表达和mRNA转录水平,也发现应用MET治疗,减少了mTOR下游HIF-1α的转录和蛋白表达。
我们的实验发现,应用MET抑制了EAE体内的Th17细胞反应,且抑制了脾组织内mTOR、HIF-1α的活化和表达,MET可能通过对细胞代谢的影响抑制了Th17细胞反应,进而在EAE疾病发生和发展中起到保护作用。尽管MET对于EAE小鼠的保护作用可能还涉及其他机制,我们的实验从细胞代谢这一角度出发,为进一步寻找新的干预免疫反应的药物提供了新的思路和可能的理论基础。