转录因子ROR-γt与Th17介导的中性粒细胞性哮喘①
2018-10-12涂敏芳邓焕华
张 伟 涂敏芳 邓焕华
(威海市中医院,威海264200)
近年来,研究发现Th17细胞是一类新的CD4+T细胞亚群,它能够特异性地产生细胞因子IL-17[1,2];而核孤儿受体-γt(ROR-γt)是它的特异性转录因子[3],ROR-γt可诱导Th17细胞的产生及分化。IL-17具有强大的招募中性粒细胞的作用。因此,Th17细胞介导了中性粒细胞性哮喘气道炎症的发生[4]。本实验研究拟通过验证以下假说来说明中性粒细胞性哮喘气道炎症的信号转导通路:转化生长因子-β(Transforming growth factor-β,TGF-β)与IL-6作为启动因子,促进幼稚的CD4+T细胞通过JAK-STAT通路向Th17转化,而ROR-γt是它的特异性转录因子,诱导Th17的产生与分化,并分泌炎性因子IL-17,IL-17可招募大量的中性粒细胞,从而引发中性粒细胞性哮喘。
1 材料与方法
1.1材料
1.1.1动物 SPF级SD雄性大鼠24只,体重200~220 g,由苏州工业园区爱尔麦特科技有限公司提供(合格证编号:No.201508901),动物在实验前适应性驯养1周,饲养环境为江西中医学院热敏灸重点实验室,室温25℃,空气湿度50%,通风条件良好。
1.1.2主要试剂和仪器 10%卵白蛋白、脂多糖、TGF-β、IL-6、IL-17酶联免疫试剂盒(Sigma公司生产);氢氧化铝[Al(OH)3]溶液(广州化学试剂厂);FITC conjugated anti-CD4、PE-Cy7-conjugated anti-IL-17(eBioscience);ROR-γt抗体、β-actin 抗体(北京中杉金桥生物技术有限公司);PCR引物(上海生工);反转录试剂盒、Real time PCR mastermix(全式金生物技术有限公司);Trizol(Invitrogen公司);超声雾化器(型号:402AI上海鱼跃医疗设备有限公司);酶标仪(型号:Multiskan mk3,芬兰雷勃公司);凝胶成像分析系统(型号:ChemiDoc MP Bio-Rad公司);分光光度仪(型号:Nano Drop 2000,Thermo Fisher Scientific公司);高速冷冻离心机(型号:Micro 21R,Thermo Fisher Scientific公司);多用途旋转摇床(型号:QB-206,海门其林贝尔仪器制造有限公司);Real time PCR仪(型号:ABI7500,Applied biosystems);SDS-PAGE电泳仪(型号:PowerPac,Bio-Rad公司);转膜仪(型号:Trans-Blot Turbo,Bio-Rad公司);流式细胞仪(CytoFLEX,Beckman Coulter有限公司);光学显微镜(型号:IX73,OLYMPUS公司)。
1.2方法
1.2.1分组 按随机数字表法将动物分为正常对照组、模型组、地塞米松组。每组8只。
1.2.2造模方法[5,6]模型组与地塞米松组于实验第1天和第8天,2次致敏,每只大鼠用1%戊巴比妥钠溶液50 mg/kg腹腔内注射麻醉后,使其颈部竖直,用移液器取2 mg/kg脂多糖(LPS)经鼻逐滴滴入,利用大鼠呼吸将致敏液吸入气道,左右鼻孔交替进行并于腹腔内注入卵白蛋白(OVA)0.1 g/kg。从第15天开始,用1%OVA溶液进行雾化吸入激发,每天雾化30 min,雾化流量3 L/min,连续雾化2周。正常对照组于实验第1天和第8天腹腔注射注射用水0.2 ml,于实验第15天起开始雾化吸入注射用水30 min,雾化流量3 L/min,连续雾化2周。
1.2.3造模成功标准 以大鼠出现烦躁、呛咳、打喷嚏、呼吸频率加快,幅度加大、腹式呼吸明显和点头运动,严重者呼吸减慢或节律不整,四肢瘫软,行动迟滞或俯伏不动,反应迟钝等症状为激发成功。
1.2.4地塞米松干预方法 于实验开始后第15天起,按0.5 mg/kg予以腹腔注射,每日一次,共14次,每次注射于OVA雾化吸入前0.5 h结束。
1.2.5样品采集及指标检测
1.2.5.1HE染色观察肺组织病理形态学 取右肺上叶,石蜡包埋,HE染色,观察肺泡壁厚度、肺泡大小及融合程度、炎性细胞浸润情况、黏膜上皮纤维化情况、支气管平滑肌细胞增生情况等。
1.2.5.2BALF细胞计数及ELISA法测TGF-β、IL-6、IL-17含量。BALF液采集方法:用动脉钳夹住右肺门,分离颈部气管,于近气管开叉处行T型切口,插管至左支气管下端分叉处,结扎气管插管处。注射器吸取室温生理盐水0.5 ml,左肺变得膨隆、苍白,回抽灌洗液,反复2次,收至离心管。重复采集3次,4℃下1 500 r/min离心,取上清,-20℃保存,做ELISA。回收离心后的细胞沉淀,加0.2 ml红细胞裂解液,4℃下1 500 r/min离心,弃上清,加1 ml PBS重悬细胞,少量于Neubauer计数台上做细胞总计数,一般以109L-1表示;剩余悬液注入液基细胞沉降管,经安必平液基细胞沉降式制片、瑞氏染色,计200个细胞做细胞分类计数。
1.2.5.3流式细胞术测外周血及脾脏中Th17的水平 各组大鼠于第28天雾化吸入结束后2 h内取材。3.5%水合氯醛(1 ml/100 g)行腹腔麻醉,剪开大腿内侧肌肉暴露股动脉,先用预先吸有肝素钠1 ml的注射器经股动脉取血2 ml,作为流式细胞学检测备用,股动脉放血处死大鼠。打开胸腔与腹腔,取脾脏。
流式细胞术:取新鲜脾及外周血,制备脾(外周血)淋巴细胞悬液,加入1×cell stimulation cocktail刺激淋巴细胞增殖,加入CD4+FITC、IL-17荧光单克隆抗体,运用流式细胞仪检测IL-17所代表的Th17的含量。采用Flowjo分析软件。
1.2.5.4免疫组织化学法测定大鼠肺组织中ROR-γt蛋白表达 取右肺中叶,石蜡包埋,脱蜡,水化,封片,一抗孵育,显色,复染与封片。每个样本随机抽取3张免疫组化切片,每张切片在显微镜下(×400)随机选取5个互不重叠视野,测定单位面积阳性细胞表达的平均吸光度值。采用Image-Pro Plus分析软件进行分析。
1.2.5.5免疫印迹法(Western blot)检测肺组织中ROR-γt蛋白含量 取右肺下叶组织,肺组织在RIPA蛋白裂解液中裂解,提取蛋白样品,SDS-PAGE凝胶电泳,转膜,一抗、二抗孵育,化学发光剂检测转印膜上靶蛋白信号。采用Image-Pro Plus分析软件进行分析。
1.2.5.6逆转录聚合酶链反应(RT-PCR)技术检测肺组织中ROR-γt mRNA的表达 取右肺下叶组织,TRIzol法抽提总RNA,逆转录反应,PCR扩增,电泳(见表1)。
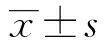
2 结果
2.1各组大鼠肺组织病理改变 在光镜200 μm水平下观察:正常对照组显示细支气管管壁光滑,支气管平滑肌细胞未见增生,支气管黏膜皱壁无增生,管腔通畅,管内无炎性渗出物,肺泡壁厚薄均匀一致,肺泡大小均匀一致,肺泡无融合,杯状细胞无增生,气道、肺间质、小血管内无明显炎性细胞;模型组气管管壁周围有大量炎性细胞浸润,主要以中性粒细胞、嗜酸粒细胞、淋巴细胞、巨噬细胞为主;支气管黏膜皱裳增多延长,杯状细胞增生明显,平滑肌增厚,管腔缩窄,内有黏液栓,部分肺泡壁变薄或断裂,融合成肺气肿;地塞米松组气管管壁周围有少量炎性细胞浸润;支气管黏膜皱裳少许增多延长,杯状细胞少量增生,平滑肌轻度增厚,管腔稍有缩窄,内有少量黏液栓,少量肺泡壁变薄或断裂,融合成肺气肿。见图1。
2.2BALF中白细胞总数,炎性细胞分类计数 各组大鼠BALF溶液回收率>80%,与正常对照组比,模型组中BALF白细胞总数显著增多(P<0.01),差异有统计学意义;其中中性粒细胞百分比、嗜酸粒细胞百分比、淋巴细胞百分比与正常对照组比较均显著增多(P<0.01),说明中性粒细胞性哮喘肺内有大量炎性细胞浸润。地塞米松组与模型组比较,白细胞总数、中性粒细胞百分比、嗜酸粒细胞百分比、淋巴细胞百分比均显著降低(P<0.01),说明地塞米松对于控制哮喘炎性反应具有显著疗效(图2~4)。
表1目的基因的引物序列
Tab.1Primersequencesoftargetgene

PrimernamePrimersequencesAmplifiedfragment lengthROR-γtF:GCAGGAGCAATGGAAGTCG162 bpR:CGCTGAGGAAGTGGGAAAAβ-actinF:TAAAGACCTCTATGCCAACACAGT220 bpR:CACGATGGAGGGGCCGGACTCATC
2.3各组BALF液中TGF-β、IL-6、IL-17含量 模型组BALF中TGF-β、IL-6、IL-17的含量与正常对照组比较,显著升高(P<0.01),而地塞米松组与模型组比较,显著降低(P<0.01),说明中性粒细胞性哮喘大鼠支气管、肺泡中有大量的TGF-β、IL-6、IL-17炎性因子,而地塞米松可显著控制炎性因子的含量(表2、图5)。
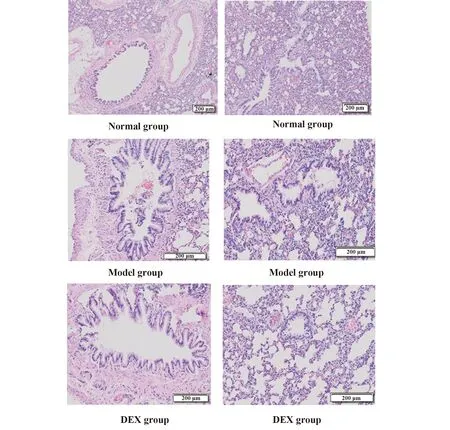
图1 HE染色观察各组大鼠肺组织病理改变Fig.1 Observe pathological changes of lung tissues in each group though HE stain
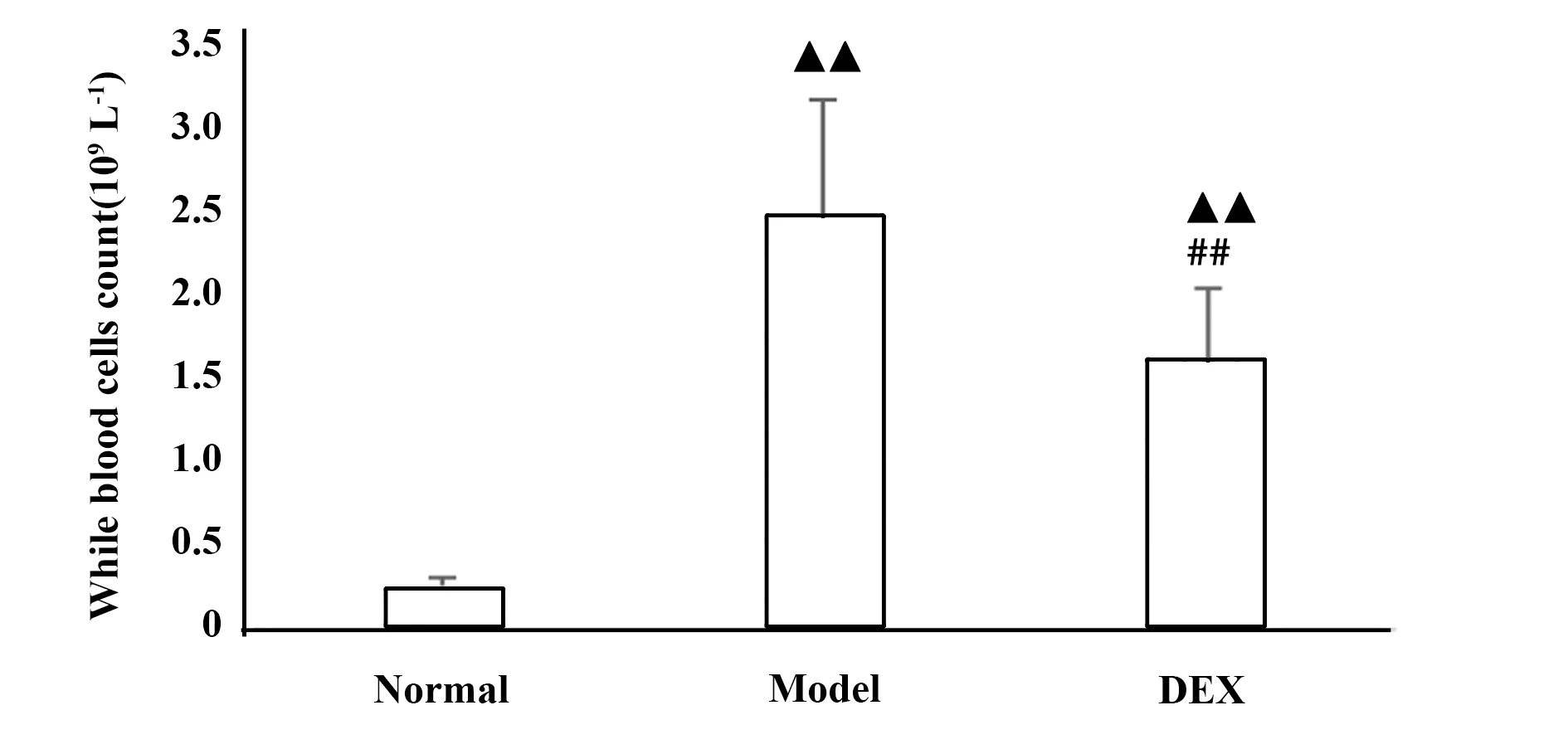
图2 各组大鼠BALF白细胞总计数Fig.2 Total count of WBC in BALF of each group Note:▲▲.P<0.01,vs normal group;##.P<0.01,vs model group.
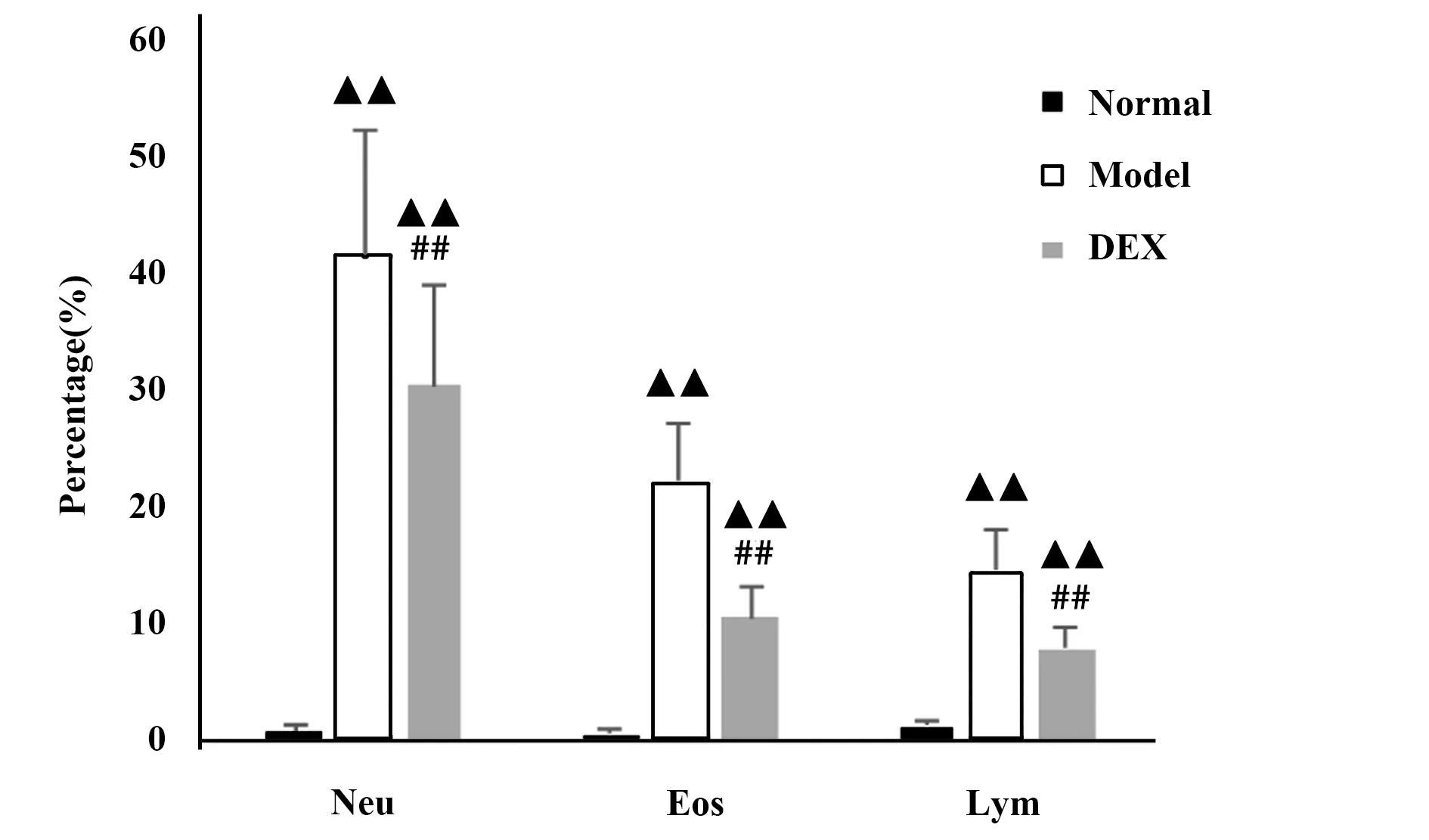
图3 各组大鼠BALF中炎性细胞分类百分比Fig.3 Percentage of inflammatory cell classification in BALF of each groupNote:▲▲.P<0.01,vs normal group;##.P<0.01,vs model group.

图4 各组大鼠BALF炎性细胞分类计数(瑞氏染色)Fig.4 Inflammatory cell classification in BALF of each group(Wright′s tain)
表2各组大鼠BALF中TGF-β、IL-6、IL-17的含量比较
Tab.2ContentofTGF-β,IL-6,IL-17inBALFofeachgroup

GroupsTGF-β(pg/ml)IL-6(pg/ml)IL-17(pg/ml)Normal group41.16±10.1346.52±10.7552.54±12.34Model group101.47±23.361)113.73±25.421)167.58±38.941)Dex group77.81±18.541)2)82.56±19.411)2)103.85±23.451)2)
Note:1)P<0.01,vs normal group;2)P<0.01,vs model group.
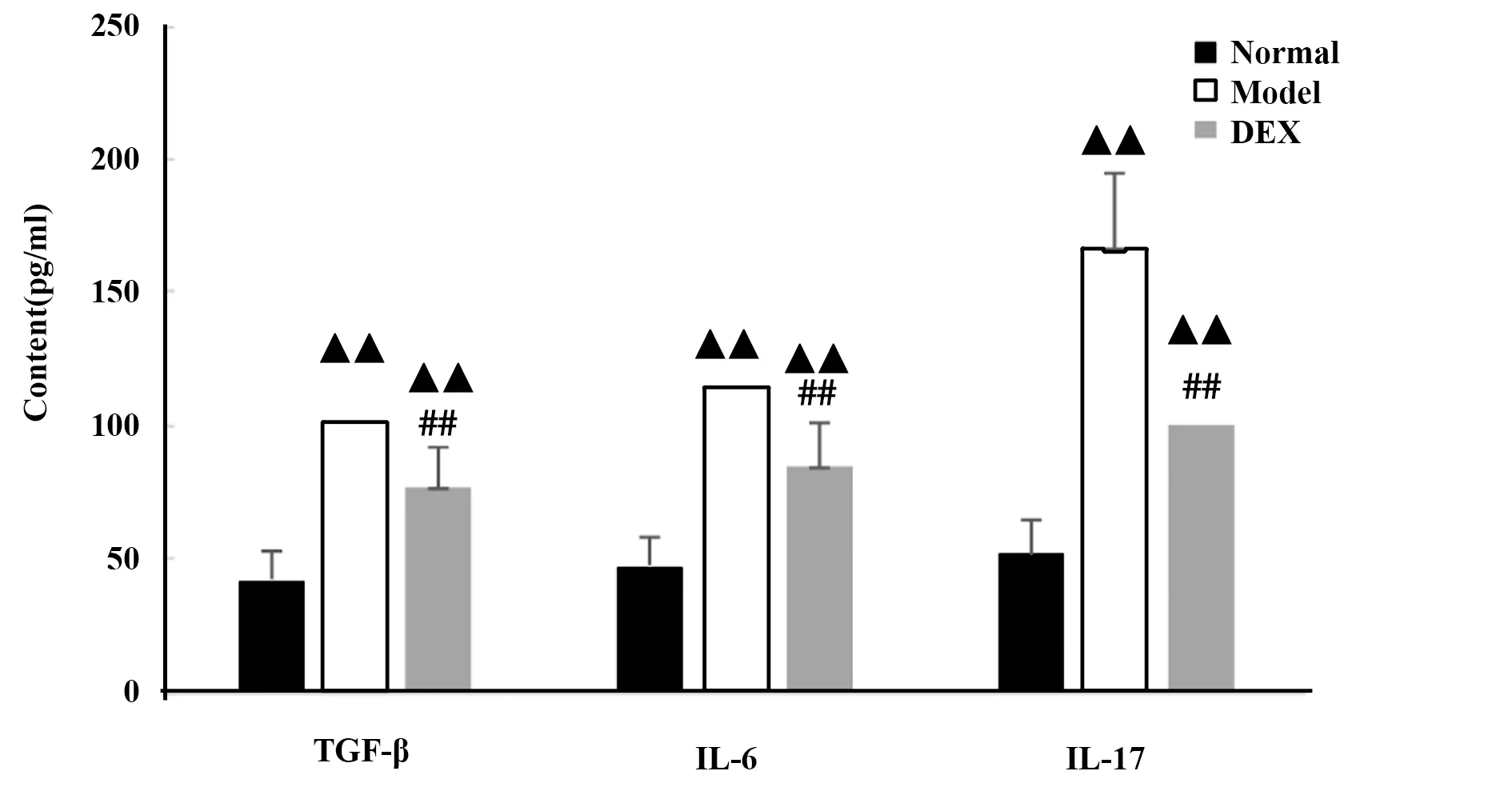
图5 各组大鼠BALF中TGF-β、IL-6、IL-17含量的比较Fig.5 Content of TGF-β,IL-6,IL-17 in BALF of each groupNote:▲▲.P<0.01,vs normal group;##.P<0.01,vs model group.
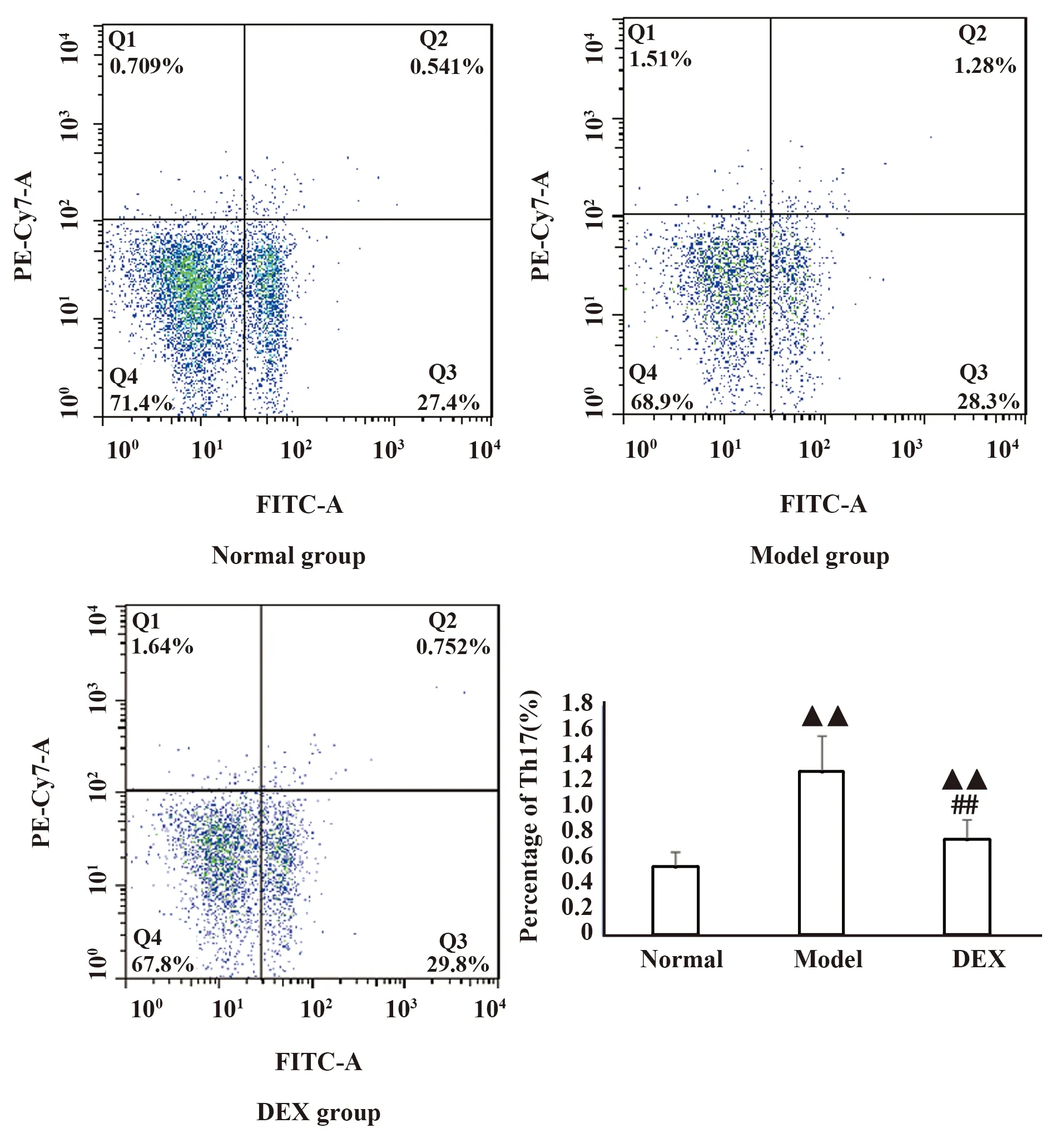
图6 各组大鼠脾脏Th17的含量Fig.6 Content of Th17 in spleen of each groupNote:▲▲.P<0.01,vs normal group;##.P<0.01,vs model group.

图7 各组大鼠外周血Th17的含量Fig.7 Content of Th17 in peripheral blood of each groupNote:▲▲.P<0.01,vs normal group;▲.P<0.05,vs normal group;##.P<0.01,vs model group.
2.4各组大鼠脾脏及外周血中Th17的含量 以IL-17含量来代表的Th17在脾脏及外周血的含量,模型组Th17所占百分比显著高于正常对照组(P<0.01),而地塞米松组显著高于或高于正常对照组(P<0.01或P<0.05),而地塞米松组Th17含量与模型组比较则显著降低(P<0.01),说明中性粒细胞性哮喘大鼠幼稚的CD4+显著向Th17分化,而地塞米松可显著抑制Th0向Th17的分化(图6、7)。
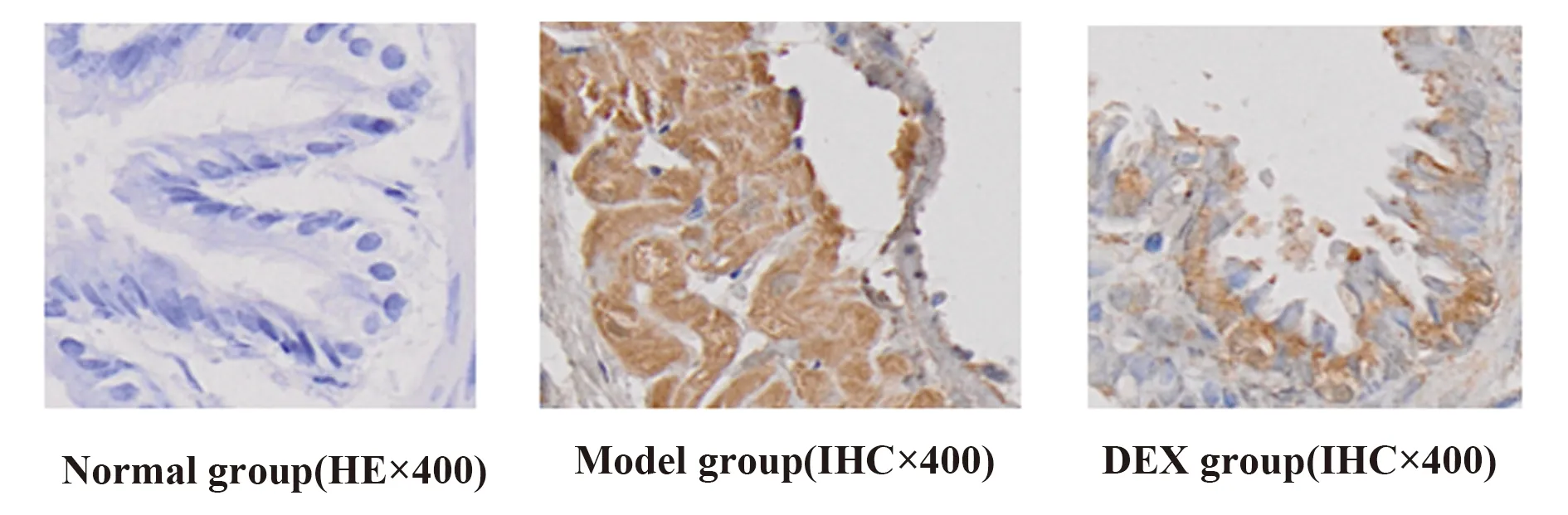
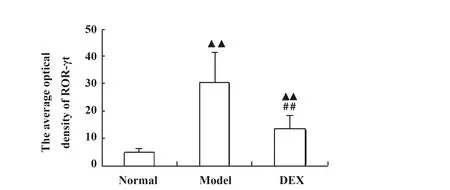
图8各组大鼠肺组织ROR-γt蛋白的平均吸光度值
Fig.8AverageopticaldensityofROR-γtproteininlungtissueofeachgroup
Note: ▲▲.P<0.01,vs normal group;##.P<0.01,vs model group.

图9 各组大鼠肺组织中ROR-γt蛋白表达的比较Fig.9 Relative expression level of ROR-γt protein in lung tissue of each groupNote:▲▲.P<0.01,vs normal group;##.P<0.01,vs model group.
2.5各组大鼠肺组织中ROR-γt蛋白的含量 免疫组化法测得各组大鼠肺组织中ROR-γt平均吸光度值,模型组与地塞米松组皆显著高于正常对照组(P<0.01),而地塞米松组与模型组比较,ROR-γt蛋白含量显著降低(P<0.01),说明ROR-γt参与了中性粒细胞性哮喘的发作,而地塞米松可以抑制ROR-γt蛋白的水平,从而减轻中性粒细胞性哮喘的程度(图8)。
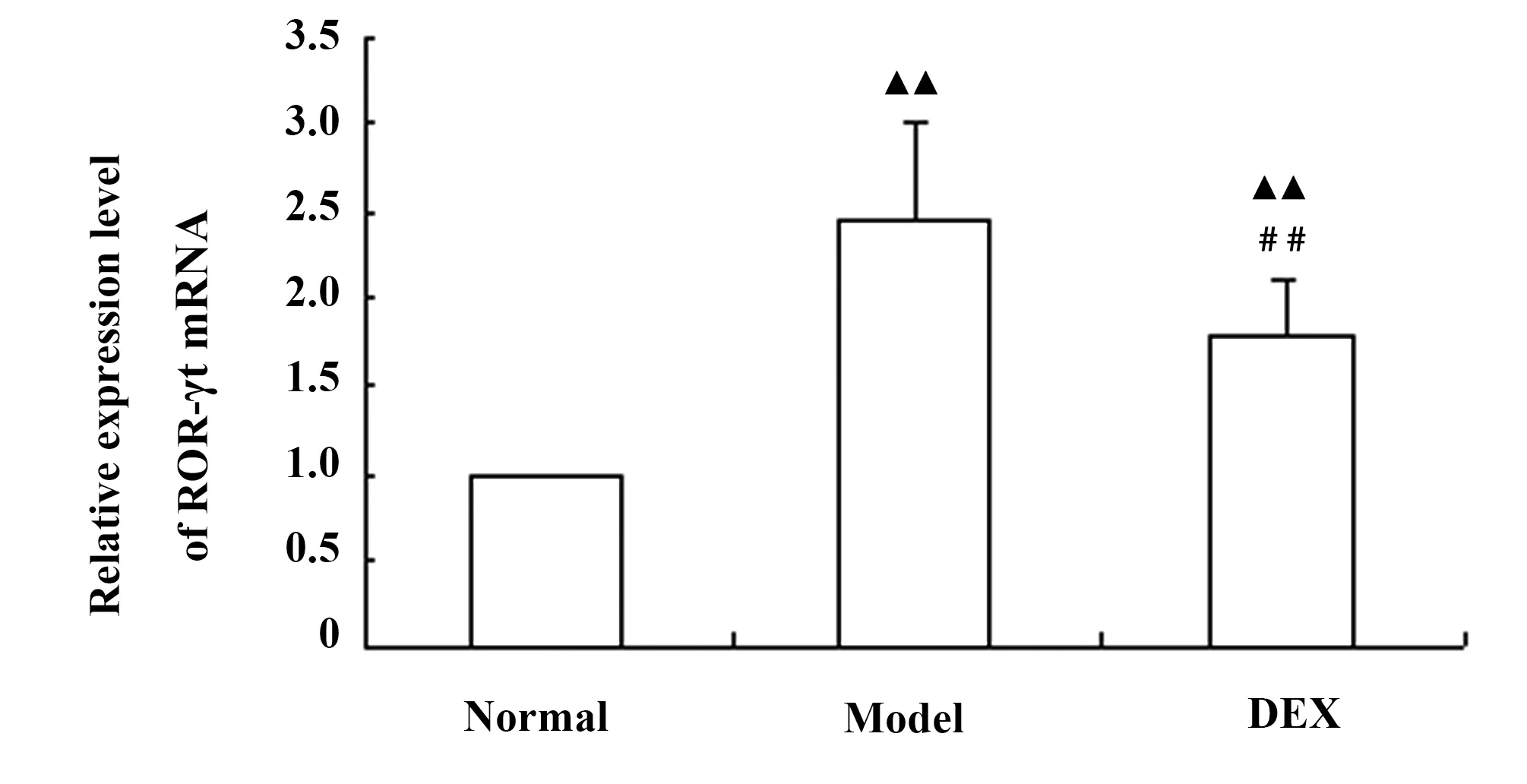
图10 各组大鼠肺组织中ROR-γt mRNA的表达Fig.10 Relative expression level of ROR-γt mRNA in lung tissue of each groupNote:▲▲.P<0.01,vs normal group;##.P<0.01,vs model group.
2.6肺组织中ROR-γt蛋白的免疫印迹表达 Western blot法测得各组大鼠肺组织中ROR-γt蛋白的免疫印迹表达水平,模型组与地塞米松组ROR-γt蛋白表达皆显著高于正常对照组(P<0.01),而地塞米松组与模型组比较,ROR-γt蛋白含量显著降低(P<0.01),说明ROR-γt参与了中性粒细胞性哮喘的发作,而地塞米松可以抑制ROR-γt蛋白的水平,从而减轻中性粒细胞性哮喘的程度(图9)。
2.7肺组织中ROR-γt mRNA的表达 RT-PCR法测得各组大鼠肺组织中ROR-γt mRNA的表达水平,与正常对照组比较,模型组与地塞米松组ROR-γt mRNA表达量均显著增高(P<0.01),而与模型组比较,地塞米松组ROR-γt mRNA表达显著降低(P<0.01),说明ROR-γt参与了中性粒细胞性哮喘的发作,而地塞米松可以抑制ROR-γt蛋白的水平,从而减轻中性粒细胞性哮喘的程度(图10)。
3 讨论
Th17目前已证实是由天然T细胞前体Th0分化而来。Th0在特定抗原刺激及多种信号综合作用下,活化后可以分化为不同的T辅助细胞亚群[7,8]。在转化生长因子β(TGF-β)和IL-6共同作用下诱导幼稚T细胞向Th17细胞分化,分泌IL-17,并表达ROR-γt[9],ROR-γt是Th17细胞分化的关键转录因子。ROR-γt是维甲酸相关核孤儿受体家族成员之一[10],特异性分布于CD4+CD8+淋巴细胞[11],受STAT3的调控[12]。ROR-γt可以作为染色体重塑因子开放IL-17基因座位,并使其他因子直接结合到IL-17启动子上,从而诱导初始CD4+T细胞中IL-17基因的转录。在分化成熟的Th17细胞内ROR-γt特异性高表达,而且在初始T细胞内转入编码ROR-γt的逆转录病毒可诱导初始T细胞分化为Th17,分泌IL-17;当转录因子ROR-γt缺陷时,炎症细胞向组织的募集和浸润降低,自身免疫性疾病和炎症性疾病的症状缓解[13]。IL-17是Th17的分泌因子[14]。IL-17是一种前炎症细胞因子,诱导T细胞介导的慢性炎症反应[15]。IL-17有强大的招募中性粒细胞因子的作用,并抑制Th2型嗜酸性细胞炎性反应。
综上所述,在ROR-γt特异性高表达下,诱导Th0细胞向Th17转变,产生大量的IL-17,而IL-17有强大的招募中性粒细胞因子的作用,产生了中性粒细胞参与为主的中性粒细胞型哮喘,而中性粒细胞参与了哮喘的急性发病及恶化过程。
本实验研究显示,中性粒细胞性哮喘的气道内大量炎性细胞浸润,主要以中性粒细胞为主,而地塞米松可显著减少炎性细胞的数量,从而减轻哮喘的发作。TGF-β、IL-6和IL-17在BALF中大量存在,TGF-β、IL-6有可能为Th17介导的中性粒细胞性哮喘的启动因子,而IL-17则为下游因子,它可以募集大量的中性粒细胞,引发急性哮喘的发作;经地塞米松治疗后,TGF-β、IL-6和IL-17在BALF中的含量则显著降低。经流式细胞技术测定,在脾脏与外周血中可检测到Th17的存在,且模型组的含量显著高于正常组与地塞米松组,说明中性粒细胞性哮喘与Th17的升高有高度相关性;在肺组织中,通过免疫组化法及免疫印迹法测得ROR-γt蛋白的表达,RT-PCR法测得ROR-γtmRNA的表达,ROR-γt在中性粒细胞性哮喘模型中均有高表达,而地塞米松可显著降低ROR-γt的含量,说明ROR-γt参与了Th17细胞的分化过程,并且是促进Th0向Th17分化的关键转录因子。
因此,中性粒细胞性哮喘与Th17高表达密切相关,而ROR-γt是促进Th0向Th17分化的关键转录因子,Th17产生大量的IL-17,而IL-17具有强大的募集中性粒细胞的作用,从而使气道内产生大量的炎性因子,并引发中性粒细胞性哮喘的发生。