呼吸道合胞病毒L蛋白单克隆抗体的制备①
2018-10-12向江艳詹炉停郑子峥夏宁邵
向江艳 詹炉停 赵 敏 张 伟 郑子峥 夏宁邵
(厦门大学分子疫苗学与分子诊断学国家重点实验室,厦门大学国家传染病诊断试剂与疫苗工程技术研究中心,厦门361102)
呼吸道合胞病毒(human respiratory syncytial virus,hRSV或RSV)是一种单股负链RNA病毒,属于副黏液病毒科肺炎病毒属[1,2],是引起全球范围内婴幼儿下呼吸道感染的主要病原之一,两周岁以内的婴幼儿几乎都感染过RSV[3]。RSV感染后,机体会激发中和抗体及T细胞免疫反应,两者均在病毒清除后逐渐衰退,从而导致一生中反复感染RSV[4]。
RSV基因组共有10个基因,编码11个蛋白[5],其中L蛋白(Large nucleoprotein)为RSV的RNA聚合酶,包含2 165个氨基酸,分子量为250 kD[6],是RSV病毒颗粒中最大的蛋白,也是核衣壳的重要组分,P与N[7,8]、L以及M2-1蛋白[9]相结合形成核衣壳;另外,N与P蛋白共定位包涵体,为病毒核酸合成提供场所[10]。目前对RSV L蛋白的结构、结构与功能的关系研究还不够深入,病毒感染复制过程中RNA合成机制以及核相关蛋白在不同阶段的表达情况及相互作用尚无明确阐述。本研究通过对L蛋白进行肽段展示来制备线性表位抗体,为今后病毒感染机制及疫苗研究提供检测试剂。
1 材料与方法
1.1实验材料、试剂和仪器 大肠杆菌DH5α菌株、293FT和骨髓瘤细胞Sp2/0-Ag14(Sp2/0)、载体pC149-mut(简称HBc)与F1代腹水小鼠(本实验室提供);6~8周雌性BALB/c小鼠(SPF级)(上海斯莱克公司);ER2566菌株(NEB公司);Full-L、GFP质粒及Hep2细胞、RSV A2病毒(美国NIH疫苗研究中心馈赠);限制性核酸内切酶、T4 DNA连接酶(华美生物工程公司);Taq-DNA聚合酶、逆转录酶AMV和RNasin(Promega公司);Trizol(Roche公司);RNaseA、DNase Ⅰ、氨基蝶呤、PEG1500、DAPI、FITC荧光标签抗抗体及弗氏佐剂(美国Sigma公司);胎牛血清和小牛血清(Hyclone公司);细胞培养所用RPMI1640、DMEM、MEM培养基、L-谷氨酰胺、非必需氨基酸及脂质体Lipofectamine2000(Invitrogen公司);抗生素(华北制药);硝酸纤维素膜(PVDF)(Millipore公司);质粒小量提取试剂盒和PCR产物胶回收试剂盒(QIAGEN公司);ELISA相关试剂(北京万泰公司);GAM-HRP(晶美公司);化学发光底物(Thermo公司);IPTG(Isopropyl-β-D-1-thiogalactopyranoside,异丙基-β-D-硫代半乳糖苷)(AMRESCO公司)。
CO2培养箱(美国Forma公司);全湿转印仪、Power Pac 300多用电泳仪(美国Bio-Rad公司);Nikon Eclipse80 正置显微镜、Nikon coolpix990 数码相机(日本 Nikon 公司);酶标仪(奥地利TECAN公司)。
1.2实验方法
1.2.1肽段设计 从GeneBank中下载RSV-A2 L蛋白(KT992094.1)的基因序列,全长2 165个氨基酸。利用DNAstar软件对L蛋白进行亲疏水性分析,避开α螺旋区域并选取亲水区与表面区域肽段(部分截图如图1A),采用15肽展示,相邻肽段之间5肽重叠的方式(如图1B),构建了共161条短肽肽库。使用Blast分析并确定所有肽段具有呼吸道合胞病毒特异性。
1.2.2基因克隆 肽展示片段的扩增与制备:短肽对应的DNA正负链(带EcoRⅠ和BamHⅠ酶切位点)稀释至10 μmol/L,各取10 μl与30 μl ddH2O混匀。按90℃ 10 min,70℃ 10 min,70℃水中退火至室温(25℃)步骤,制备目的片段。通过BamHⅠ与EcoRⅠ双位点酶切、T4连接酶将目的片段重组到HBc149载体上(如图1C)。
常规分子生物学操作,如:普通PCR扩增、质粒酶切鉴定、片段与载体酶切、目的片段与载体连接等参考《分子克隆实验指南》第三版[11];质粒小量提取、小量DNA片段胶回收参考QIAGEN公司相应试剂盒说明书。
1.2.3蛋白表达纯化与复性 从平板上挑选单个DH5α菌落转移至2 ml的LB(加相应抗生素)液态培养基,37℃振荡过夜,再取200 μl加至2 ml的LB液体培养基中37℃振荡2 h,OD600 nm约为0.6;加入IPTG至0.5 mmol/L,设置温度梯度诱导4、6或8 h,4℃、10 000 r/min离心4 min收集菌体,裂解液重悬,冰浴超声破碎菌体;4℃、10 000 r/min离心10 min 后取上清逐滴加入等体积20%或40%饱和硫铵溶液,混匀后静置20 min,3 000 r/min离心10 min,生理盐水溶解沉淀。
将上述溶液置PB5.8缓冲体系(16 mmol/L Na2HPO4、184 mmol/L NaH2PO4、300 mmol/L NaCl和50 mmol/L EDTA用盐酸或氢氧化钠溶液调节pH为5.8即可)中透析,然后在50~65℃水浴30 min,期间不断振荡,至出现蛋白沉淀,4℃、2 000 r/min离心20 min去除沉淀,上清转移到透析袋中并置PB5.8缓冲体系(体积为上清-蛋白样品的20倍以上)中透析,每隔3~4 h换新配的透析液,共3次;再将透析液换为PBS,透析全程用磁力搅拌器搅拌,环境温度为4℃。最后收集透析袋内的样品经4℃ 12 000 r/min离心10 min,上清即为目的蛋白的复性液。
1.2.4小鼠免疫与脾脏免疫 免疫方案:选取 6~8周龄BALB/c雌鼠, 2只/组,经背部皮下、四肢肌肉、腹股沟皮下等注射免疫原(纯化复性蛋白)。注射前,样品(100 μg/只)与佐剂等体积混合,用注射器反复吹吸成乳浊液,4℃放置30 min,用酒精棉球消毒小鼠后进行免疫。初免时,使用完全弗氏佐剂(Complete Freund′s adjuvant,CFA);初免2周后开始第一次加免,使用不完全弗氏佐剂(Incomplete Freund′s adjuvant,ICFA),此后每周加免一针,共加免4次。在第三、四和五周免疫前对小鼠进行眼球采血,血样37℃孵育30 min,12 000 r/min离心10 min,上清-20℃保存待检。上述免疫结束后4~6周进行脾脏免疫:乙醚麻醉小鼠,剖开腹腔外皮取出脾脏,沿脾脏纵向注射100 μg抗原,再用手术针线缝合切口。
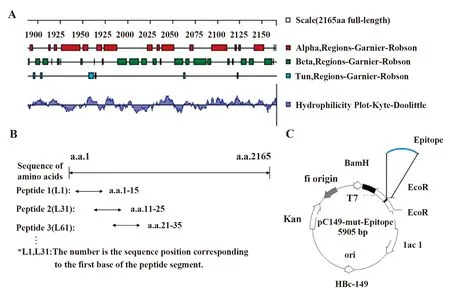
图1 肽段展示、质粒构建与表达Fig.1 Peptide display,construction and expression of plasmidNote:A.Secondary structure analysis of L protein;B.Scheme of peptide display;C.Construction of plasmid
1.2.5细胞融合 在融合之前准备饲养层细胞,将一只年龄为13 d左右的BALB/c小鼠脱颈处死,75%乙醇浸泡5 min消毒。转移至超净工作台,使其腹部朝上,剪开外皮暴露胸腔,取出胸腺,经200目细胞筛研磨后得到胸腺饲养细胞悬液。脾免72 h后,无菌取脾脏制成单细胞悬液与SP2/0细胞融合,采用常规PEG促融合方法。ELISA检测融合细胞分泌上清筛选克隆阳性细胞株;有限稀释法亚克隆细胞株,将阳性孔的细胞转移到24孔板中,再克隆化到96孔板进行培养,挑选单集落细胞孔重复克隆化直到连续出现3次以上的单克隆。
1.2.6间接法酶联免疫吸附分析(ELISA) 蛋白(重组质粒或载体HBc149表达纯化蛋白)用CB(0.05 mol/L pH9.6碳酸盐缓冲液)稀释至0.5 μg/ml,100 μl/孔加至聚苯乙烯板中,4℃过夜;弃掉液体,PBST(PBS+ 0.05%Tween-20)洗一次,2%牛血清白蛋白(PBS配制)封闭,37℃ 1 h;弃去液体,将适当稀释比例的小鼠血清或单克隆抗体加入,37℃孵育1 h;PBST洗5次,加入GAM-HRP酶标抗体,37℃孵育1 h,PBST洗5次;显色液A、B等量混合,37℃反应10~15 min,加终止液(2 mol/L硫酸),用酶标仪单双波长450 nm/630 nm测定OD值。
1.2.7蛋白印迹分析(Western blot,WB) 样品或抗原进行常规SDS-PAGE电泳[11],恒流300 mA,90 min将蛋白转移到硝酸纤维素膜,去离子水漂洗后,用5% 脱脂奶[5 g脱脂奶粉用TN buffer溶解并定容至100 ml,TN buffer(pH8.0)成份:50 mmol/L Tris-HCl,150 mmol/L NaCl]封闭1 h;去离子水漂洗,用TN稀释待检样品,孵育1 h;TNT(TN中加0.05%Tween-20)洗膜3次,每次5 min;用TN稀释的GAM-HRP孵育1 h,洗膜后;去离子水漂洗,化学发光底物流遍膜表面,在ImageQuant LAS 4000化学发光成像仪上进行成像。
1.2.8单克隆抗体IgG亚类鉴定 按照Thermo scientific公司单克隆抗体分型试剂盒说明书操作。
1.2.9免疫荧光 圆形玻璃片(无菌干净)铺入24孔板,每孔加入1×105个Hep2细胞。待细胞贴壁后,RSV A2病毒株以MOI=3感染细胞,36 h后去上清,PBS洗涤;200 μl/孔预冷的4%多聚甲醛,避光10 min;洗涤后,200 μl/孔0.3%Triton X-100,孵育15 min。洗涤后10%山羊血清封闭;一抗稀释合适梯度孵育1 h,洗涤后避光孵育FITC标记的GAM二抗(PBS稀释)1 h,PBS洗涤;DAPI(PBS稀释)避光孵育5 min,PBS洗涤;在载玻片上滴加封片剂(70%甘油,2.5%防淬灭剂),玻片有细胞面朝下盖上去,吸取多余液体,用指甲油封闭玻片四周,避光晾干。显微镜下观察,并采集图像。
1.3统计学处理 核酸序列分析与比较采用Blast软件和DNAstar软件;数据做图采用GraphPad Prism 7.0;图片处理采用ImageJ及Adobe Photoshop CS6软件。
2 结果
2.1免疫原制备
2.1.1基因克隆 本研究中,我们选择L蛋白非疏水区肽段进行肽段展示,目的片段合成后重组到HBc149载体上,随后进行质粒转化及质粒小提。为了减少工作量,我们对菌液PCR体系及程序进行调试,使得目的条带在500 bp处,并得到了117个阳性克隆。经测序及序列比对,共有102个正确的重组质粒可用于下一步实验。
2.1.2重组蛋白表达与纯化 将经过鉴定的102个质粒转化进ER2566菌株感受态中,加入IPTG使目的蛋白在上清中大量表达,发现IPTG在诱导温度为30℃时诱导效果最好。20%和40%饱和硫胺纯化蛋白,显示40%硫胺较好纯化目的蛋白(如图2A)。前期实验中发现,硫胺溶液的温度会影响纯化效率。因此,我们对加热温度进行调试,分别设置45℃、50℃、55℃和60℃,最后采用55℃为热处理温度(如图2B)。
2.2单克隆抗体的制备
2.2.1小鼠免疫及免后血清分析 重组质粒表达纯化后,获得28种目的蛋白可用于免疫小鼠,免疫方案见图3A。以Full-L质粒转染293FT细胞裂解液为样品进行WB分析,第五周血清结果(如图3B),显示只有L2269、L3935和L4099这3组免疫蛋白的血清有较强阳性条带(如图3B),暗示这些肽段可能是L蛋白的线性表位,能有效刺激机体产生大量L蛋白特异性抗体。ELISA检测免疫后小鼠血清中针对免疫原的抗体水平,第五周血清的反应性检测结果以EC50(血清的稀释倍数)表示(如图3C),发现28种免疫蛋白均能刺激小鼠产生较好的免疫应答。为确认血清反应性,挑选了WB 阳性较强的L3935和L4099两组血清重复WB检测,以病毒感染的Hep2细胞裂解液为对照(如图4),发现这两种免疫原激发的血清抗体既能与质粒转染表达的L蛋白反应,也能与天然表达的L蛋白相互作用。
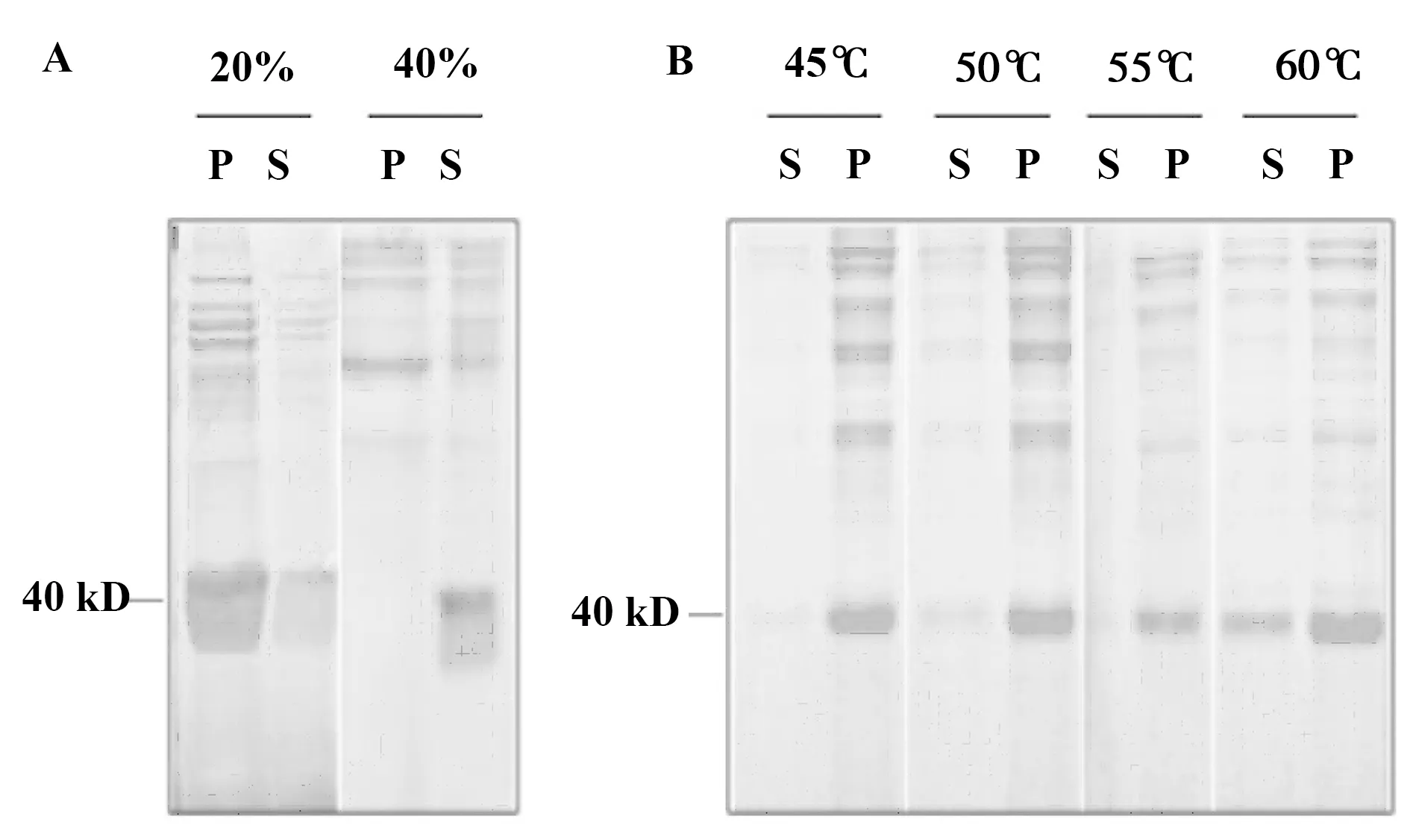
图2 不同浓度硫铵(A)和热处理温度(B)的对比Fig.2 Comparison of different concentrations of Ammon-ium sulphate(A) and temperature of heat treatment(B)Note:P.Precipitate;S.Supernatant.
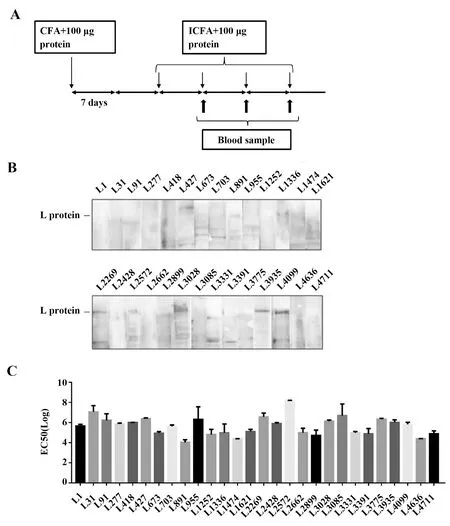
图3 小鼠免疫及免疫血清检测Fig.3 Mouse immunization and serum detectionNote:A.Immunization scheme;B.Western blot;C.Reactivity.
2.2.2L蛋白抗体筛选 根据免疫血清检测结果,选择血清反应性与WB阳性较强的L3935和L4099两组小鼠进行脾脏免疫、融合与单克隆细胞筛选,情况见表1所示,将得到的单克隆细胞分别进行细胞冻存和腹水纯化抗体。
2.2.3单克隆抗体鉴定 将11株单克隆抗体进行IgG亚类分型、ELISA检测EC50(如表2)和单抗性质鉴定与分析(如图5)。亚类分型结果为:3株IgG1、3株IgG2a、2株IgG2b、3株IgG3,分布均匀,没有表现亚类偏向性;14A10和9H3的EC50数值较小,分别为0.032 μg/ml和0.093 μg/ml,说明这两株抗体对相应的免疫原的亲和力较强。WB检测结果显示:L3935有2株(13G4和14A10),L4099有3株(2F7、9H3和13G2)WB显示阳性(如图5A);SDS-PAGE分析(如图5B)可见单克隆抗体的轻、重链均单一。
随后,挑选14A10、9H3两株单抗进行免疫荧光实验,对RSV A2感染的Hep2细胞内L蛋白进行定位(如图6)。蓝色为DAPI对细胞核的染色,绿色为GAM-FITC指示L蛋白;结果显示L蛋白定位于宿主细胞的细胞膜表面、包涵体以及核区。
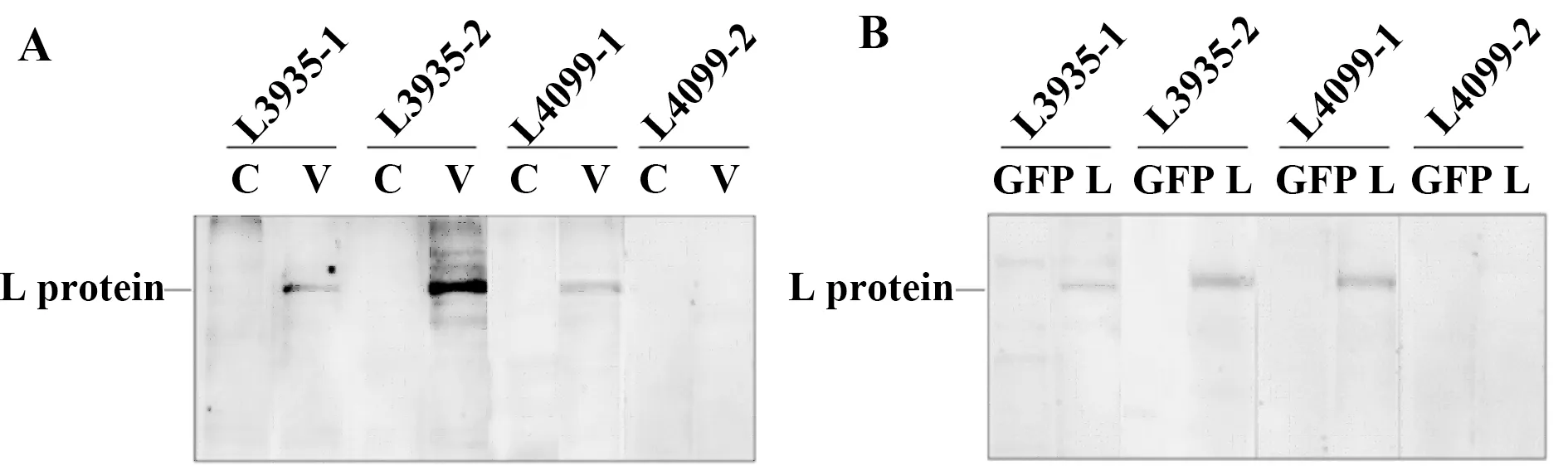
图4 部分血清Western blot分析Fig.4 Western blot of partial serumNote:A.Lysate of cells virus infected;B.Lysate of cells transfected with L plasmid;C.Lysate of Hep2 cells;L.Lysate of 293FT cells transfected with L plasmid;V.Lysate of Hep2 cells RSV A2 infected;GFP.Lysate of 293FT cells transfected with GFP plasmid.
表1融合与筛选情况
Tab.1Summaryoffusionandscreeningconditions
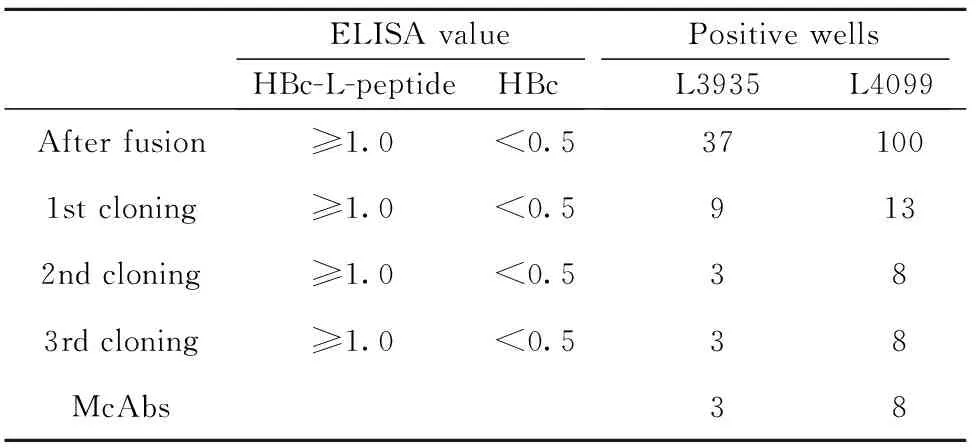
ELISA valueHBc-L-peptideHBcPositive wellsL3935L4099After fusion≥1.0<0.5371001st cloning≥1.0<0.59132nd cloning≥1.0<0.5383rd cloning≥1.0<0.538McAbs38
表211株单抗分型及反应性
Tab.2Subtypesandreactivityof11McAbs

McAbs13E213G414A102F75D89H310C810D610F1012H913G2SubtypeIgG2aIgG3IgG1IgG3IgG2bIgG2aIgG1IgG3IgG2bIgG2aIgG1EC50(μg/ml)0.1410.1410.0322.0320.6120.09345.421.3118.9645.7290.173
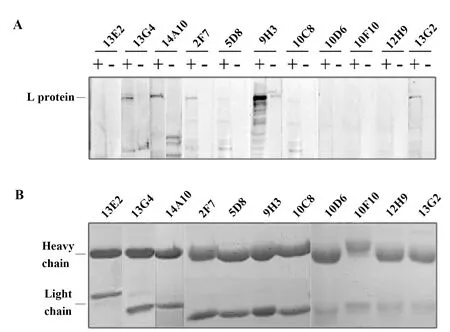
图5 11株单抗WB(A)和SDS-PAGE(B)分析Fig.5 Western blot(A)and SDS-PAGE(B)analysis of 11 McAbsNote :+.Lysate of Hep2 cells RSV A2 infected;-.Lysate of Hep2 cells.
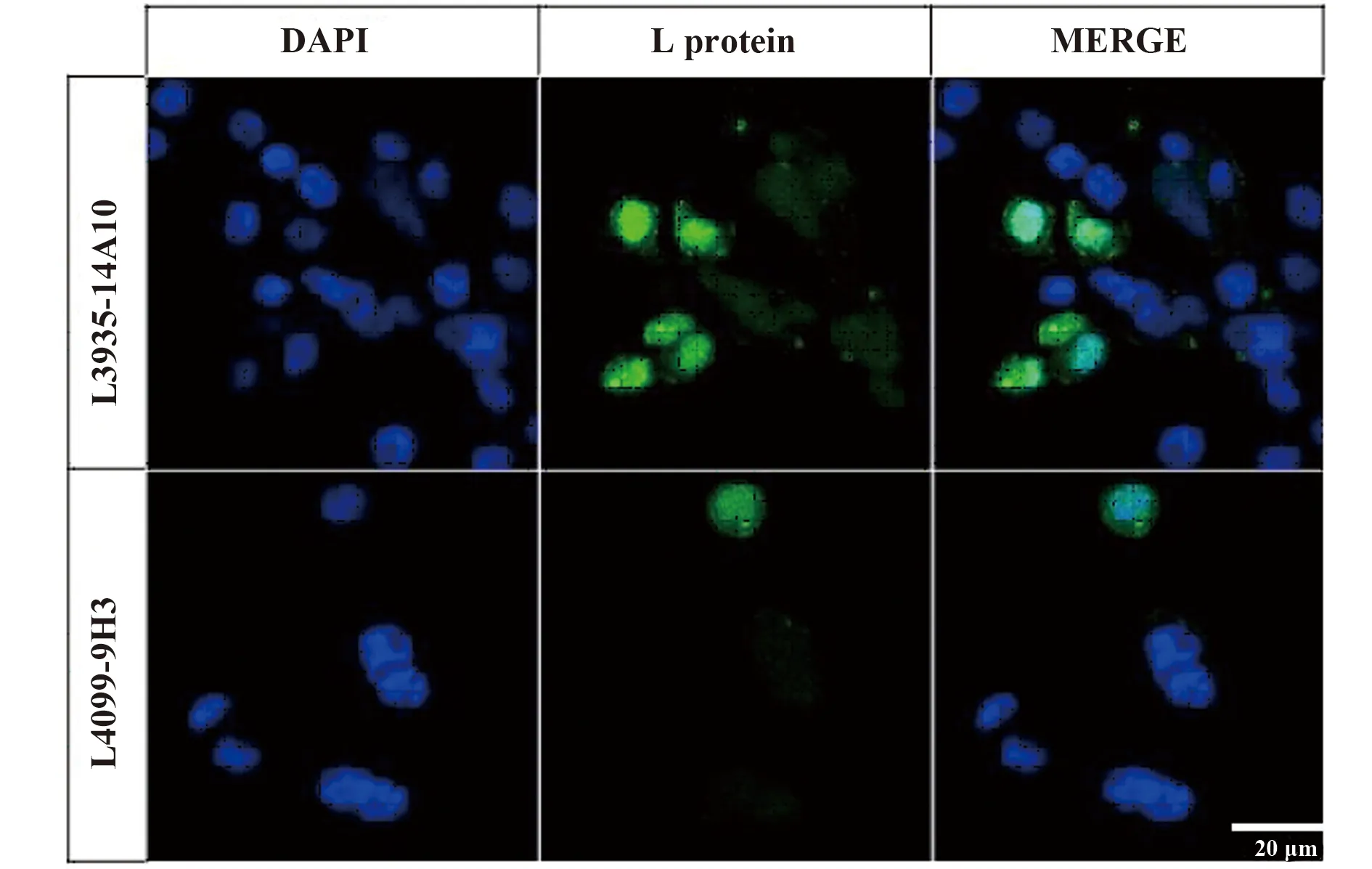
图6 RSV感染的Hep2细胞内L蛋白定位Fig.6 Localization of L protein in Hep2 cells RSV infected
3 讨论
一份全球疾病死亡率分析报告显示,一周岁以内的儿童死亡约有6.7%是由RSV感染引起的[12],是仅次于肺炎链球菌及副流感嗜血杆菌引起儿童下呼吸道感染死亡的第三大病原体;老年人感染RSV后会出现严重的症状甚至死亡[13,14],目前针对RSV感染尚无有效治疗及预防措施。而对RSV感染的发病机制及机体抵抗RSV的免疫机制进一步理解有助于为RSV疫苗的研究提供新的线索、为主动免疫预防RSV的疫苗研发开拓新的思路,从而有望减轻因RSV造成的全世界范围内医疗负担。L蛋白的研究在RSV感染机制研究中占有重要地位,不可或缺。能用于免疫印迹及免疫荧光实验的单克隆抗体-14A10和9H3的制备,对RSV L蛋白的结构以及结构与功能的关系研究、RSV的生物学作用以及病毒感染机制研究提供基本实验检测材料。
本研究中免疫原制备前期,我们直接选择表面亲水非二级结构区域进行肽段展示的策略大大减少了不必要的工作量。考虑到基因工程抗原免疫原性较弱,我们采用初免混合完全弗氏佐剂,2周后加强免疫混合不完全弗氏佐剂,每周一次共4针加免的免疫方案;ELISA和WB检测结合的方式挑选能激发高亲和力血清抗体的免疫原;阳性细胞株筛选过程中,利用“双抗原筛选”的间接ELISA方法,不仅排除了血清抗体中针对载体HBc149的那部分抗体、避免假阳性的干扰,也大大提高了筛选抗体的准确性。最终获得11株抗L蛋白单克隆抗体,5株显示WB阳性条带,其中14A10和9H3有较好的WB反应性;并免疫荧光实验对病毒感染后细胞内L蛋白进行定位;免疫荧光实验中L蛋白定位细胞膜表面可能指示正在出胞的RSV病毒颗粒;有报道显示RSV L、P及N蛋白和病毒RNA共定位于宿主细胞包涵体内,进行病毒核酸复制与转录[7,8,10]。另有报道显示L蛋白定位于被RSV感染的Hep-2细胞核周包涵体,暗示N、P和L可能与核膜有紧密联系[15];图拉病毒(Tula virus)聚合酶L蛋白是一种负链RNA病毒来源的被描述为核周膜相关的蛋白[16];而L蛋白在被感染细胞中的核特异性,提示L蛋白可能拥有其他未知功能,为RSV感染机制研究提供了新的信息。