xCT和促血管生成因子在胶质瘤组织中肿瘤相关巨噬细胞的表达及意义①
2018-10-12陈黛诗郑朝攀杜甲珺胡继良
陈黛诗 郑朝攀 杜甲珺 胡继良
(深圳市人民医院,暨南大学附属第二临床医学院,深圳518020)
脑胶质瘤是最常见的中枢神经系统恶性原发性肿瘤,占颅脑肿瘤的40%~50%[1]。 其中,胶质母细胞瘤(Glioblastoma,GBM)呈高度侵袭性生长,对放疗、化疗不敏感,目前的治疗主要是姑息性的,预后极差,复发率高。 未经治疗的GBM的存活率仅约5个月。 即使是运用手术、化学治疗、放射治疗等辅助疗法,中位生存期不超过14.6个月[2,3]。胶质瘤的预后好坏与肿瘤的生长速度和浸润侵袭速度有一定的关系,因此,研究脑胶质瘤的生长速度和浸润侵袭机制对于寻找临床治疗的分子靶点,提高患者生存率和延长生存时间具有重要的意义。
肿瘤相关巨噬细胞(小胶质/巨噬细胞,TAMs)主要是外周循环血液中的单核细胞,在正常的大脑中主要是小胶质细胞。当脑实质存在恶性胶质瘤时,血脑屏障受损,胶质瘤细胞来源的细胞因子和趋化蛋白促进小胶质细胞和血液中的巨噬细胞迁移到肿瘤微环境中增殖、分化形成TAMs[4-6]。TAMs可以通过表达一些生长因子(如表皮细胞生长因子)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)和细胞因子(如IL-6)等促进胶质瘤细胞的增殖,新生血管生成,同时,抑制微环境免疫反应促进肿瘤向周围组织浸润转移[6-8]。因此,TAMs在脑胶质瘤的发生和进展过程中具有重要作用,因此有望成为胶质瘤治疗的新靶点。
由于胶质瘤细胞快速增殖需要更多的谷胱甘肽(L-Glutathione,GSH)来应对高水平的氧化伤害,因此,胶质瘤细胞相比正常细胞表达更高的谷氨酸反转运蛋白xCT[9]。xCT表达上调保护胶质瘤细胞免受氧化应激损伤,促进肿瘤的发生、发展,并且增加了化疗(替莫唑胺)的耐药性[10]。但是关于xCT在TAMs中的表达和作用鲜有报道[11],因此本研究拟采用荧光免疫染色、荧光实时定量RT-PCR,TAMs培养技术探讨在脑胶质瘤中TAMs是否通过xCT表达促进肿瘤的发展,以及TAMs在胶质瘤微环境中的作用,为胶质瘤的治疗提供新的思路。
1 材料与方法
1.1一般资料 收集2010~2015年本院经手术后病理证实的人脑胶质瘤组织,组织采集后立即置液氮中长期保存备用。胶质瘤组织按WHO胶质瘤分级标准Ⅱ级16例,Ⅲ级16例,Ⅳ级16例。
1.2方法
1.2.1TAMs的分离和培养 手术切除的新鲜脑胶质瘤组织切成碎片,用胶原酶消化,37℃消化 1 h,制成细胞悬液;40 μm无菌细胞过滤器,形成单细胞悬液;将悬液离心800 r/min,5 min,弃上清后冷PBS冲洗,用不含血清的 RPMI1640培养基重悬细胞加入T75培养瓶中,37℃、5%CO2孵育箱中培养。
1.2.2免疫荧光染色 组织常规OCT胶包埋切片后,0.3% TritonX-100透化15 min,5%正常羊血清+3%BSA室温封闭30 min;依次加入xCT羊多克隆抗体(1∶300)和CD68鼠单克隆抗体(浓度1∶300),4℃孵育过夜;加FITC标记的二抗(1∶1 000),室温避光孵育;Hoechst33258染核(1∶10 000),封片,Zeiss荧光显微镜观察、照相;设对照组,用PBS代替一抗,其余步骤同上。
1.2.3Real time PCR检测 用Trizol提取细胞和组织总RNA,通过NanoVueTMPlus分光光度计测定RNA浓度。 使用SuperScript®III逆转录酶合成cDNA。采用LightCycler480全自动荧光实时定量PCR仪(Roche)检测。以GAPDH为内参。xCT上游引物5′-CCC AGA TAT GCA TCG TCC-3′,下游引物5′-GCA ACC ATG AAG AGG CAT GT-3′,CD14上游引物5′-GCA ACA CAG GAA TGG AGA-3′;下游引物5′-AGC GAA CGA CAG ATT GAG-3′;CD86上游引物5′-CTT CTC TGC TGC TGT AAC-3′,下游引物5′-CTT CTG CTG TGA CCT AAT ATC-3′;Arg-1上游引物5′-GGC AGA AGT CAA GAA GAA-3′,下游引物5′-GTT GTC AGT GGA GTG TTG-3′;CD209上游引物5′-CAG CAC ATC CTC ACA GAA-3′,下游引物5′-CCA ACA TCC AGT CCT ACC-3′;GAPDH上游引物5′-ATG AGA AGT ATG ACA ACA GCC-3′,下游引物5′-AGT CCT TCC ACG ATA CCA AAG-3′。PCR反应条件为:95℃,变性5 min; 94℃,15 s,56℃,30 s,72℃,30 s,共40个循环。每个PCR反应设3个复孔,结果取3次平均。利用公式2-ΔΔCT计算mRNA水平的相对变化。
1.3统计学处理 采用SPSS17.0统计包进行统计学处理,均数差异采用单因素方差分析(One-way ANOVA),组间比较采用SNK法,检验水准为α=0.05,P<0.05表示差异有统计学意义。
2 结果
2.1xCT和CD68在脑胶质瘤中的表达 通过免疫荧光染色方法,可以观察到xCT和CD68均在胶质瘤中表达,并且xCT和CD68在胶质母细胞瘤(WHO°Ⅳ)组织中的阳性细胞表达强度明显高于WHO°Ⅱ胶质瘤的阳性细胞表达强度 (图1)。CD68是小胶质细胞和巨噬细胞特异性分子标志物[12]。所以,xCT和CD68共同表达于胶质瘤的小胶质细胞中,随着胶质瘤级别的增高,阳性表达程度不断增加,提示二者之间具有相互协同作用。
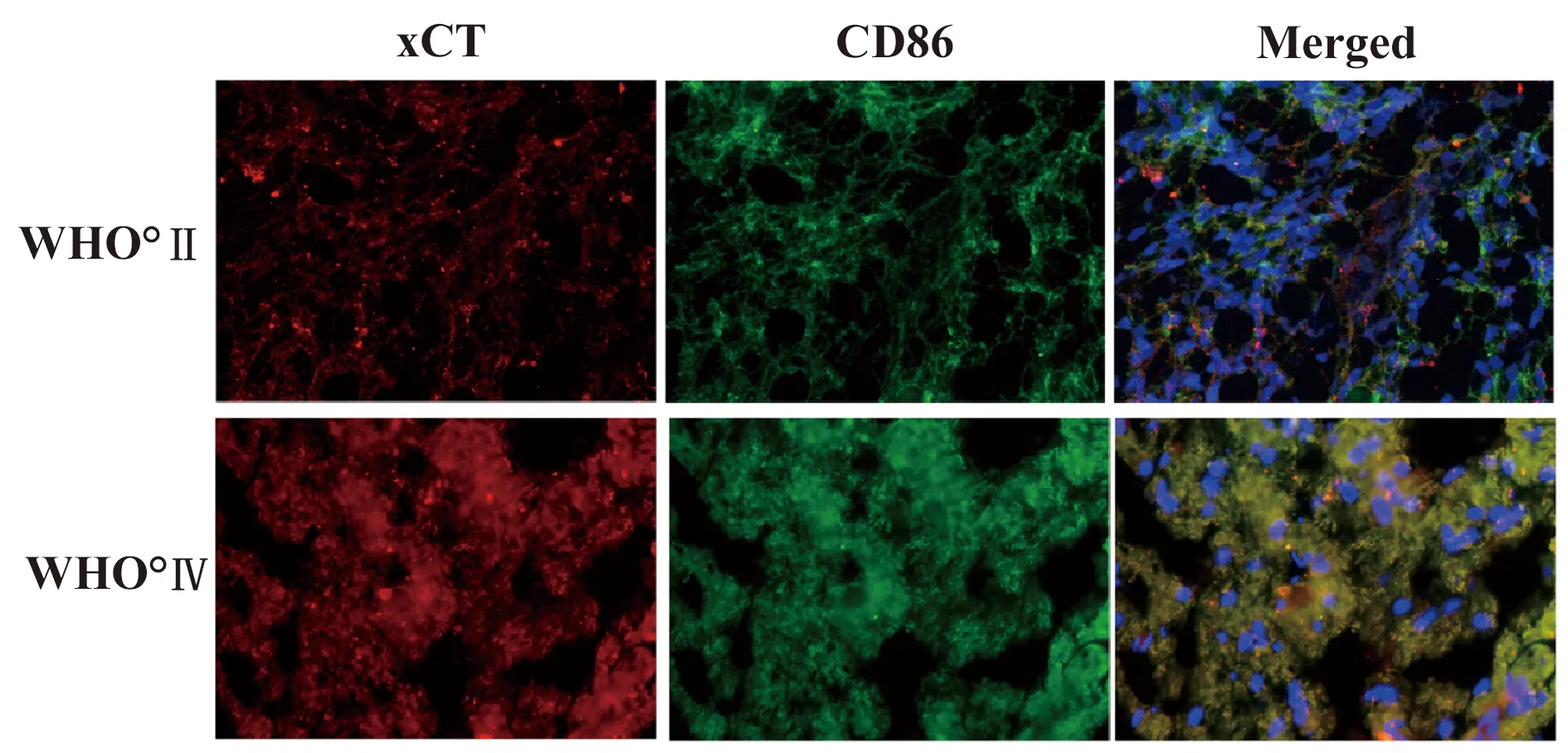
图1 胶质瘤中xCT和CD68的表达(免疫荧光染色,×200)Fig.1 Expression of xCT and CD68 in gliomas(Immunofluorescence staining,×200)Note:Red.xCT positive cells;Green.CD68 positive cells;Blue.Nucleus.
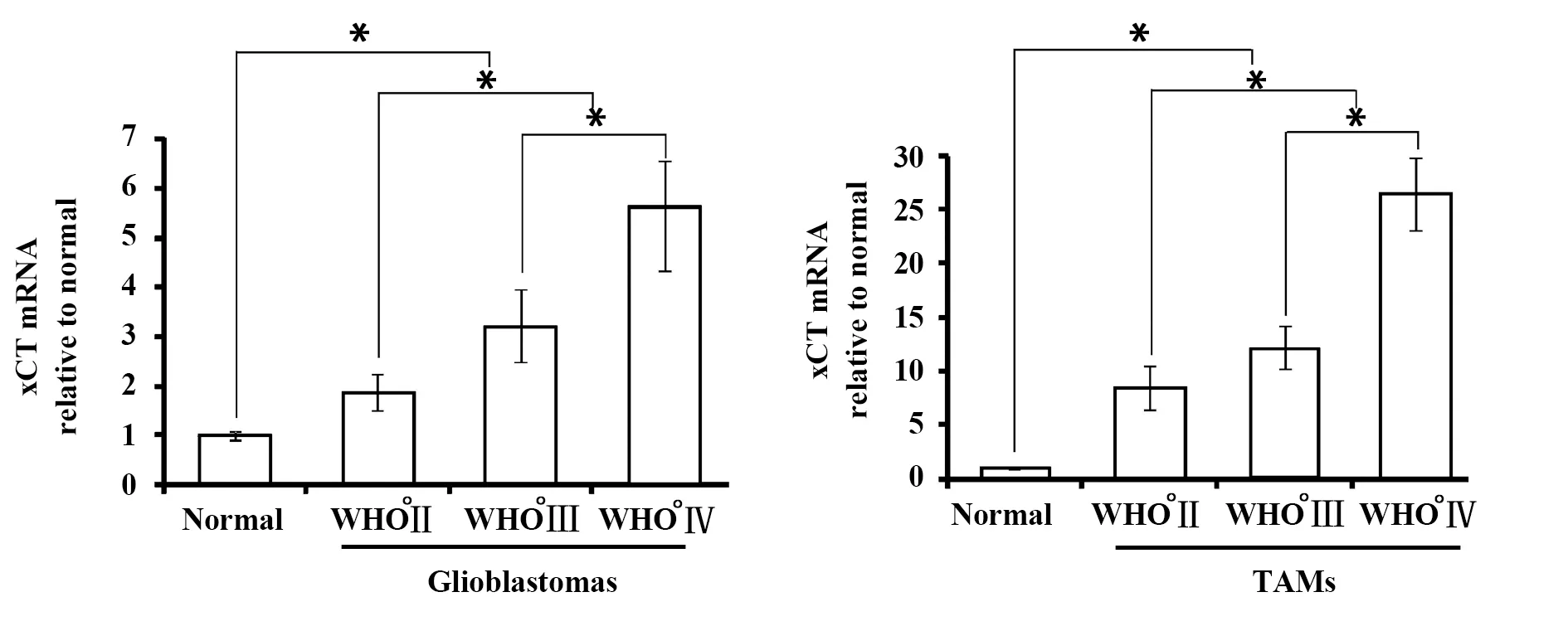
图2 胶质瘤和胶质瘤分离得到的TAMs中xCT mRNA表达水平Fig.2 mRNA levels of xCT in gliomas and gliomas-derived TAMsNote:*.P<0.05.
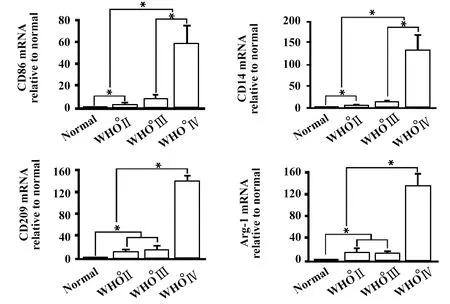
图3 胶质瘤分离得到的TAMs中M2表型标记物(CD14和CD86)和促血管生成因子(Arg-1和CD209) mRNA表达水平Fig.3 mRNA levels of M2 markers(CD14 and CD86) and pro-angiogenic markers(Arg-1 and CD209) in gliomas-derived TAMsNote:*.P<0.05.
RT-PCR检测可见胶质瘤组织中和从分离得到的TAMs中xCT mRNA水平与胶质瘤分化程度相关 (图2),WHO°Ⅳ胶质瘤中的xCT mRNA水平比WHO°Ⅰ~°Ⅲ胶质瘤和正常脑组织增加(P值均<0.05)。
2.2RT-PCR检测TAMs中M2表型标记物和促血管生成因子的mRNA表达 检测结果显示,TAMs中小胶质细胞M2表型标记物CD14和CD86 mRNA表达水平随着胶质瘤恶性程度相应地上调(图3)。同时,小胶质细胞M2表型标记物的上调提示活化状态的TAMs数目增加,支持TAMs在胶质母细胞瘤发展中的潜在作用。另外,与WHO°Ⅰ~°Ⅲ胶质瘤和正常脑组织的TAMs相比,胶质母细胞瘤(WHO°Ⅳ)组织中促血管生成因子Arg-1和CD209 mRNA表达水平明显增高(图3)。
3 讨论
中枢神经系统(Central nervous system,CNS)是具有独立的“免疫特权”部位,以保护其重要的功能不受免疫介导的炎症损伤。小胶质细胞作为CNS主要的免疫应答细胞,在CNS受到损伤和病理过程中小胶质细胞发挥了广泛的先天和适应性免疫作用[13]。在正常生理状态下小胶质细胞处于静息态,但在一定条件下,尤其在胶质瘤中,通过肿瘤微环境中一些细胞因子(如IL-6和IL-10)和表皮生长因子等作用,静息态小胶质细胞能够向M2型转化,从而显著地促进胶质瘤的恶性程度[14-16]。另外,小胶质细胞数量在胶质瘤中明显增加,发挥着联系“免疫特权”中枢神经系统部位和外周免疫系统之间的桥梁作用,与胶质瘤细胞相互作用,这一特性使得它们成为胶质瘤免疫治疗的潜在候选靶点。
CD68是巨噬细胞核和小胶质细胞特异性标志物,其表达与肿瘤分化程度相关[17]。在本研究中,通过免疫荧光染色也观察到与分化程度高的胶质瘤组织比较,CD68阳性TAMs在分化程度差的胶质瘤组织中数量明显增多。xCT是定位在细胞胞质胱氨酸/谷氨酸反向转运体,通过摄取胞外胱氨酸、排出胞内谷氨酸调控细胞代谢和抗氧化应激,与肿瘤的生长分化、浸润和预后密切相关[18-20]。更重要的是,xCT在胶质瘤中过表达增强了胶质瘤对化疗和放疗的不敏感性[21,22]。本研究发现在胶质母细胞瘤中CD68和xCT表达水平明显高于分化程度高的胶质瘤和正常组织,且xCT与CD68共同表达于小胶质细胞。提示在恶性程度高的胶质瘤中TAMs数量明显增加,xCT表达水平也随着胶质瘤恶性程度增加而增高。TAMs中xCT表达增加提示TAMs抗氧化等能力增强,摄取更多的胱氨酸和维持细胞内谷胱甘肽水平,以保证在肿瘤微环境缺氧状态下细胞内氧化还原平衡。另外,缺氧的肿瘤微环境诱导更多的TAMs聚集,分泌更多的谷氨酸,促进其与胶质瘤细胞之间信号联系,形成胶质瘤细胞浸润的通道。
本研究发现TAMs向免疫抑制M2态转化,TAMs活化程度与胶质瘤的分化程度密切相关,可作为胶质瘤患者预后指标之一。本研究发现在胶质母细胞瘤中,M2型TAMs表达明显上调的同时,促血管生成因子的表达水平也显著增加。有研究表明,M2型TAMs在胶质瘤微环境中不能激活T细胞的抗肿瘤反应,而通过分泌多种生长因子(如VEGF,转化生长因子-β1和肝细胞生长因子等)、细胞因子(IL-6和IL-18等)和基质金属蛋白酶等来上调肿瘤细胞的浸润转移能力,促进新生血管和淋巴管生成,诱导微环境的免疫抑制状态而促进肿瘤的发生、演变[6,8,23,24]。因此,M2型TAMs在胶质瘤中有重要的作用,诱导异常新生血管的形成,导致胶质瘤细胞增殖和向周围组织浸润,从而促进胶质瘤的发展。
总之,胶质瘤组织中肿瘤相关巨噬细胞作为胶质瘤微环境中的重要免疫细胞,与胶质瘤的发生、发展及不良预后密切相关,如何调控TAMs为胶质瘤的治疗预后提供了新的思路。 其能够通过xCT过表达,促炎症因子和促血管生成因子促进胶质瘤的发展。肿瘤中M2表型的肿瘤相关巨噬细胞募集与脑胶质瘤的不良预后相关。