不同高程消落带古菌群落组成与分布特征
2018-10-11吴晓冰吴胜军
叶 飞 ,吴晓冰 ,3,姜 毅 ,吴胜军 ,王 雨 *
(1.中国科学院 重庆绿色智能技术研究院,重庆 400714;2.中国科学院 水库水环境重点实验室,重庆 400714;3.中国科学院大学 北京 100049)
Woese和Fox在20世纪80年代提出了由古菌、细菌和真核生物组成的三域系统[1]。古菌是地球生物圈中一类丰富且多样的微生物,广泛地分布于地球的各类环境中[2-5]。据估算,土壤中古菌数量占所有微生物的比例高达12%~38%[6]。数量庞大的古菌在生物地球化学过程中起着十分重要的作用。在碳循环中,产甲烷古菌产生的甲烷占全球甲烷排放量的70%[7]。除此之外,古菌还积极参与硫循环,能将二硫化碳(CS2)快速转化为硫化氢(H2S)和CO2[8]。进行化能自养的氨氧化古菌(AOA)能将NH3氧化为NO2-[9]。AOA的发现彻底改变了氨氧化过程由细菌驱动的认识,它们在自然界中的庞大数量意味着其在自然界物质转化,尤其是全球碳氮循环方面扮演重要角色[3,7]。
古菌群落的分布受到沿生态梯度性的生物和非生物因素的影响[10,11]。许多环境因子都可以影响古菌群落,如海拔[12]、盐度[13]、氧化还原电位[14]以及pH[15]。土壤水分含量被认为是比区域或季节性变化、生境差异等因素对古菌群落影响更大的环境因子[16]。因此,消落带水位波动可能会极大地影响其古菌群落的分布[17]。
为满足发电、排沙和防洪的需求,三峡水库采取“蓄清排浑”的运行方案,周期性的水位涨落,在三峡库区周边形成了涨落幅度高达30 m的消落带,其总面积达到349 km2,为中国面积最大的水库消落带[18]。三峡库区消落带水位涨落幅度大,水位涨落与自然洪枯规律相反。古菌有可能在消落带碳氮循环过程中发挥重要作用,但是对于三峡消落带中古菌群落沿高程的分布特征还鲜有报道。本文以不同时间不同高程的消落带土壤为研究对象,通过高通量测序数据分析消落带古菌群落多样性和结构沿高程的分布特征。
1 材料与方法
1.1 研究区与样品的采集
白家溪消落带研究区位于重庆市开州区澎溪河湿地市级自然保护区(31°09′02″N,108°3′45″E,图1)。该区域属于中亚热带湿润季风气候,年平均气温18.5℃,四季分明,年均降雨量大约1 200 mm,雨季长、雨日多、降水丰富。土壤类型以发育自紫色砂岩的紫色土为主。
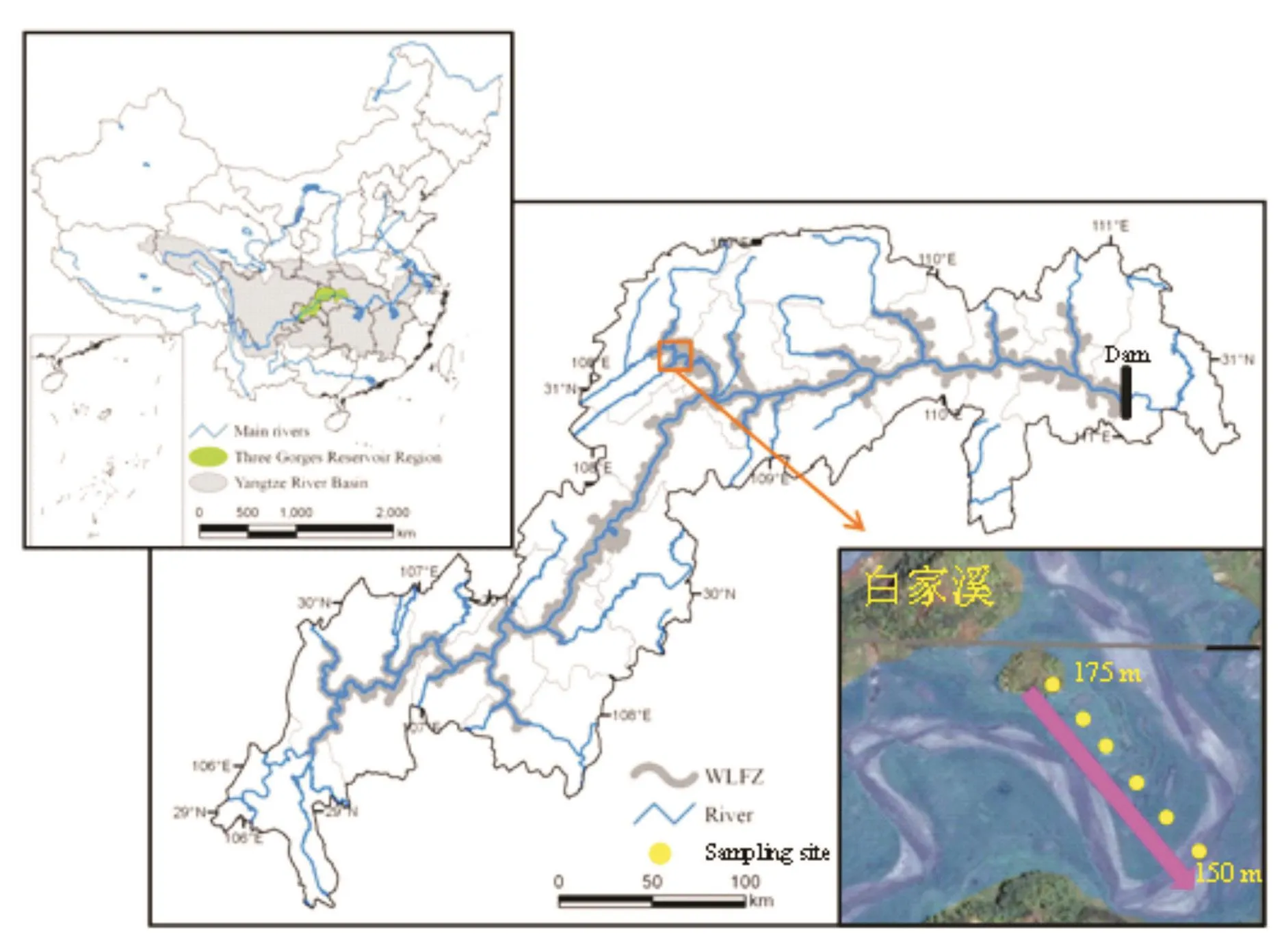
图1 研究区和采样点示意图Fig.1 The maps of the study region and sampling sites
为调查不同高程古菌的群落分布特征,分别在消落带水位上升初期的2013年10月10日和2014年9月23日,以及水位下降末期的2014年4月1日和2015年5月6日共进行2年4次土壤样品的采集。以海拔150 m为最低点,沿消落带150~175 m海拔高程选择一个垂直样带,每隔5 m设置采样点。每个采样点采集3个子样品充分混合成1个混合样,共形成24个混合样。样品采集后放置于无菌密封袋,于冰盒中保存运输至实验室。其中1份立即进行理化指标分析,另1份于-20℃储存,用于DNA提取和后续分子生物学实验。
1.2 土壤性质分析
土壤pH采用pH计(FE20,Mettler Toledo,USA)测定,水土比为1∶5。含水率用烘干称重法测定。土壤NH4+和NO3-的含量用2 mol/L KCl浸提后采用连续流动注射分析仪(FIA Star 5000,FOSS Tecator,Sweden)测定浸提液得到。土壤有机质(OM)采用烧失量法测定。总碳(TC)、总氮(TN)和总硫(TS)用元素分析仪(Vario EL cube,Elementar,Germany) 测定[19]。
1.3 DNA提取与Illumina高通量测序
土壤样品采用Power Soil®DNA Isolation Kit(Mobio,USA)试剂盒提取样品中的总DNA。用超微量紫外分光光度计NanoVue Plus Spectrophotome⁃ter(GE Healthcare,UK)确定DNA浓度。用质量浓度为1%的琼脂糖凝胶电泳检验DNA的质量。提取的DNA溶液保存于-20℃冰箱中待用。
针对古菌16 S rRNA基因的V3~V5高变区,使用带barcode的引物Arch344F(5′-ACGGGGYG⁃CAGCAGGCGCGA-3′) 和 Arch915R (5′-GT⁃GCTCCCCCG CCAATTCCT-3′)[20]进行PCR扩增。扩增采用TransGen AP221-02(TransGen,China)的20 μL体系,具体为:5 μL 5 × FastPfu buffer,2 μL dNTPs(脱氧核糖核酸,2.5 mmol/L),0.3 μL FastPfu DNA聚合酶(2.5 U),正、反向引物(5 μmol/L)各0.8 μL,0.2 μL BSA(牛血清白蛋白,20 μg/μL)(TaKaRa,中国大连),DNA模板(10 ng),双蒸水补足至20 μL。PCR扩增程序为:95 °C预变性3 min,然后95 °C变性30 s,55 °C退火30 s,72°C延伸45 s,共32个循环,最后再72°C延伸10 min。扩增所用的PCR仪为ABI GeneAmp®9700。PCR产物使用AxyPrep DNA凝胶回收试剂盒(AXYGEN,USA)纯化后用2%琼脂糖凝胶电泳进行检测。参照电泳初步定量结果,将PCR产物用QuantiFluor™-ST蓝色荧光定量系统(Promega,USA)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合后双端(PE)测序(2×300)。本研究的Illumina高通量测序委托上海美吉生物医药科技有限公司(http://www.Majorbio.com)在Illumina Miseq PE300平台上完成。在1个淹水周期内,160 m样点的淹水和出露时间与165 m样点非常接近,因此在进行高通量测序及后续相关分析过程中将160 m高程采集的样品排除在外。
1.4 高通量测序序列处理与分析
MiSeq测序得到的是双端序列数据,首先根据PE reads之间的overlap关系,将成对的reads拼接(merge)成一条序列,同时对reads的质量和拼接的效果进行质控过滤,根据序列首尾两端的bar⁃code和引物序列区分样品得到有效序列,并校正序列方向,进行数据优化。
优化后的高质量序列使用Usearch软件(vse⁃sion 7.0,http://drive5.com/uparse/)在97%的相似度下划分独立操作单元(OTUs,Operational Taxo⁃nomic Units)。为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对OTU代表序列进行分类学分析,分析比对使用SILVA rRNA数据库(Release 128 http://www.arb-silva.de)。基于得到的OTU数据,采用Mothur(version v.1.30.1)计算各个样品的α多样性指数(包括shannon多样性、Chao1丰富度和shannon均匀度)。为了便于比较各样品间的差异性,根据测序样品中的最小序列数将所有样品的序列稀释到同一测序深度(每个样品21 068条序列)。
1.5 统计分析
不同高程土壤理化性质和古菌群落多样性差异利用IBM SPSS Statistics 20.0 for Windows的单因素方差分析(One-way ANOVA)进行比较。基于Bray-Curtis距离的主坐标轴分析(Principal Coordi⁃nates Analysis,PCoA)通过CANOCO 5软件实现。使用HemI软件(Heatmap Illustrator,版本1.0)绘制基于平均连接聚类(计算出的两个聚类之间的距离)和欧几里德距离(两组之间计算的距离)的古菌群落结构热图。其他图形绘制使用ORIGIN 9.0软件完成。
2 结果
2.1 古菌群落α多样性
基于古菌16 S rRNA基因的Illumina高通量测序数据,对不同高程消落带土壤中古菌群落的α多样性进行评估,包括Shannon多样性指数、Shan⁃non均匀度指数和Chao1丰富度指数。结果(图2)发现,消落带土壤古菌α多样性3个指标的最大值都出现在150 m高程,而最小值都出现在175 m高程,并且表现出随着采样高程的增加而逐渐降低的趋势。
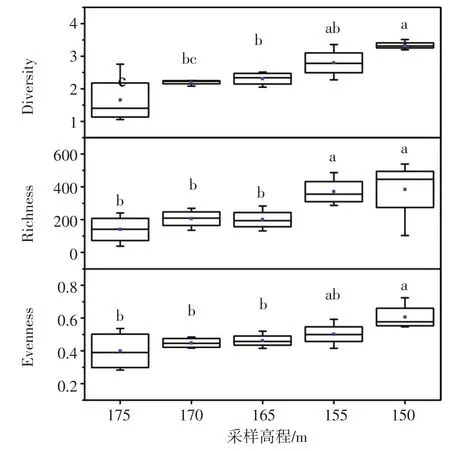
图2 不同采样高程古菌群落α多样性。箱图上方的字母不同表示不同高程间的指数存在显著差异(P<0.05)Fig.2 Alpha-diversity of archaeal communities along the sampling elevations.Different letters above the boxes denote a significant difference between different elevations(P<0.05)
2.2 古菌群落组成
采用基于Bray-Curtis距离的主坐标轴分析(PCoA),对不同高程消落带土壤古菌群落结构进行分析(图3)。可以发现,不同高程样点表现出从175 m到150 m的梯度性。其中,155 m和150 m高程样点能很好地聚集在一起,表明这两个高程土壤中的古菌群落结构较为类似。175 m和170 m高程样点古菌群落同样有着较好的聚集性。而165 m高程样点处于从较高高程到较低高程的过渡区域,其土壤古菌群落结构与其他高程相比差异较大。
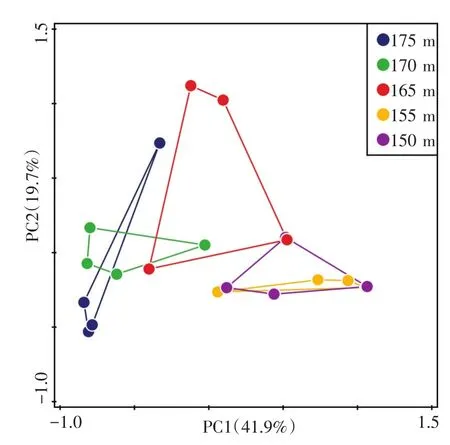
图3 基于Bray-Curtis距离不同采样高度的土壤中古菌群落的主坐标轴分析(PCoA)Fig.3 Principal coordinate analysis(PCoA)based on Bray-Curtis distance for aracaeal communities in soils along the sampling elevations
从门水平上可以看出,奇古菌门(Thaumar chaeota)和广古菌门(Euryarchaeota)是消落带土壤古菌两个优势门(图4)。随着采样高程的升高,奇古菌门的相对丰度表现出逐渐上升的趋势。在175 m、170 m和165 m三个高程土壤中奇古菌门的相对丰度均超过50%,分别为95.6%,83.5%和71.5%,是优势门。而广古菌门是155 m和150 m高程土壤的优势门,其相对丰度分别为68.0%和55.6%。其他的古菌门,如深古菌门(Bathyarchaeota)、乌斯古菌门(WoesearchaeotaDHVEG-6)在各高程样点中的相对丰度都较少,但总体表现出随着采样高程的降低而增加的趋势。
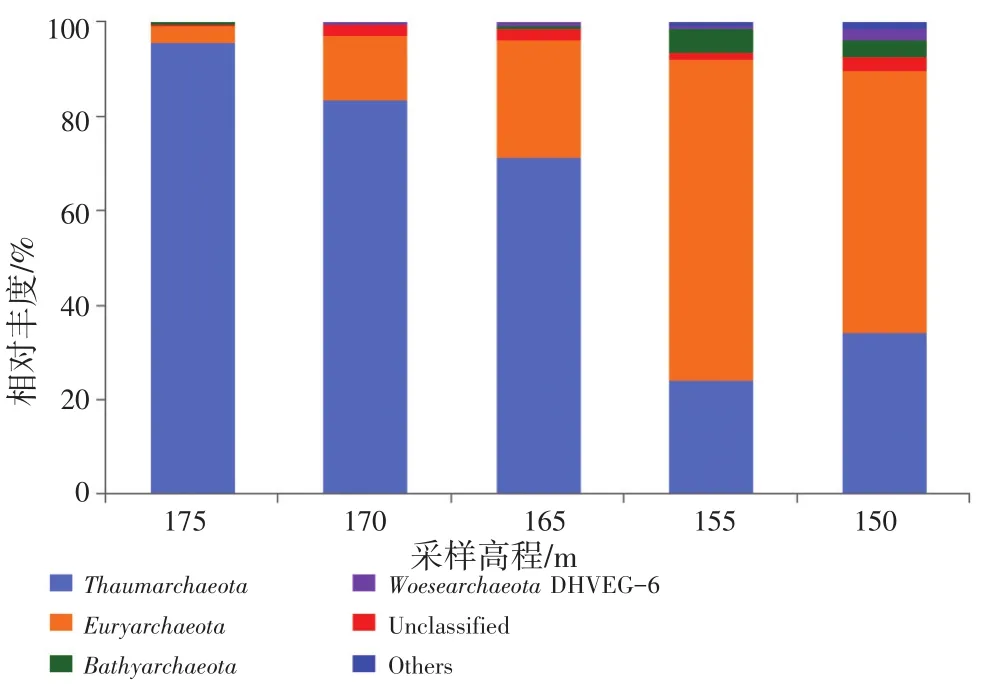
图4 不同高程主要古菌门的相对丰度(相对丰度大于1%)Fig.4 Relative abundances of the dominant archaeal phyla in different sampling elevations (relative abundance>1%)
本研究还从属水平上对消落带土壤中的古菌群落结构进行了分析(图5)。总共有61个属水平的古菌物种在消落带土壤中被发现,并对相对丰度前20的古菌物种在各高程土壤中的变化情况进行分析。隶属于奇古菌门的Soil Crenarchaeotic Group(SCG)是消落带175 m,170 m和165 m高程样点的优势属,其相对丰度分别为83.7%、63.4%和48.5%。在SCG为优势属的高程样点中,同样隶属于奇古菌门的Candidatus Nitrososphaera占有较大比例,达到10.4%~23.0%,且从175 m到165 m高程逐渐升高。然而,在较低高程的155 m和150 m样点,Candidatus Nitrososphaera的相对丰度分别只有2.9%和6.4%。消落带155 m高程相对丰度前3的古菌物种分别为Methanosarcina(24.3%),SCG(20.2%) 和ThermoplasmatalesIncertae Sedis(11.0%),而150 m高程相对丰度前三的古菌物种分别为SCG(26.3%),Methanosarcina(14.3%)和Methanosaeta(12.9%),在155 m和150 m高程没有发现明显的优势物种。
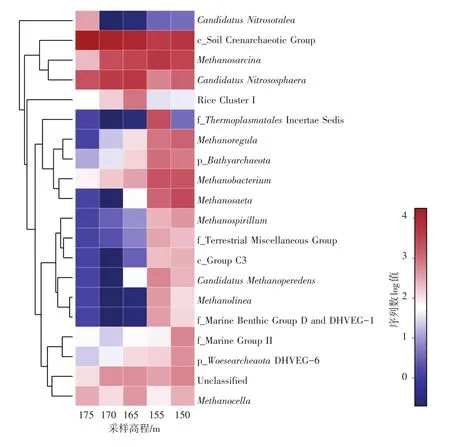
图5 相对丰度前二十的古菌物种在不同高程的相对丰度(主要为属水平)Fig.5 Relative abundances of the 20 most dominant archaeal taxa(primarily at genus level)in different sampling elevations
2.3 古菌群落的环境影响因子
从土壤性质与主要古菌物种的相关性热图(图6)可以看出,消落带土壤中SCG与NH4+(P<0.001)、含水率(P<0.01)和pH(P<0.05)显著负相关,Candidatus Nitrososphaera同样与NH4+(P<0.05)和含水率(P<0.05)显著负相关。而大多数的产甲烷古菌,如Methanosarcina(P值分别为0.01和0.01)和Methanosaeta(P值分别为0.01和0.001)都和土壤中NH4+和含水率显著正相关。消落带土壤NO3-含量主要与古菌物种表现出负相关,如Methano⁃sarcina,Marine Benthic Group和Metheanoregula等(P<0.05)。然而消落带土壤中的OM,TC,TN和TS没有与任何古菌物种呈现出显著的相关性(图6)。
3 讨论
在自然生态系统中,诸如淹水等环境条件的变化是影响生物群落组成的常见干扰。本文应用高通量测序的方法分析了三峡库区消落带土壤古菌群落多样性和结构沿高程梯度的空间变化规律,结果发现古菌群落α多样性表现出随着采样高程降低而升高的趋势。这可能是因为较低高程土壤受到的淹水干扰在古菌群落适宜的范围内,“中度干扰”理论表明一定程度的干扰能导致生物群落的多样性增加[21-22]。此外,土壤水份发挥着传输营养物质的作用,淹水能导致大量的营养物质进入土壤孔隙中,而丰富的土壤营养往往与高的微生物多样性联系在一起。因此,消落带低高程样点长时间的淹水能为土壤携带大量的营养物质,可能促进古菌群落多样性的增加。
消落带古菌群落组成的变化与高程密切相关。奇古菌门是较高高程样点的优势古菌门(相对丰度为71.5%~95.6%)。这与多数研究表明土壤中有着相当数量的奇古菌门[4]是一致的。隶属于奇古菌门的SCG是175 m、170 m和165 m高程土壤中的优势古菌物种,表明在此高程区间古菌发挥着重要的氨氧化作用。此外,Candidatus Nitrososphaera组在较高高程占有较大比例,但是在155 m和150 m高程的相对丰度很小(分别为2.9%和6.4%)。这可能跟淹水导致不同高程土壤的氧环境存在较大差异有关。奇古菌门主要由好氧氨氧化古菌组成,较高高程土壤淹水时间较短,有着较好的氧环境,适宜好氧氨氧化古菌的生长。
不同于奇古菌,广古菌更多存在于淹水时间较长的低高程样点中。绝大多数的广古菌门(如产甲烷菌)都是严格厌氧微生物,与土壤含水量显著正相关。稳定的氧化还原条件更有利于广古菌门微生物的生长[23],消落带低高程相对稳定的厌氧环境更适合广古菌。广古菌门的产甲烷菌,包括Methanosarcina和Methanosaeta,大量存在于低高程样点中,但在高海拔样点中急剧减少。产甲烷菌沿高程梯度的分布与它们严格的厌氧代谢机理是一致的。淹水是土壤形成厌氧环境最直接的方法,这解释了产甲烷菌大量存在于频繁且长时间淹水土壤的原因[16]。产甲烷古菌和氨氧化古菌的分布与土壤含水率密切相关,表现出沿高程梯度完全相反的分布特征,这在一定程度上反映了古菌群落在消落带土壤碳氮循环过程中的功能存在空间分异。
