细菌超声分散计数仪在微生物实验前处理中的应用
2018-10-11冯通明肖美方王威崔小颖吴智龙周杰
冯通明 肖美方 王威 崔小颖 吴智龙 周杰
菌悬液制备是微生物学研究的一项基本实验操作,尤其在开展致病菌的药物敏感性试验、菌种鉴定之前,通常需要对菌株或菌液进行预处理,使细菌分散呈单细胞状态,或接近单细胞游离状态,以便于后续实验的进行[1-4]。传统的菌悬液制备方法以反复吹打、涡旋振荡、研磨法为主,而在临床及科研工作中,经常涉及到某些培养形态呈颗粒状、皱褶干燥、黏稠拉丝、难分离的菌株,如诺卡菌属、奈瑟菌属、肺炎克雷伯菌、铜绿假单胞菌等[5-7],难以通过传统手工方法获得理想的菌悬液;此外,开放式操作容易产生大量气溶胶,而研究对象通常具有一定的传染性和致病性,对实验人员的人身安全存在较大隐患[8]。因此,微生物学研究亟需安全、高效、标准化的菌悬液制备方法。
本研究采用细菌超声分散计数仪,通过对比传统的手工分散方法与新型的超声分散方法这两种菌悬液制备方法,借助革兰染色镜检观察比较二者的分散效果,并用平板计数法评价超声分散处理对菌活性的影响,从而探究细菌超声分散计数仪在微生物实验前处理中的应用价值。
材料和方法
1. 实验材料:本研究参试菌种共计9种,分别为鲍曼不动杆菌(Acinetobacterbaumannii)、阴沟肠杆菌(Enterobactercloacae)、大肠埃希菌(Escherichiacoli)、肺炎克雷伯菌(Klebsiellapneumoniae)、奈瑟菌属(Neisseriaspp.)、诺卡菌属(Nocardiaspp.)、人苍白杆菌(Ochrobactrumanthropi)、玫瑰单胞菌(Roseomonassp.)和嗜麦芽窄食单胞菌(Stenotro-phomonasmaltophilia),均为佛山市第四人民医院检验科提供。
2.仪器和试剂:BACspreaderTM2100型细菌超声分散计数仪(广东体必康生物科技有限公司,简称“分散仪”,中国),光学显微镜(奥林巴斯,日本),37 ℃ 恒温培养箱(上海一恒,中国),4 ℃冰箱,微量移液器(Eppendorf公司,德国)等;LB(Luria-Bertani)固体培养平板,接种环,0.5% Tween-80生理盐水,超声分散专用试管(广东体必康生物科技有限公司,中国),载玻片,革兰染色液等。
3.实验及评价方法:包括采用分散仪分散方法(简称“仪器分散法”)与传统手工分散方法。(1)活化菌株:无菌条件下,用接种环分别将各菌种划线接种到LB固体培养平板上,37 ℃恒温培养24~48 h。(2)设定分散仪工作参数:以是否能肉眼观察到颗粒物为标准,摸索不同菌株的超声分散处理的条件,选取达到均匀、无明显颗粒分散效果所需的最低超声分散功率和处理时间,作为各菌种的仪器分散初始参数。(3)仪器分散法:用接种环挑取适量菌落分装到3个装有2 ml生理盐水的超声分散专用试管中,并设置3组重复,分别用分散仪的低档、中档和高档功率进行超声分散,每超声处理5 s,间隔5 s,以此循环;随时通过肉眼观察菌液分散效果,当菌液呈均匀无明显颗粒状时即停止超声处理,记录各菌种适合的超声分散工作时间和功率,并检测菌液浊度,稀释至1 麦氏浊度单位(MCF)。(4)传统手工分散方法:采用反复吹打混匀法,用接种环挑取适量菌落至装有2 ml生理盐水的超声分散专用试管中,并设置3组重复,用微量移液器反复吹打混匀,直至菌液呈均匀无明显颗粒状,并用分散仪检测菌液浊度,稀释至1 MCF。(5)分散效果评价方法:分别将仪器分散和手工分散获得的菌悬液进行10倍梯度稀释至1∶105,经革兰染色,在油镜下观察其分散效果。(6)菌液浊度评价方法:麦氏浊度直接反映菌悬液中活细胞的浓度,通常菌悬液越均匀,则浊度越稳定且准确,因此浊度变化可以从侧面反映菌液的均匀程度和仪器分散的分散效果。对各参试菌种分别设置3组重复,用分散仪进行超声分散处理,其中,奈瑟菌属和诺卡菌属用中档功率,其他菌种用低档功率,每隔30 s记录一次菌液浊度,最后取平均值绘制浊度与累积超声分散时间的曲线图。(7)细菌活性检测和评价方法:采用平板计数法检测并对比仪器分散和传统手工分散两种处理方法下细菌生长活性的差异,取两种分散方法获得的1∶105稀释菌液各10 μl,分别涂布3个或6个LB固体培养平板,37 ℃ 恒温培养24~48 h后统计各平板的菌落数,各参试菌种分别经不同分散方法处理后,在同一稀释度下进行划板培养,通过平板计数法检测其生长活性,对比分析不同分散方法对菌活性的影响。
4. 统计学处理:用Graphpad prism 6.0软件进行数据分析和制图,使用SPSS 20.0软件进行统计学分析,重复测量计量数据采用方差分析,计数资料采用χ2检验分析,以P<0.05为差异有统计学意义。
结 果
1.分散仪工作参数对分散效果的影响:采用仪器分散法制备9种参试菌种菌悬液时,需使用低档或中档功率,其中7种菌只需使用低档功率、2种菌需要使用中档功率;除诺卡菌属使用中档超声分散处理120 s外,其他各菌种超声处理时间均不超过60 s,其中,大肠埃希菌需要的超声时间最短,仅需10 s (表1)。
2. 不同处理方法对分散效果的影响:不同参试菌株经手工分散获得的菌悬液普遍存在不同程度的菌团聚等现象;分散仪对各参试菌种的分散效果更加均匀,无明显菌团聚现象,部分菌种甚至呈单细胞游离状态。两种方法的分散效果差异最明显的是奈瑟菌属和诺卡菌属,仪器分散法较传统手工分散法能够明显提高细胞的分散程度;其次是人苍白杆菌,仪器分散法能够在一定程度上提高分散效果;而鲍曼不动杆菌、肺炎克雷伯菌和嗜麦芽窄食单胞菌等菌株两者的分散效果差异不明显(图1)。
3.超声分散处理时间对菌液浊度的影响:随着超声分散时间的延长,大部分菌种的菌悬液浊度变化不明显,以奈瑟菌属为例,累积超声分散时间从30 s到360 s,菌液浊度没有发生明显升高或降低,表明超声处理30 s即可达到较为理想的分散效果;而鲍曼不动杆菌、阴沟肠杆菌和大肠埃希菌的菌液浊度随超声分散时间的延长而明显下降,表明在保证其分散效果的同时,应尽量缩短超声时间;肺炎克雷伯菌较为特殊,当超声处理60 s时,菌液浊度达到最大值,继续延长处理时间,则浊度逐渐下降,见图2。
不同分散方法对细菌生长活性的影响:在1∶105稀释度下,大肠埃希菌经仪器分散后的平板菌落数均值均明显低于手工分散(P<0.05),表明这种菌经手工分散后的细菌生长活性明显高于仪器分散;诺卡菌属经仪器分散后的平板菌落数均值明显高于手工分散(P<0.05),表明诺卡菌经仪器分散后的细菌生长活性明显高于手工分散;此外,鲍曼不动杆菌、阴沟肠杆菌、人苍白杆菌和玫瑰单胞菌经仪器分散后的平板菌落数均值均高于手工分散,而奈瑟菌属和嗜麦芽窄食单胞菌经仪器分散后的平板菌落数均值均低于手工分散,但均未达到显著性水平。可以认为,上述6种菌种在指定条件下分别用仪器分散和手工分散获得的菌悬液不存在明显的生长活性差异,见表2。
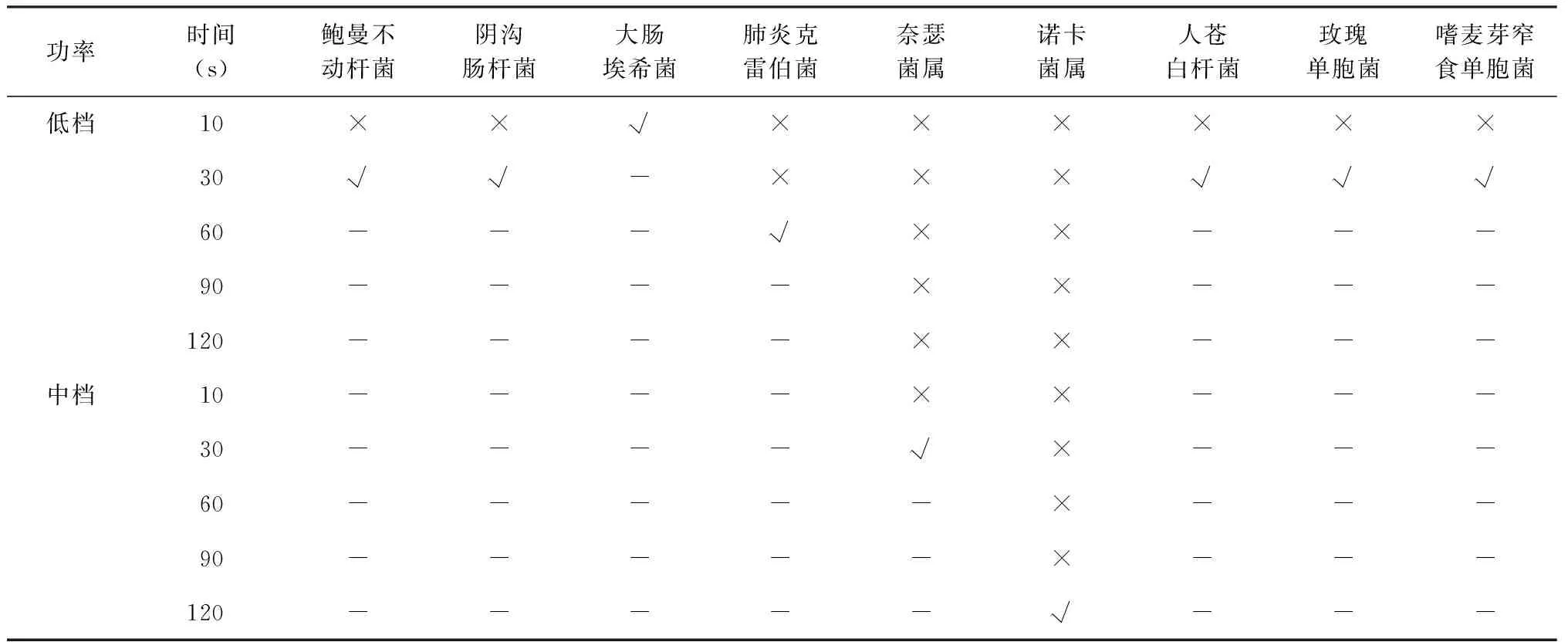
表1 不同功率及累积超声分散时间对各菌种的分散效果
注×:表示该条件下菌液分散效果未达到要求,需要延长超声处理时间或提高超声功率;√:表示该条件下菌液分散效果已达到要求;-:表示无数据,菌液分散效果已在更低超声功率或更短超声时间下达到要求
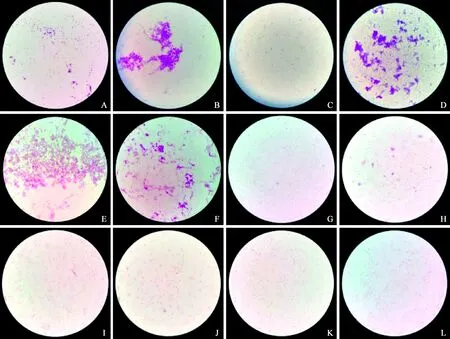
图1 部分菌种(革兰染色 ×1000)在不同处理方法下的分散效果。图1A、B分别为奈瑟菌属仪器分散与手工分散效果图,显示奈瑟菌属经仪器分散后的细胞分散程度明显高于手工分散; 图1C、D分别为诺卡菌属仪器分散和手工分散效果图,显示诺卡菌属经仪器分散后的细胞分散程度明显高于手工分散;图1E、F分别为人苍白杆菌仪器分散和手工分散效果图,显示仪器分散法在一定程度上提高人苍白杆菌的分散效果;图1G、H分别为鲍曼不动杆菌仪器分散和手工分散效果图;图1I、J分别为肺炎克雷伯菌仪器分散和手工分散效果图;图1K、L分别为嗜麦芽窄食单胞菌仪器分散和手工分散效果图;图1G~L显示对于鲍曼不动杆菌、肺炎克雷伯菌和嗜麦芽窄食单胞菌菌株,仪器分散法和手工分散法的分散效果差异不明显
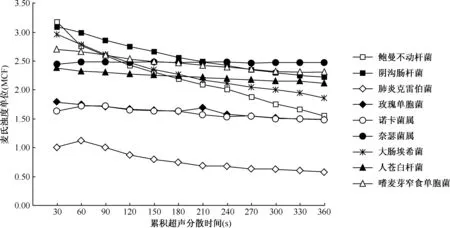
图2 超声分散处理时间对不同菌株悬液浊度的影响
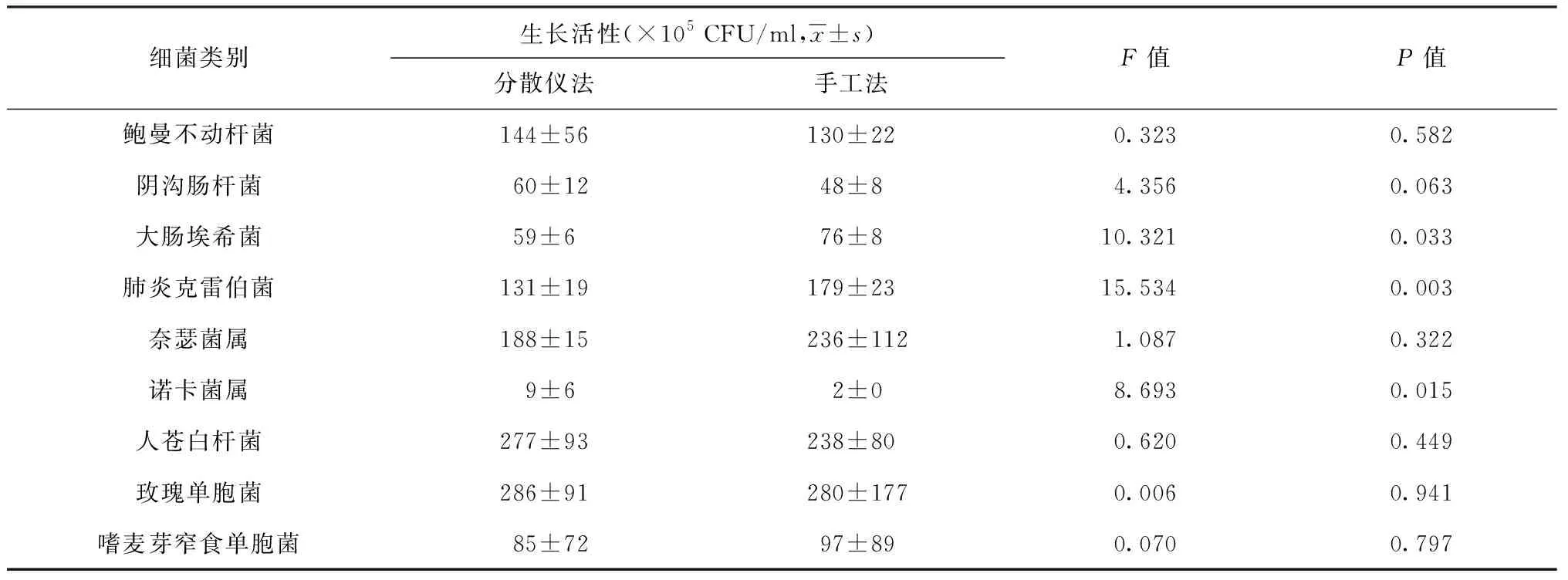
细菌类别生长活性(×105 CFU/ml,x±s)分散仪法手工法F值P值鲍曼不动杆菌144±56130±220.3230.582阴沟肠杆菌60±1248±84.3560.063大肠埃希菌59±676±810.3210.033肺炎克雷伯菌131±19179±2315.5340.003奈瑟菌属188±15236±1121.0870.322诺卡菌属9±62±08.6930.015人苍白杆菌277±93238±800.6200.449玫瑰单胞菌286±91280±1770.0060.941嗜麦芽窄食单胞菌85±7297±890.0700.797
注CFU为菌落形成单位
讨 论
细菌超声分散计数仪的工作原理是以液体为媒介,通过超声波在液体中的“空化”作用,将聚集成团的菌落进行分散和解团聚,从而达到分散细菌的作用,小功率超声有分散作用而无损于菌体,但大功率超声可使细菌细胞破碎[3]。
本研究通过肉眼观察、革兰染色镜检、超声时间与菌液浊度关系曲线作图和平板计数法等实验,对传统手工分散方法和新型超声分散方法这两种菌悬液制备方法进行分散效果对比,并对比二者对细菌生长活性的影响。结果表明,与传统手工分散方法相比,细菌超声分散计数仪对各参试菌种的分散效果更加均匀,且耗时较短,在中档或低档功率下累积分散时间通常不超过120 s,在指定条件下不会影响菌体的生长活性。
菌悬液标本的制备是药物敏感性试验的关键步骤[9-12]。已有研究表明,细菌超声分散计数仪在结核分枝杆菌的药物敏感性试验中具有极高的应用价值:传统的研磨法分散效果不理想、操作复杂、人为误差较大,而分散仪的超声分散效果非常理想,且不影响细菌活力,更利于对药物敏感性试验结果的科学判读,结果更具客观性、可比性,能有效减少试验误差[3]。另外在体外试验中,由于黏液型细菌,如铜绿假单胞菌、肺炎克雷伯菌,产生大量藻酸盐使其菌落表面覆盖一层厚厚的黏液,致使制作菌悬液的过程中挑取大量的黏液而导致实际的菌液浓度偏低,是影响黏液型细菌的耐药率明显低于非黏液型细菌的重要因素[11]。可以预见,细菌超声分散计数仪在其他病原菌,尤其是某些难以手工分散的病原菌的药物敏感性试验及耐药性检测中具有极高的应用价值和潜力。此外,在病原菌的菌株分离和鉴定中,菌悬液制备同样是关键步骤,细胞分散程度越接近单细胞游离状态,越便于菌株的分离纯化和后期鉴定[12]。
细菌超声分散计数仪能够解决某些菌种难以分散的难题,如诺卡菌属、奈瑟菌属、肺炎克雷伯菌、结核分枝杆菌[3,13-15]等,同时,分散后可实现自动比浊,智能提示稀释到标准麦氏浊度所需的稀释体积等。此外,分散仪的工作环境相对密闭,能够为实验人员提供充足的健康安全保障;仪器参数设置固定、工作条件稳定,具有可行性高、重复性好等优势,能够为不同菌种的菌悬液制备提供一套标准化操作方法。
总之,分散计数仪能够为菌悬液制备提供安全、高效、标准化的解决方案,在临床及科研微生物实验前处理中具有极高的应用价值,能够替代传统手工方法。
