骨化三醇、雷帕霉素及其联合使用对人子宫内膜癌Ishikawa细胞株的作用及机制研究
2018-10-11张铮铮杜文升陆晓媛
张铮铮,刘 筱,徐 浩,魏 敏,杜文升,陆晓媛
(徐州医科大学 1. 附属医院妇产科、2. 妇产科教研室、3. 附属医院急救中心,江苏 徐州 221002)
目前,子宫内膜癌多采用手术与化疗相结合的综合治疗方法。然而,化疗药物多存在毒性大、副作用强的缺点,且长期使用易产生耐药性[1-2]。因此,进一步寻找新的高效、低毒化疗药物仍是一个非常有意义的临床热点问题[3]。
骨化三醇(calcitriol)又称1,25-(OH)2D3,是维生素D3的重要活性代谢产物之一。通过激活特异维生素D受体(vitamin D receptor,VDR)而发挥其生物学效应[4]。有研究报道,骨化三醇与VDR结合,引起其构象变化和磷酸化,同时可激活PI3K/Akt/mTOR信号通路[5]。而该通路作为细胞内非常重要的信号转导途径,在细胞的生长、存活、增殖、凋亡、血管生成、自噬等过程中发挥着极其重要的作用。该通路的紊乱可导致肿瘤细胞的增殖、分化、凋亡、化疗耐药等[6]。雷帕霉素(rapamycin)及其衍生物是mTOR信号特异性的抑制剂。Grabiner等[7]证实,抑制mTOR通路可以有效阻断各种生长因子异常信号的转导,从而抑制癌细胞的发生与生长。但骨化三醇、 雷帕霉素及其二者联合使用对子宫内膜癌的作用尚未见报道。本研究拟通过观察骨化三醇、雷帕霉素及其联合使用对人子宫内膜癌Ishikawa细胞株形态、增殖周期及PI3K/Akt/mTOR信号表达的影响,以期明确其抑癌效应及可能的作用机制。
1 材料与方法
1.1材料
1.1.1细胞株与试剂 子宫内膜癌Ishikawa细胞株,购自南京凯基生物科技发展有限公司。骨化三醇、雷帕霉素均购自美国Sigma公司;细胞周期检测试剂盒购自南京凯基生物科技发展有限公司;Akt、mTOR引物由上海英潍捷基贸易有限公司合成;抗mTOR(SC-8319)、Akt(SC-24500)抗体,均购自Santa Cruz Biotechnology;羊抗兔IgG(H+L)、DylightTM680偶联的二抗,购自美国Thermo Scientific公司;驴抗羊IgG(H+L)(IRDye800CW),购自美国Abcam公司。
1.1.2仪器 二氧化碳孵育箱(美国Thermo公司);WFH-204B型手提式紫外分析仪(上海精科实业有限公司);倒置相差显微镜及显微照相系统(Motic AE 31);Centrifuge 5810R冷冻超速离心机、Mastercycler Gradient PCR反应仪(德国Eppendorf公司);流式细胞仪(美国ESPELITE公司);GDS-800数码凝胶摄影系统(英国UVP公司)。
1.2方法
1.2.1骨化三醇和雷帕霉素抑癌适宜浓度和时间点的筛选 骨化三醇(10-6、10-7、10-8、10-9mol·L-1)及雷帕霉素(100.0、50.0、25.0、12.5 nmol·L-1)分别与人子宫内膜癌Ishikawa细胞株共培养24、48、72 h,同时设立不加药物的溶媒对照。MTT法测定不同浓度骨化三醇对人子宫内膜癌Ishikawa细胞株增殖的抑制率,抑制率=(1-用药组OD值/对照组OD值)×100%。以抑制率最高所需较低浓度、较短时间作为适宜浓度和时间点。将抑制率最高且浓度较低的骨化三醇和雷帕霉素混合液作为联合抑癌的适宜浓度,与人子宫内膜癌Ishikawa细胞株共培养24、48、72 h,药物合用效果用金氏公式p2推测[8]:q=E(AB)/[EA+(1-EA)×EB],其中E(AB)为两药合用的抑制率,EA和EB为各药单用时的抑制率。q=0.85~1.15表示两药作用相加;q>1.5表示两药作用协同;q<0.85表示两药作用拮抗,进一步筛选出适宜时间。
1.2.2细胞形态学观察 用倒置显微镜观测骨化三醇、雷帕霉素及其联合使用对人子宫内膜癌Ishikawa细胞株形态学的影响。
1.2.3流式细胞术检测细胞周期 实验分为骨化三醇组(10-7mol·L-1)、雷帕霉素组(50 nmol·L-1)、联合组(骨化三醇10-7mol·L-1+雷帕霉素50 nmol·L-1)、溶媒对照组。收集不同药物作用48 h后的细胞及细胞培养液,按照细胞周期试剂盒说明,2 000 r·min-1离心5 min,弃上清,用PBS轻轻重悬细胞并计数。细胞浓度1×109·L-1,取1 mL单细胞悬液离心后,4℃保存,染色前用PBS洗去固定液;加入100 μL RNase A 37℃水浴30 min;再加入400 μL PI染色混匀,4℃避光30 min;上机检测,记录激发波长488 nm处红色荧光。用流式细胞仪检测各组对Ishikawa细胞增殖周期的影响。
1.2.4RT-PCR检测mRNA的表达 参考试剂盒说明,提取Ishikawa细胞的总RNA,逆转录成cDNA,并进行cDNA扩增。扩增样本体系为25 μL。扩增条件均为:94℃预变性30 min;94℃变性30 s,53℃退火30 s,35个循环;72℃ 1 min,72℃ 5 min终止。以β-actin为内参,计算Akt、mTOR mRNA的相对表达量。Akt上游引物:5′-ACGGGCACATTAAGATCACAG-3′,下游引物:5′-GGCTGAGCTTCTTCTCGTACA-3′;mTOR上游引物:5′-CTGGGACTCAAATGTGTGCAGTTC-3′,下游引物5′-GAACAATAGGGTGAATGATCCGGG-3′;内参基因β-actin 上游引物:5′-TCACCCACACTGTGCCCATCTACG-3′,下游引物:5′-CAGCGGAACCGCTCATTGCCAATGG -3′。
1.2.5Western blot检测蛋白的表达 将实验各组细胞按前述方式分组培养,实验结束后,提取细胞总蛋白。采用BCA法测定蛋白浓度。取适量蛋白样品加样,SDS-PAGE电泳,将蛋白条带转到PVDF膜上,250 mA电流转膜30 min,5%脱脂牛奶封闭3 h,4℃孵育一抗过夜,回收、漂洗一抗,然后室温下孵育二抗2 h,洗涤后加入显色液,分析各组Akt、mTOR蛋白表达情况。

2 结果
2.1骨化三醇、雷帕霉素以及联合应用对人子宫内膜癌Ishikawa细胞增殖的影响
2.1.1骨化三醇对Ishikawa细胞增殖的影响 Fig 1A的MTT实验结果表明,相同浓度的骨化三醇,随作用时间增加而抑制率上升,似具有时间依赖性。在0~48 h时间范围内,抑制率曲线的斜率较大,表明其抑制子宫内膜癌细胞增殖作用明显,而随着作用时间的延长,在48~72 h时间范围内,该曲线的斜率明显减小,曲度趋向平坦,表明其抑制子宫内膜癌细胞增殖作用变化不大。10-7mol·L-1的骨化三醇作用于Ishikawa细胞株48 h的抑制率为(51.82±2.03)%,72 h抑制率为(52.35±3.22)%,均高于其他实验浓度组。而10-7mol·L-1骨化三醇在48 h和72 h的抑制率差异无统计学意义。结果表明,骨化三醇作用于Ishikawa细胞的最佳浓度为10-7mol·L-1。作用时间方面,虽然72 h的抑制率高于48 h,但两者差异无统计学意义,从药物毒性时间依赖性的角度,本实验选用48 h为最佳作用时间点。
2.1.2雷帕霉素对Ishikawa细胞增殖的影响 Fig 1B实验结果表明,相同浓度的雷帕霉素,随作用时间增加而抑制率上升,似具有时间依赖性。在0~48 h时间范围内,抑制率曲线的斜率较大,表明其抑制子宫内膜癌细胞增殖作用明显,而随着作用时间的延长,在48~72 h时间范围内,该曲线的斜率明显减小,曲度趋向平坦,表明其抑制子宫内膜癌细胞增殖作用变化不大。100.0 nmol·L-1的雷帕霉素作用于Ishikawa细胞株48 h的抑制率为(46.22±2.62)%,72 h抑制率为(47.26±3.63)%,均高于其他实验浓度组。但与50.0 nmol·L-1雷帕霉素组相比,在48 h和72 h时间点抑制率差异无统计学意义。结果表明,雷帕霉素作用于Ishikawa细胞的最佳浓度为50.0 nmol·L-1,最佳作用时间点为48 h。
2.1.3骨化三醇联合雷帕霉素对Ishikawa细胞增殖的影响 根据上述实验结果,将溶媒对照组、10-7mol·L-1骨化三醇组、50 nmol·L-1雷帕霉素组、联合用药组(10-7mol·L-1骨化三醇+50 nmol·L-1雷帕霉素)分别与Ishikawa细胞株共培养48 h。Fig 1C结果表明,骨化三醇联合雷帕霉素对Ishikawa细胞抑制率为(63.64±2.05)%,均高于其他各组,差异有统计学意义。用金氏公式评价骨化三醇联合雷帕霉素的应用效果,q值为1.53,表明骨化三醇、雷帕霉素联合用药疗效优于单独用药,为增强效应。

Fig 1 Effect of calcitriol, rapamycin and combination treatment on proliferation of human endometrial carcinoma Ishikawa cells in vitro n=6)
A: The inhibitory rate of calcitriol on Ishikawa cells; B: The inhibitory rate of rapamycin on Ishikawa cells.*P<0.05vs24 h; C: The inhibitory rate of calcitriol and rapamycin on Ishikawa cells.*P<0.05vscontrol group;#P<0.05vscalcitriol and rapamycin combined group.
2.2骨化三醇、雷帕霉素及其联合使用对Ishikawa细胞形态学的影响将骨化三醇(10-7mol·L-1)、雷帕霉素(50 nmol·L-1)以及骨化三醇联合雷帕霉素分别与Ishikawa细胞培养48 h。如Fig 2所示,溶媒对照组细胞生长状态良好,光镜视野内贴壁细胞密集,胞体饱满,细胞贴壁生长,透明,表面光滑,折光性好,细胞增殖旺盛。骨化三醇组和雷帕霉素组细胞则出现视野内细胞密度减低,细胞间隙增大,细胞变圆、缩小、边界清晰,核内颗粒增多,折光性差,边缘不整,部分悬浮于培养液中;而骨化三醇联合雷帕霉素组细胞密度进一步减小,部分细胞已解体,见较多的凋亡和坏死细胞悬浮于培养液中。

Fig 2 Number of survival cells under an inverted phase microscope cultured for 48 h(scale bar=100 μm)
A:Control; B:Calcitriol; C:Rapamycin; D:Combination.
2.3骨化三醇、雷帕霉素及其联合使用对Ishikawa细胞周期的影响如Fig 3所示,与溶媒对照组相比,骨化三醇组、雷帕霉素组在G1峰前均出现较低二倍体细胞凋亡峰,联合用药组则在G1峰前出现较高二倍体细胞凋亡峰。Tab 1结果表明,骨化三醇组和雷帕霉素组G0/G1期细胞所占比例均高于溶媒对照组,而S期和G2/M期细胞所占的比例最低;骨化三醇联合雷帕霉素组的凋亡率高于其各自单独用药组(P<0.05);溶媒对照组细胞大多处于G0/G1期,S期次之,G2/M期最少。骨化三醇或雷帕霉素能使细胞周期发生变化,G0/G1期细胞增加,S期、G2/M期比例稍减少,而联合用药G0/G1期细胞增加更明显,S期、G2/M期细胞比例相应减少,凋亡率明显增加。
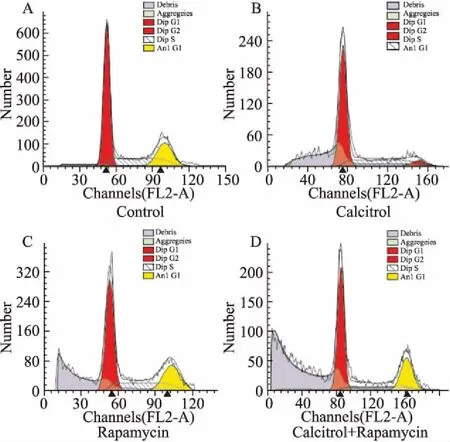
Fig 3 Cell cycle of human endometrial carcinoma Ishikawa cells performed by flow cytometry
A:Control; B:Calcitriol; C:Rapamycin; D:Combination.

Tab 1 Apoptotic rate and percentage of cells during each stage to total cell n=6)
*P<0.05vscontrol;#P<0.05vscombination
2.4骨化三醇、雷帕霉素及其联合使用对Ishikawa细胞Akt、mTORmRNA表达的影响Fig 4的RT-PCR结果表明,与对照组相比,骨化三醇组、雷帕霉素组及骨化三醇联合雷帕霉素组Ishikawa细胞内Akt、mTOR mRNA的表达水平均降低,差异有统计学意义(P<0.05)。其中,骨化三醇联合雷帕霉素组表达水平最低,与其他组相比差异有统计学意义(P<0.05)。
2.5骨化三醇、雷帕霉素及其联合使用对Ishikawa细胞Akt、mTOR蛋白表达的影响Fig 5的Western blot结果表明,与对照组相比,骨化三醇组、雷帕霉素组及骨化三醇联合雷帕霉素组Ishikawa细胞Akt、mTOR蛋白的表达量均降低,差异有统计学意义(P<0.05)。其中,骨化三醇联合雷帕霉素组表达量最低,与其他组相比差异有统计学意义(P<0.05)。

Fig 4 Expression of Akt and mTOR mRNA in Ishikawa cells cultured for 48 h n=6)
1:Control;2:Calcitriol; 3:Rapamycin; 4:Calcitriol+Rapamycin.*P<0.05vscontrol group;#P<0.05vscombination group
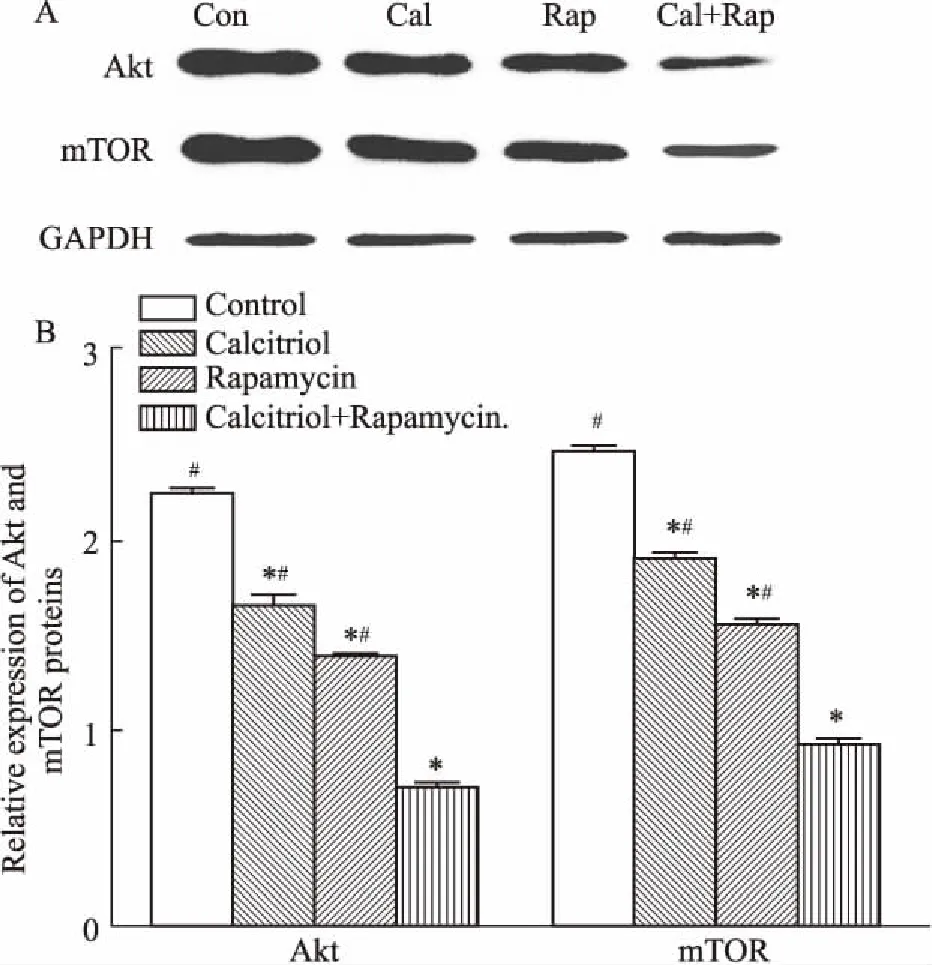
Fig 5 Expression of Akt and mTOR proteins in Ishikawa cells
*P<0.05vscontrol group;#P<0.05vscombination group
3 讨论
适宜的药物浓度和作用时间对药物的生物学效应至关重要。本实验采用10-6~10-9mol·L-1的骨化三醇和12.5~100.0 nmol·L-1的雷帕霉素分别与Ishikawa细胞共培养24~72 h,MTT法观察比较两种药物对癌细胞的抑制率,以期寻找适宜的药物浓度和作用时间。尽管结果表明两种药物对癌细胞的抑制率均具有浓度和时间依赖性,但并非呈直线关系。根据抑癌效果曲线图,可见至一定浓度和时间点,曲线由直线趋转平缓。鉴于既往资料报道,药物浓度越高伴随而来的副作用风险愈大;药物作用时间越长,常致细胞营养需求量增加、代谢产物增加,细胞生长空间受限,造成缺氧、凋亡等负效应等理由[10],我们选择抑制效果相近,而浓度更小的10-7mol·L-1骨化三醇和50.0 nmol·L-1雷帕霉素作为适宜浓度。以48 h作为药物作用的适宜时间。
我们进一步以上述适宜浓度和时间比较骨化三醇、雷帕霉素以及二者联合用药的抑癌效果。单独和联合使用骨化三醇与雷帕霉素,均有不同程度的抑制子宫内膜癌细胞作用,但联合用药的抑制效率更高。根据药物合用效果金氏公式测算,q=1.53,表明骨化三醇与雷帕霉素联合使用,对人子宫内膜癌Ishikawa细胞抑制作用的合用效果为协同作用。
联合用药对子宫内膜癌细胞的协同效应在进一步的形态学研究中同样得到证实。倒置显微镜观察显示,单独使用骨化三醇和雷帕霉素,细胞密度较对照组降低,细胞间隙增大,细胞变圆、缩小,核内颗粒增多,凋亡细胞增多,折光性差,边缘不整,部分悬浮于培养液中;而联合应药后可见细胞数量进一步减少,部分细胞已解体,见较多的凋亡和坏死细胞。
细胞增殖是一个连续而又受调节的过程,增殖周期可分为G0/G1期、S期、G2期和M期。检测上述几个时间点的增殖状态可反映骨化三醇、雷帕霉素及其联合应用对子宫内膜癌细胞的影响状况。结果表明,骨化三醇和雷帕霉素单独及联合使用,均可使细胞周期发生变化,G0/G1期细胞增加,S期、G2/M期比例稍减少;单独使用在G1前即可出现较低的二倍体峰细胞凋亡图像,联合用药组可见G1峰前出现的较高二倍体峰细胞凋亡图,提示凋亡率明显增加。这一结果从抑制细胞周期增殖角度进一步为联合用药的协同作用提供了佐证。
雷帕霉素是最早被发现的mTOR抑制剂。有研究表明,mTOR信号通路与肿瘤的发生、发展密切相关,并与肿瘤的血管生成、转移及化疗耐药有关[11]。雷帕霉素能结合FKBP(FK506结合蛋白),抑制mTOR,阻止P70S6K和4EBP磷酸化,同时也间接抑制了其它相关蛋白转录和翻译,具有抗菌、免疫抑制和抗肿瘤作用[12]。早在20世纪70年代,人们就发现了雷帕霉素具有抗肿瘤活性。在子宫内膜癌的发生机制研究中,Dedes等[13]认为,PI3k/Akt/mTOR是最容易出现异常激活的信号通路。作为PI3K/Akt通路的下游分子mTOR,为细胞启动翻译信号及细胞由G0/G1期进入S期所必需,是细胞分解和合成代谢的调节中心,与蛋白合成、细胞周期的调控相关[14]。在许多肿瘤组织培养和动物模型中,mTOR的选择性抑制剂雷帕霉素对乳腺癌、白血病、肝细胞癌、胰腺癌、黑色素瘤、小细胞肺癌、结直肠癌等多种肿瘤均具有浓度依赖性的抑制肿瘤细胞生长活性[15]。本实验进一步使用RT-PCR、Western blot,观察了骨化三醇、雷帕霉素及联合用药组对Ishikawa细胞中Akt、mTOR mRNA及蛋白表达的影响。结果表明,单独使用骨化三醇和雷帕霉素,Ishikawa细胞的Akt、mTOR mRNA及蛋白表达水平较对照组均有下降,但联合用药组下降更明显。由此推测,骨化三醇、雷帕霉素及其联合应用均可能通过影响PI3k/Akt/mTOR通路,下调Akt、mTOR的mRNA及蛋白的表达,影响细胞增殖周期,加速细胞凋亡,发挥抑制癌细胞作用。
我们的研究从细胞增殖抑制率、形态学、细胞增殖周期等多个层面,为骨化三醇、雷帕霉素联合应用对子宫内膜癌细胞协同抑制效应提供了科学的依据,并初步揭示了其发挥作用的可能机制,也为临床各领域骨化三醇、雷帕霉素及其联合使用提供了有益的参考。