有氧运动和白藜芦醇对糖尿病大鼠海马神经元凋亡的影响
2018-10-11王松涛
李 翰,王松涛,常 芸
有氧运动和白藜芦醇对糖尿病大鼠海马神经元凋亡的影响
李 翰1,王松涛2,常 芸1
1. 国家体育总局体育科学研究所, 北京 100061; 2. 华南师范大学体育科学学院, 广东 广州 510006
目的:探讨8周游泳运动与白藜芦醇对糖尿病大鼠海马神经细胞形态学及超微结构功能上的影响。方法:雄性SD大鼠45只,除正常对照组(NC)其余大鼠经高脂饲养和链尿佐菌素注射建立糖尿病大鼠模型,再随机分为糖尿病药物运动组(DRE)、糖尿病药物组(DR)、糖尿病运动组(DE)、糖尿病模型对照组(DC)4组。运动组大鼠进行8周无负重游泳训练(60 min/天,5天/周);药物组大鼠进行白藜芦醇灌胃(每天45 mg/kg,7天/周)。采集血清测口服葡萄糖耐量,海马区神经细胞进行尼氏染色,扫描电镜超微结构的观察,并检测Bax、Caspase-3、Bal-2的阳性细胞表达水平以及细胞凋亡率。结果:1)DC组神经细胞形态变形严重,排列疏松混乱,核固缩浓染显著,多见空泡变性,DRE组神经细胞状态优于DE、DR两组,其细胞形态较规则,结构较为完整,排列紧密有序;2)DC组神经元的超微结构上细胞器明显减少,线粒体空泡,神经髓鞘结构破坏严重,DRE组神经细胞状态改善明显,与NC组较接近;3)DC组中Bax、Caspase-3表达最强,Bcl-2最弱(<0.05),但DRE组均优于DE、DR两组;4)与NC组比较,DC组中的细胞凋亡率极为显著(<0.01),DRE组明显低于DC组(<0.01)。结论:1)8周游泳训练与白藜芦醇给药单独或共同干预,均能改善糖尿病大鼠海马细胞结构形态的受损,但游泳训练与白藜芦醇二者相结合的处理方式较单一因素干预效果更加显著;2)游泳训练与白藜芦醇给药,改善糖尿病大鼠神经元形态结构,可能与其减少Bax、Caspase-3表达,增加Bcl-2表达,降低海马细胞凋亡率,以维持细胞形态结构完整性与功能性有关。
细胞凋亡;白藜芦醇;海马;糖尿病
随着世界各国社会经济的发展和人民生活水平的不断提高,以及人口老龄化进程的加快,糖尿病的发病率与患病率呈逐年上升趋势。流行病学指出,糖尿病已成为仅次于肿瘤和心血管病的第3大疾病,全球亿万人口深受其害。长期糖尿病将危及机体多种器官和组织,尤其易引起中枢系统脑功能减退或障碍,导致包括学习和记忆、认知功能方面受损。大脑海马区为哺乳动物进化过程所形成的古脑区,其形态学上呈板层状,其结构特点为高度有序化,其中各种神经成分的分布具有较高的相对独立性。目前,海马区已成为神经科学领域研究脑功能与神经发生发育机制的理想模型之一,此外,海马区也是学习、记忆的重要神经解剖部位。因此,大脑海马区可作为深入探讨糖尿病中枢神经系统损害以及各种干预措施结果和机制的靶组织。
目前已知,药物与运动干预为治疗糖尿病的有效举措。白藜芦醇(Resveratrol)为一种SIRT1激动剂,而SIRT1为NAD+依赖的组蛋白脱乙酰化酶,在中枢系统中广泛表达,可通过对多种底物的脱乙酰化作用发挥其基因沉默、寿命调节、调控细胞周期和细胞凋亡、调节糖脂代谢、参与炎性反应和抵抗应激损伤等生理功能[9],发挥对神经的保护作用。此外,有研究证明,适当的运动训练也可通过增强神经细胞可塑性、上调相关神经生长因子、促进神经细胞结构的修复等方式发挥其健脑益智之功效。但运动联合白藜芦醇是否对糖尿病机体的脑神经损害具有更有效的保护效应以及相关机制,目前尚缺乏充足的研究。
本研究旨在探讨运动与白藜芦醇对糖尿病大鼠海马神经细胞形态学及超微结构功能上的影响,以期为揭示糖尿病脑损伤机理以及运动与药物的神经保护机制提供一定的形态学依据与理论基础。
1 研究材料与方法
1.1 实验动物与饲养
SPF级雄性SD大鼠(8周龄,体重220±20 g)45只,购自中山大学实验动物中心。每笼4只,自由饮食。室温23℃±2℃,空气湿度45%~55%。12-12 h昼夜节律。大鼠适应性喂养1周后,构建糖尿病大鼠模型。
1.2 模型构建与分组
随机将大鼠分为正常对照组(Normal Control,NC,8只)和模型组(37只),模型组大鼠喂以高脂高糖饲料。高糖高脂饲料配方(各成分质量分数):15.0%蔗糖,10.0%猪油,10.0%蛋黄粉,0.5%胆酸钠,1.0%胆固醇,53.5%基础饲料。不限食喂养5周后,模型组大鼠禁食12 h后按照30 mg/kg的剂量,腹腔注射链尿佐菌素(STZ),正常对照组注射同剂量的柠檬酸-柠檬酸三钠缓冲液。分别在3天和7天后进行取尾静脉血测血糖,以空腹血糖浓度≥6.7 mmol/L,随机血糖浓度≥16.7 mmol/L为建模成功标准。剔除不达标大鼠5只,将糖尿病成模大鼠随机分为:模型对照组(Diabetes control,DC),糖尿病运动组(Diabetes Exercise,DE),糖尿病药物组(Diabetes Resveratrol,DR),糖尿病运动药物组(Diabetes Exercise and Resveratrol,DER),每组各8只[2]。
1.3 运动方案
运动组大鼠进行无负重游泳训练[28](水池深60 cm,水温32℃±2℃,活动面积200 cm2/只)。适应性训练1周后,初始训练时间为10 min,随后每天递增10 min,最后增至60 min/天,5天/周,共8周[7]。
1.4 给药方案
依据药理学方法[4],将白藜芦醇溶于双蒸水中制成 (6 mg/ml)悬浊液。灌胃组大鼠按每天45 mg/kg剂量给药,对照组大鼠施予等体积双蒸水灌胃,均灌胃8周,每周7天。
1.5 口服葡萄糖耐量试验(Oral Glucose Tolerance Test,OGTT)
各组大鼠禁食12 h,尾部静脉取血检测空腹血糖,随后分别在灌服葡萄糖(2 g/kg)后30 min、60 min和120 min检测血糖水平[2,22]。
1.6 大鼠海马形态光学显微镜观察
各组大鼠按照3.5 ml/kg剂量,腹腔注射10%的水合氯醛进行麻醉。沿腹白线剖开腹腔,打开胸腔,剪破心包膜,暴露全心。从左心室处插管至升主动脉穿刺,插入灌注针头,再剪开右心耳,放静脉血。先灌注生理盐水约100 ml,继而灌注4%的多聚甲醛,约100 ml。灌注完毕,断头,剥离一侧海马组织,置于4%多聚甲醛固定24 h,经常规乙醇梯度脱水、石蜡包埋、连续切片后进行尼氏染色,切片厚度为3 µm,再中性树脂封片。于OLYMPUS(CK40-F2000型号)显微镜下观察比较各组大鼠海马区神经元形态结构。
1.7 大鼠海马神经元超微结构观察
4%的多聚甲醛心脏灌注后,剥离获取大鼠一侧海马,切成1 mm3组织置2.5%戊二醛中,固定4 h,继而1%锇酸(四氧化锇)固定2 h。标本先用缓冲液彻底冲洗3次,经梯度酒精脱水、置换、包埋、修块,半薄切片定位,再超薄切片机切片,切片厚度为40~60 nm,醋酸铀及柠檬酸铅行双重染色,使用日本JEOL(JEM-1400型)投射电镜观察并采集图像。
1.8 大鼠海马Bax、Bcl-2、Caspase-3免疫组化染色检测
采用SABC法进行免疫组化染色,使用DAB显色,行常规脱水、透明、封固。在10×10与40×10倍的普通光镜视野下,其胞浆呈棕色颗粒者为阳性细胞,每张片随机选取8个视野,在40×10倍光镜下观察并记录各组大鼠海马区的Bax、Bcl-2、Caspase-3的阳性细胞数目。采用Imagepro Plus软件定量分析阳性面积,得出积分光密度IOD。
1.9 大鼠海马神经元细胞凋亡检测
TUNEL法检测大鼠海马神经元细胞凋亡率,石蜡切片常规脱腊至水,微波抗原修复,加TUNNEL反应混合液37℃,1 h;加Converter-POD反应液,37℃、30 min,DAB显色液室温反应约10 min;透明封片,镜检显示凋亡的海马神经元细胞核呈棕黄色。采用OLYMPUS的CK40-F2000型显微镜与Image-ProPlus图像处理软件显微图像分析系统进行图像采集与细胞凋亡率分析。
计算公式:凋亡细胞表达率=阳性细胞数÷(阳性细胞数+阴性细胞数)×100%。
1.10 数据的统计学处理
所有数据用均数±标准差(±)表示,用SPSS Statistics 17.0软件进行数据分析与统计。多组间均数比较采用多因素方差分析。组间两两比较:正态分布资料,采用one-way ANOVA(方差齐,采用LSD法;方差不齐,采用Dennett’s T3法);非正态分布资料进行变量变换,若符合正态分布采用上法,若不符合正态分布,则用Kruskal-Wallis Test进行非参数检验。显著性水平取<0.05,极显著性水平取<0.01。
2 实验结果
2.1 空腹和OGTT后不同组别大鼠的血糖变化情况
如表1、图1所示,与NC组比较,DC组空腹血糖显著升高(<0.05);与NC组比较,DC组OGTT后30 min、60 min和120 min血糖浓度极显著升高(<0.01);DRE组、DE组和DR组OGTT后30 min、60 min和120 min血糖浓度与DC组比较均显著性降低(<0.05)。

表1 不同组别大鼠OGTT后血糖变化情况
注:*表示与NC组对应时间点比较<0.05,为显著性差异,**表示与NC组对应时间点比较<0.01,为极显著性差异;#表示与DC组对应时间点比较<0.05,为显著性差异,下同。
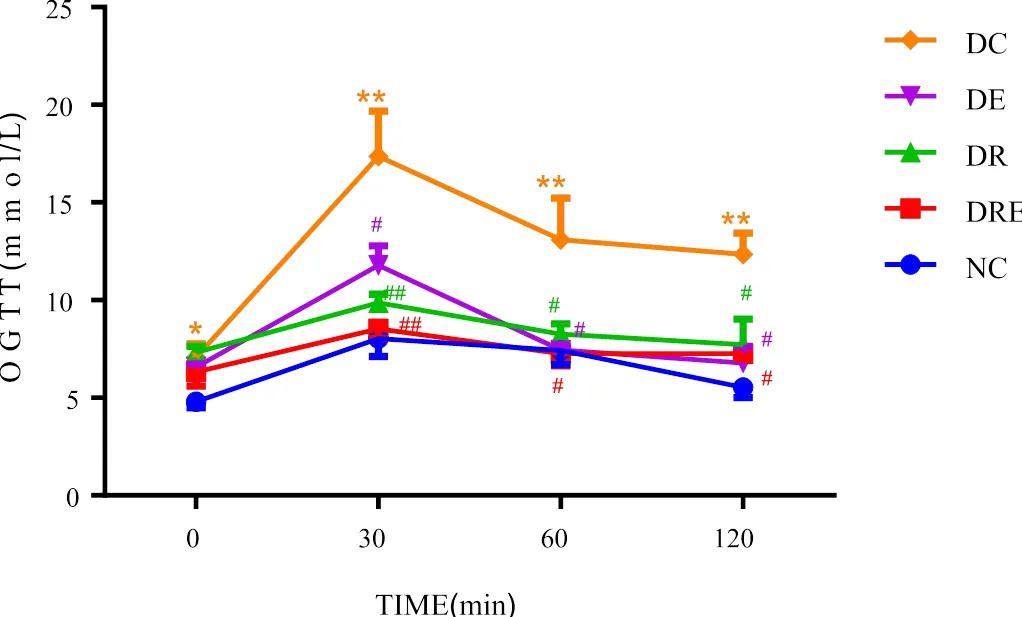
图1 不同组别大鼠OGTT后血糖变化(mmol/L)
Figure 1. The Variation of Blood Glucose after OGTT in Different Group of Rats
2.2 海马神经元尼氏染色形态学观察
NC组大鼠海马区多形细胞层、锥体细胞层、分子层的细胞形态正常结构完整,细胞之间紧密有序,排列整齐。神经元胞体、胞核大小规则,细胞轮廓清晰,细胞层次丰富。胞核呈圆形、淡染,细胞尼氏小体明显,着色明晰(图2)。DC组神经元细胞空泡样变性情况与细胞形态异常较明显,神经元分布稀少紊乱,细胞界限不清,胞体及胞核较小,偶现核固缩浓染,可见增生的胶质细胞,细胞尼氏小体数目较少(<0.05,图6)。DE、DR两组大鼠神经元细胞层次明显,但部分细胞排列稀疏,细胶质细胞增生较为少见。细胞形状基本正常,胞体及胞核也较规则,染色较淡但个别核固缩浓,锥体细胞状态优于DC组;但DE、DR组间细胞形态差异不明显(>0.05,图4、图5)。而DRE组大鼠海马的神经细胞体胞核大小多数较规则,细胞核形状多为圆形,尼氏小体多数清晰,着色明显;细胞间排列紧密整齐,细胞轮廓清晰,细胞分层较多,淡染,细胞整体状态与NC组大鼠接近,明显优于DE、DR与DC 3组(<0.05,图3)。

图2 NC组的锥体细胞层形态(40×10)
Figure 2. The Morphology of Pyramidal Cell Layer in NC Group(40×10)
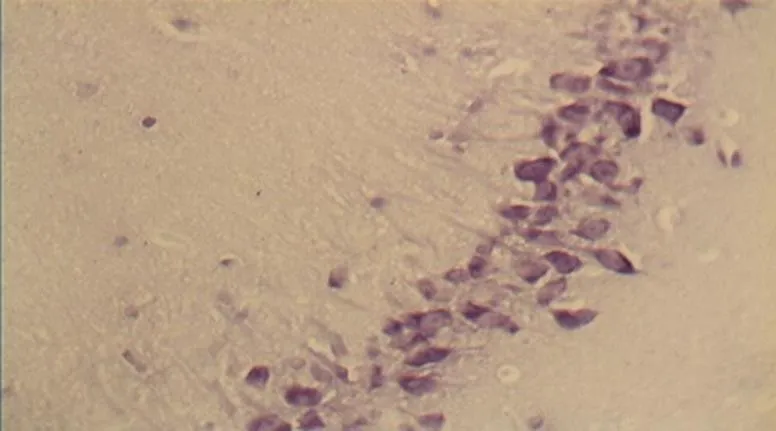
图3 DRE组的锥体细胞层形态(40×10)
Figure 3. The Morphology of Pyramidal Cell Layer in DRE Group(40×10)
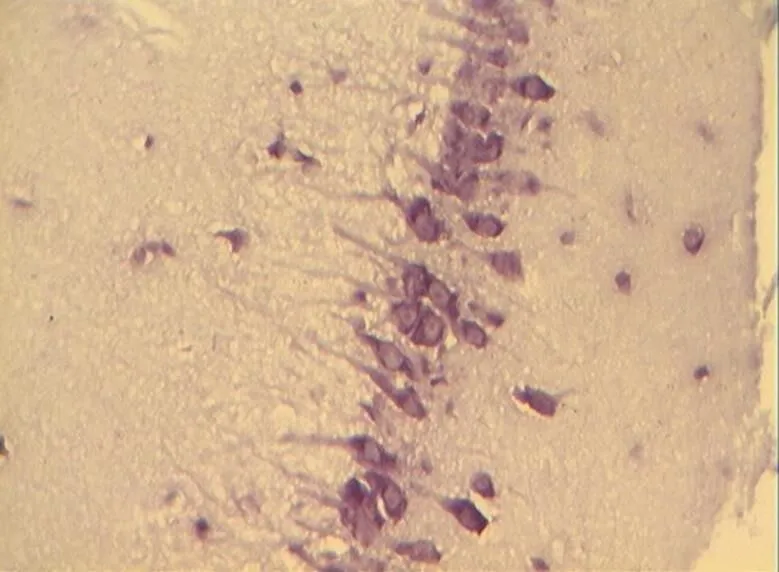
图4 DE组的锥体细胞层形态(40×10)
Figure 4. The Morphology of Pyramidal Cell Layer in DE Group(40×10)

图5 DR组的锥体细胞层形态(40×10)
Figure 5. The Morphology of Pyramidal Cell Layer in DR Group(40×10)
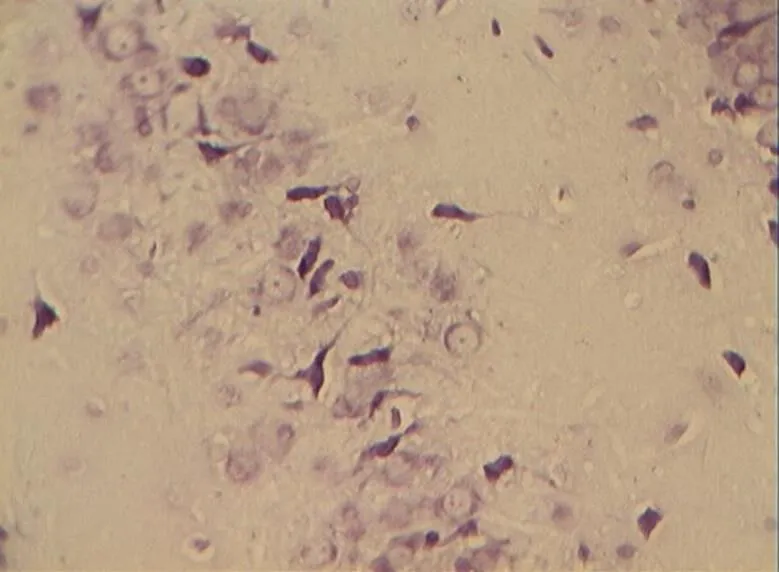
图6 DC组的锥体细胞层形态(40×10)
Figure 6. The Morphology of Pyramidal Cell Layer in DC Group (40×10)
2.3 海马神经元超微结构形态学观察
在×23 000倍的扫描电镜观察发现,NC组神经元呈正常的形态学结构,其细胞核染色质均匀分布,核膜边界清楚;细胞器丰富,线粒体发达,其外表面的双层膜和内部的嵴清晰可辨,并且粗面内质网分布规则,表面附有较多核糖体颗粒,网腔形态均匀,同时高尔基复合体明显,囊腔规则;突触结构完整,突触前膜、突触间隙和突触后膜特化带明显,其突触前分布有丰富的圆形突触小泡且排列紧密。此外,神经纤维髓鞘横切面结构层次致密有序,排列整齐,轴突内部的神经丝和线粒体等结构分明可识;突触均有典型的不对称界面,突触后膜厚度大于突触前膜,且后膜上附有突触后致密物质(PSD),突触前成分内含有大量清亮型突触小泡,线粒体结构完整(图7、图8)。与NC组大鼠比较,DC组大鼠海马区出现明显的神经元退行变性现象,其高尔基体形态异常,粗面内质网排列紊乱、扩张,出现脱颗粒现象;髓鞘板层排列疏松,导致空泡或裂隙形成,造成神经纤维外层髓鞘脱落;内部轴突神经丝松散、卷曲,线粒体呈空泡现象增多;神经突触结构形态学特征异常,突触成分减少且变性明显;轴突内线粒体空泡显著,突触间隙明显增宽,PSD明显变薄,突触小泡较少(图11、图12)。DRE组神经元细胞核形态较规则,染色质分布均匀,核周界限较清楚;细胞器较丰富,绝大部分线粒体双层膜和嵴形态明晰;粗面内质网分布规则,核糖体颗粒附着较多,网腔结构均匀;高尔基复合体明显,囊腔规则;多数神经元髓鞘横切面形态结构较规则,神经元排列整齐,轴突内线粒体等结构清楚;突触结构较规则,突触前膜、突触间隙和突触后膜特化带清晰,触小泡呈圆形、量多,PSD较厚且线粒体结构完整;神经元髓鞘超微结构较规则,层次致密有序,轴突中的神经丝和线粒体及其他细胞结构等整体水平与NC组较为接近(图9、图10)。DE、DR两组神经元细胞状态较相似,部分神经细胞形态不规则,细胞器少,高尔基体少见,局部线粒体呈空泡状,内质网扩张出现形变,但游离核糖体多;另外,神经纤维层间排列紧实,尽管髓鞘层次少,轴中线粒体结构水肿。尽管突触数量较少,但突触结构较为规则,其中突触前膜、突触间隙和突触后膜特化区、突触小泡等清楚可辨,但两组大鼠海马细胞结构整体水平仍次于DRE组(图13~16)。
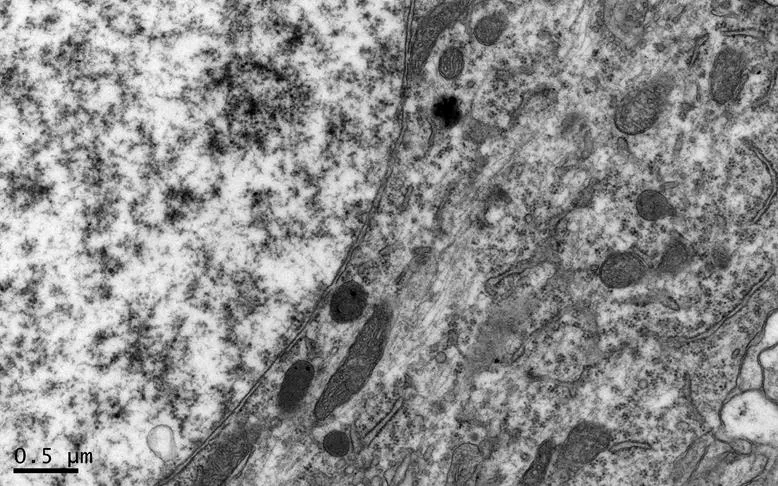
图7 NC组的海马锥体细胞形态
Figure 7. The Morphology of Hippocampal Pyramidal Cells in NC Group

图8 NC组的海马神经纤维形态
Figure 8. The Morphology of Hippocampal Nerve Fibers in NC Group

图9 DRE组的海马锥体细胞形态
Figure 9. The Morphology of Hippocampal Pyramidal Cells in DRE Group
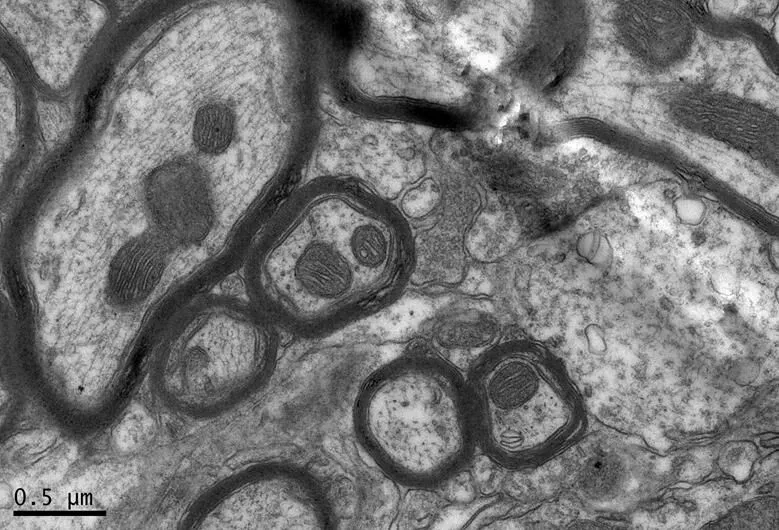
图10 DRE组的海马神经纤维形态
Figure 10. The Morphology of Hippocampal Nerve Fibers in DRE Group

图11 DE组的海马锥体细胞形态
Figure 11. The Morphology of Hippocampal Pyramidal Cells in DE Group
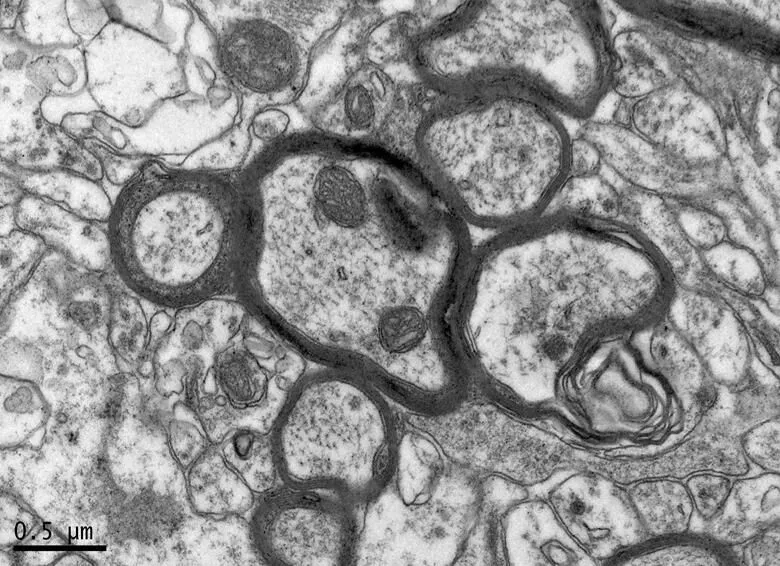
图12 DE组的海马神经纤维形态
Figure 12. The Morphology of Hippocampal Nerve Fibers in DE Group
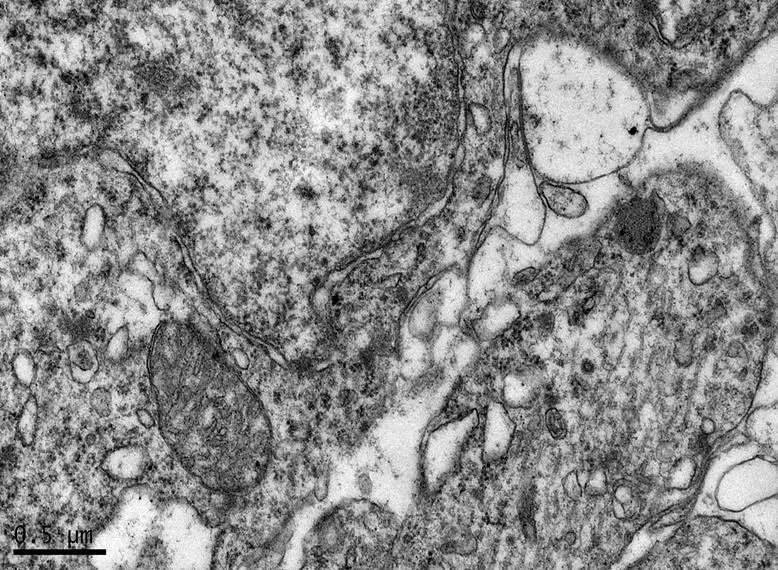
图13 DR组大鼠海马锥体细胞形态
Figure 13. The Morphology of Hippocampal Pyramidal Cells in DR Group

图14 DR组大鼠海马神经纤维形态
Figure 14. The Morphology of Hippocampal Nerve Fibers in DR Group

图15 DC组的海马锥体细胞形态
Figure 15. The Morphology of Hippocampal Pyramidal Cells in DC Group

图16 DC组的海马神经纤维形态
Figure 16. The Morphology of Hippocampal Nerve Fibers in DC Group
2.4 海马神经元Bax、Bcl-2、Caspase-3的表达
2.4.1 Bax的表达
如图17~21所示,凋亡促进蛋白Bax在胞浆内阳性表达,基本呈明显的棕褐色颗粒。

图17 NC组的Bax阳性表达(40×10)
Figure 17. The Positive Expression of Bax in NC Group(40×10)

图18 DRE组的Bax阳性表达(40×10)
Figure 18. The Positive Expression of Bax in DRE Group (40×10)
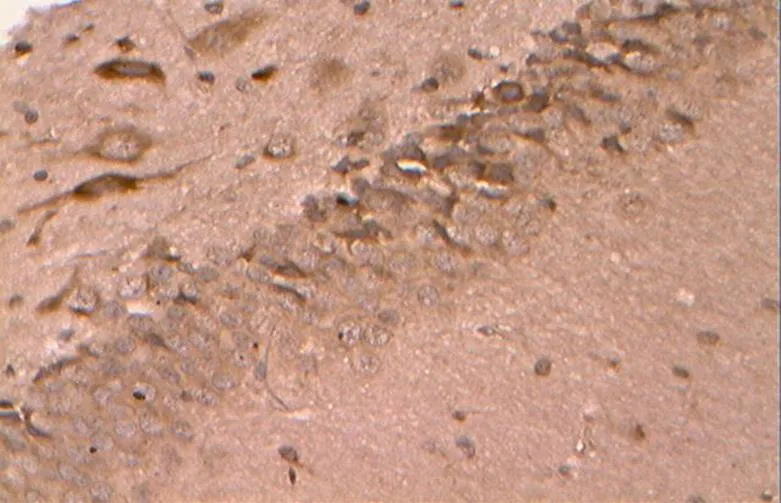
图19 DR组的Bax阳性表达(40×10)
Figure 19. The Positive Expression of Bax in DR Group(40×10)
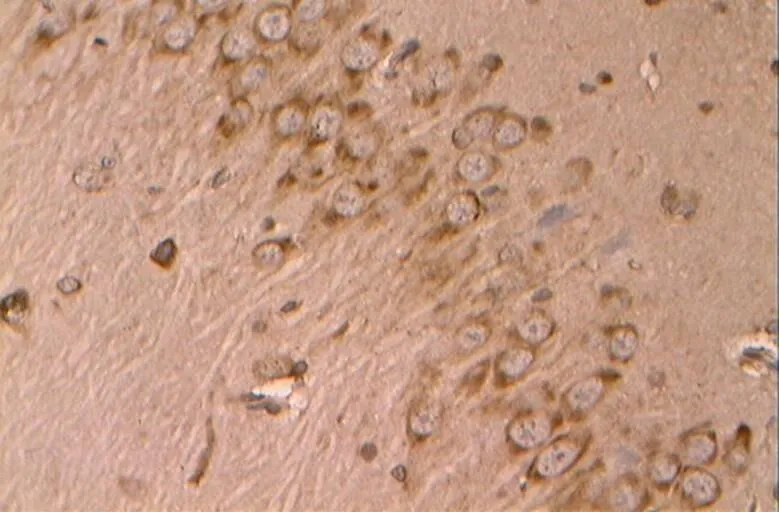
图20 DE组的Bax阳性表达(40×10)
Figure 20. The Positive Expression of Bax in DE Group(40×10)

图21 DC组的Bax阳性表达(40×10)
Figure 21. The Positive Expression of Bax in DC Group(40×10)
2.4.2 Bcl-2的表达
如图22~26所示,凋亡抑制因子Bcl-2在胞浆内阳性表达,主要为棕黄色细颗粒,无着色则多为阴性表达。
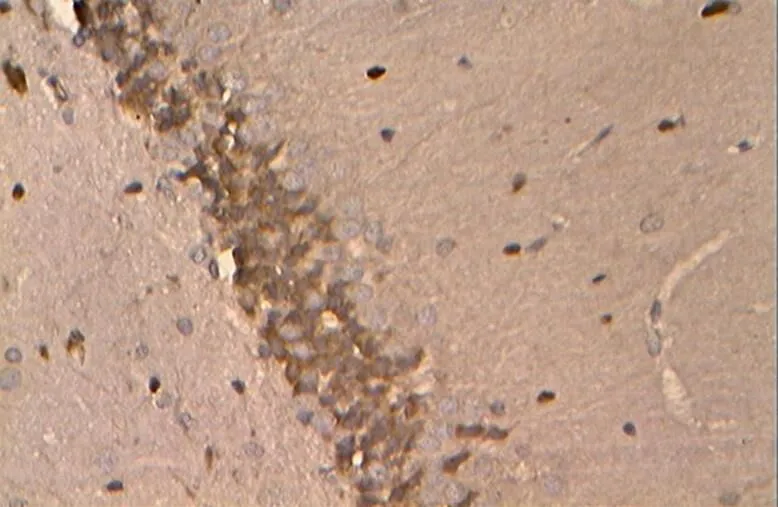
图22 NC组的Bcl-2阳性表达(40×10)
Figure 22. The Positive Expression of Bcl-2 in NC Group(40×10)

图23 DRE组的Bcl-2阳性表达(40×10)
Figure 23. The Positive Expression of Bcl-2 in DRE Group(40×10)

图24 DE组的Bcl-2阳性表达(40×10)
Figure 24. The Positive Expression of Bcl-2 in DE Group(40×10)

图25 DR组的Bcl-2阳性表达(40×10)
Figure 25. The Positive Expression of Bcl-2 in DR Group(40×10)

图26 DC组的Bcl-2阳性表达(40×10)
Figure 26. The Positive Expression of Bcl-2 in DC Group(40×10)
2.4.3 Caspase-3的表达
如图27~31所示,Caspase-3在胞浆内阳性表达,为明显的棕褐色颗粒,无着色为阴性。

图27 NC组的Caspase-3阳性表达(40×10)
Figure 27. The Positive Expression of Caspase-3 in NC Group (40×10)
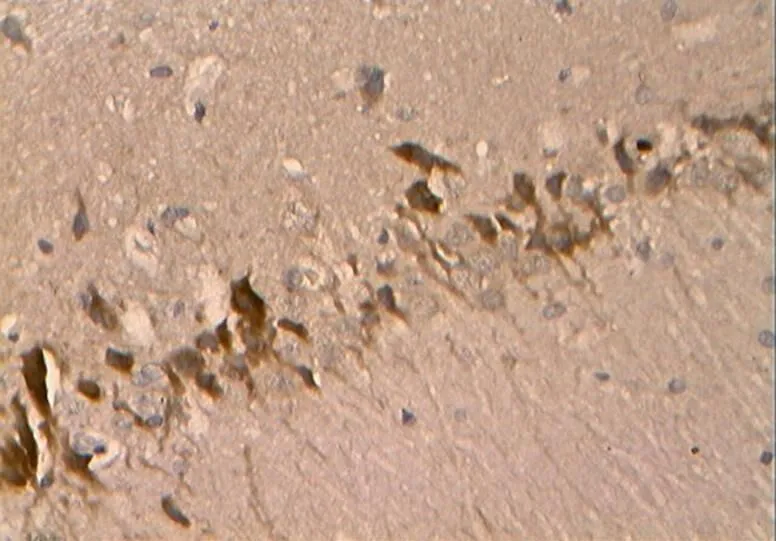
图28 DRE组的Caspase-3阳性表达(40×10)
Figure 28. The Positive Expression of Caspase-3 in DRE Group (40×10)

图29 DE组的Caspase-3阳性表达(40×10)
Figure 29. The Positive Expression of Caspase-3 in DE Group (40×10)

图30 DR组的Caspase-3阳性表达(40×10)
Figure 30. The Positive Expression of Caspase-3 in DR Group(40×10)

图31 DC组的Caspase-3阳性表达(40×10)
Figure 31. The Positive Expression of Caspase-3 in DC Group(40×10)

表2 各组大鼠海马神经元Bax、Bcl-2、Caspase-3阳性表达情况
注:@表示与DRE组比较<0.05,为显著性差异,下同。
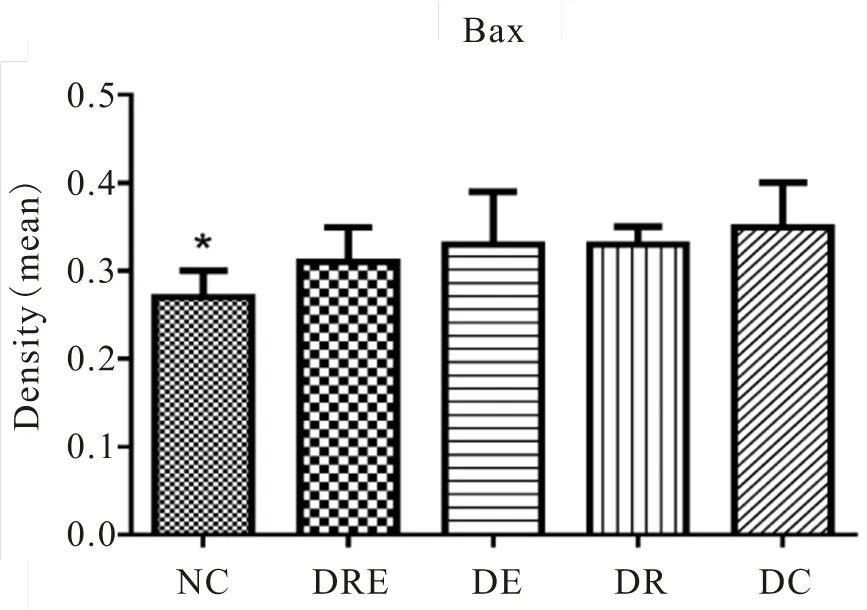
图32 各组大鼠海马神经元Bax阳性表达变化
Figure 32. The Positive Expression of Bax of Hippocampal Neurons in Different Groups of Rats

图33 各组大鼠海马神经元Bcl-2阳性表达变化
Figure 33. The Positive Expression of Bcl-2 of Hippocampal Neurons in Different Groups of Rats

图34 各组大鼠海马神经元Caspase-3阳性表达变化
Figure 34. The Positive Expression of Caspase-3 of Hippocampal Neurons in Different Groups of Rats
免疫组化及统计结果显示(表2,图17~34),各组大鼠海马神经元中凋亡促进蛋白Bax、Caspase-3的阳性表达产物主要分布于胞质和突起、胞核内,而抑凋亡因子Bcl-2主要在胞浆和核膜表达。NC组的神经元细胞排列紧密,Bcl-2阳性细胞数目众多,染色深、明显,且多呈黄褐色,而Bax、Caspase-3阳性细胞很少,表达最弱。DC组大鼠海马的Bcl-2阳性神经元的数目则明显减少,排列松散,但层次少且单薄,神经元染色浅,Bax、Caspase-3阳性细胞则非常显著,深棕色颗粒物质较多,表达强烈(<0.05)。DE与DR两组结果较为接近,基本优于DC组,两组具体表现为Bcl-2细胞阳性细胞数目有所增加(>0.05),细胞凋亡有所下降,且细胞排列略为有序,但DR组Bax阳性细胞也略有增加(>0.05),且DR、DE两组的Caspase-3阳性细胞有增加趋势,其中,在DE组大鼠海马神经元中其表达增加显著(<0.05)。DRE与DE、DR组间比较显示,该组大鼠海马区的凋亡促进蛋白均有降低趋势,其中,DRE组的Bax的表达弱于DE、DR两组,但无统计学意义(>0.05);而DRE组的Caspase-3阳性细胞数目显著低于DR组(<0.05);而相对于DE、DR两组,DRE组大鼠海马神经元的抑凋亡因子Bcl-2阳性细胞数目略有增加(>0.05),其阳性细胞在胞浆和核膜着色深,近黄褐色且细胞间排列紧致。同时,DRE组的细胞凋亡情况与正常对照NC组较为接近,凋亡促进蛋白Bax、Caspase-3的表达差异均不明显(>0.05),但Bcl-2阳性细胞数目显著低于NC组(<0.05)。另外,DE、DR组间Bax、Caspase-3、Bcl-2 3种蛋白的阳性表达均无显著差异(>0.05)。
2.5 海马神经元细胞的凋亡
根据TUNEL法进行原位末端标记并置于普通光镜下观察,同时进行统计学计数分析(表3,图35~40)。NC组大鼠海马神经元显示生理性凋亡细胞数目极少,细胞排列紧致,层次丰富,细胞核基本被苏木素复染成蓝色,核相对较大,形态大小一致,细胞凋亡率低于其他组(<0.01)。DC组大鼠其海马区凋亡阳性细胞极明显增加(<0.01),具体表现为阳性细胞核呈棕色着染,形态呈不规则碎点状,海马细胞杂乱无序,部分胞浆也因胞核DNA碎片溢出而呈深褐色阳性着染,凋亡细胞形态呈圆形或椭圆形(<0.01)。DE、DR组大鼠海马神经元的细胞凋亡数目显著低于DC组大鼠(<0.05),但DR组凋亡率降低更明显(<0.01),体现为细胞整体排列松散,阳性细胞着染颜色较之DC浅。此外,DRE组细胞凋亡状态与NC组相近,表现为细胞排列较紧密,层次丰富。细胞核多呈蓝色,核形态大小基本一致,且两组间细胞凋亡率差异不明显(>0.05)。同时,与DE、DR组比较,DRE组大鼠海马神经元凋亡率极显著降低(<0.01)。

图35 NC组的细胞凋亡(40×10)
Figure 35. The Apoptosis in NC Group(40×10)

图36 DRE组的细胞凋亡(40×10)
Figure 36. The Apoptosis in DRE Group(40×10)

图37 DE组的细胞凋亡(40×10)
Figure 37. The Apoptosis in DE Group(40×10)

图38 DR组的细胞凋亡(40×10)
Figure 38. The Apoptosis in DR Group(40×10)
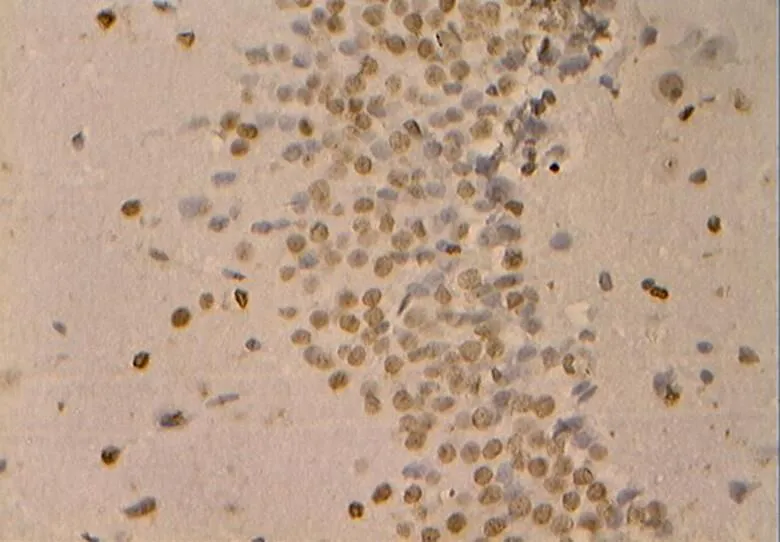
图39 DC组的细胞凋亡(40×10)
Figure 39. The Apoptosis in DC Group(40×10)

表3 各组大鼠海马神经细胞凋亡表达率比较
注:@@表示与DRE组比较<0.01,为极显著性差异;&&表示与DR组比较<0.01,为极显著性差异;下同。
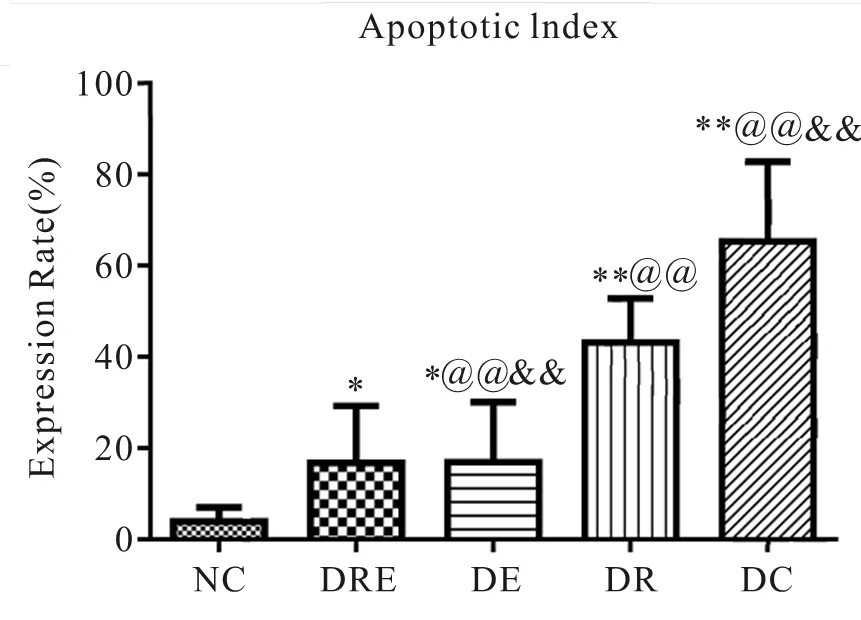
图40 各组大鼠海马神经细胞凋亡表达率比较
Figure 40. The Apoptosis in Different Groups of Rats
3 讨论
3.1 运动训练与白藜芦醇对糖尿病大鼠海马神经元形态学的影响
尼氏体是神经元的重要结构成分,与神经元的功能具有密切的关系。神经元尼氏体数量的多寡和形态大小实际上反映出神经元的生长发育、物质转运及其功能活动的正常与否[13],神经元受到如炎症、中毒等病理刺激后,神经细胞内尼氏体颗粒数量减少,呈明显的溶解甚至消失。作为神经元的标志性物质,尼氏染色是检测神经元损伤的最经典的形态学方法之一[15]。
本研究中NC组大鼠的海马细胞经尼氏染色显示,多形细胞层、锥体细胞层、分子层的细胞形态结构完整,层次分明、细胞排列整齐规律、紧致有序,尼氏体着色均匀。DC组则细胞形态异常较明显,其海马区神经元变性最严重,神经细胞层次混乱不清,且尼氏小体数目极少。上述结果说明,糖尿病可造成大鼠海马神经元细胞异常。本研究中分别施予8周游泳运动与白藜芦醇灌胃给药,DE、DR两组大鼠神经元锥体细胞状态基本优于DC组,其细胞形状基本正常,胞体及胞核也较规则,且DE、DR组间差异不显著。提示,运动与白藜芦醇给药均可改善糖尿病大鼠海马细胞形态,并且两种干预方式发挥的作用其差异性不大,但与DRE组相比,显示仍有部分细胞排列分散稀疏及胶质细胞增生。而DRE组大鼠海马神经细胞形态比DE、DR、DC 3组较为规则,其细胞整体状态与NC组接近。提示,对糖尿病大鼠海马细胞形态结构的改善作用,运动与白藜芦醇共同干预的治疗方式优于单纯运动和单纯给药。
海马神经元的超微结构观察结果也进一步证实了上述发现。DC组大鼠的海马细胞核、细胞器、突触结构、神经纤维等一系列超微结构失常变性,出现明显的神经元退行变性现象,说明高脂毒性加剧其细胞超微结构受损程度。而DE组经过8周运动,其海马锥体细胞状态总体优于其对应的DC组,表现为其突触成分与结构、细胞器丰富程度、细胞形态、神经纤维形态等超微结构均有所改善。有报道指出,糖尿病导致中枢神经系统损伤涉及多方面的病理变化,其中以轻度认知功能障碍为主要表现,电生理实验中显示,糖尿病大鼠的海马突触可塑性下降[5],并影响海马的突触传递[12],出现长时程增强抑制(Long Term Depression,LTD)现象[24]。Reisi等[27]的研究中,链脲霉素诱导的糖尿病大鼠进行连续12周,0°斜度,40 min/天,7天/周,17 m/min的中等强度的跑台训练,观察大鼠齿状回抑制性中间神经元短期可塑性的变化,实验发现,糖尿病模型结合运动组和正常对照结合运动组两组大鼠的穿通路径齿状回突触的双脉冲易化,与安静对照组大鼠相比均无显著性差异(>0.05),但糖尿病模型组的双脉冲易化与安静对照组大鼠相比则明显增加,且存在显著性差异(<0.05)。说明,糖尿病可影响大鼠齿状回突触可塑性的突触前成分,但适量的运动训练可在一定程度上改善此现象。提示,运动对链脲霉素诱导的糖尿病大鼠齿状回的突触传递具有神经保护作用。本研究的结果也为这些研究提供了形态学上的支持。
白藜芦醇的多酚结构具有降血脂功能、抗氧化、清除自由基作用[14]。在本研究中,可能由于白藜芦醇可透过血脑屏障[29],并通过提高突触传递、降低氧化应激或者调节受体功能这些机制,对神经元起营养、损伤修复和保护作用[3],故DR组大鼠神经元各成分、神经纤维超微结构分别优于对应的DC组,该结果与Mokni等[25]的结论相似。同时,镜下显示DE、DR组大鼠海马区神经元细胞状态较相似。显示分别采用白藜芦醇给药和运动的两种单一方式干预,均能改善海马细胞超微结构。但是,经运动与白藜芦醇共同干预结果则显示,DRE组大鼠海马区神经元细胞核形态规则,边界清楚,染色质分布均匀,线粒体、高尔基体、内质网等细胞器丰富,突触结构清晰等形态特点,表明其对超微结构改善显著,其细胞整体水平与NC组较为接近,且明显优于DE、DR两组。提示,运动与白藜芦醇双因素预处理方式,对糖尿病大鼠海马神经元超微结构的改善更有效。
3.2 运动训练与白藜芦醇对糖尿病大鼠海马神经元凋亡的影响
近年来流行病学与动物实验研究指出,中枢神经系统许多疾病如糖尿病神经变性、脑老化、神经变性及退行性疾病(如AD)、脑缺血、脑出血、癫痫、脑外伤等,与神经元凋亡有关[1]。而糖尿病对中枢神经系统造成不同程度的学习记忆衰退、认知功能障碍,是糖尿病慢性并发症之一。关于糖尿病导致认知功能障碍、学习记忆低下的机理机制目前尚未完全阐明,但有研究表明,脑神经元正常细胞形态受损、结构缺失和功能下调为其主要因素,神经细胞凋亡则是影响糖尿病脑神经元功能的可能机制之一[10,17,21]。
目前检测细胞凋亡的方法有多种[2,4],但因电子显微镜观察细胞凋亡也仅为定性,且标本处理过程复杂,因而采用光学显微镜观察是一种较理想的方法。在本研究中,NC组大鼠海马神经元细胞状态良好,显示其生理性凋亡细胞数目极少,细胞凋亡检出率远低于其他各组。而DC组大鼠海马的凋亡阳性细胞极明显增加,说明,糖尿病高糖状态导致海马细胞变性凋亡增加极显著[16]。另有报道指出,中等强度的运动能保护神经,减少细胞凋亡,增强学习记忆能力[20],与激发机体自身的保护机制有关。在本研究中,对糖尿病大鼠进行为期8周的游泳训练,结果显示其细胞凋亡率低于糖尿病模型DC组。
此外,Anekonda等[18]研究发现,白藜芦醇干预后的糖尿病大鼠坐骨神经Bax、Caspase-3、Drp-1表达明显下降,Bcl-2的表达显著升高,说明细胞凋亡现象有所降低,坐骨神经超微结构有所改善。陆灵美等[6]指出,白藜芦醇的确能改善大鼠因糖尿病造成的周围神经病理结构,发挥神经保护功能,并具有抗凋亡作用。本研究中,糖尿病大鼠进行8周的白藜芦醇灌胃处理,与糖尿病模型DC组相比,白藜芦醇DR组细胞凋亡数目降低极明显,结果与上述结论接近。但上文报道研究部位为坐骨神经,本研究则侧重于海马神经细胞,虽然研究部位不同,但结论相似。本研究还发现,运动与白藜芦醇灌胃给药两种方式,均能减轻糖尿病导致的大鼠海马神经元细胞凋亡现象,但采用白藜芦醇治疗方法,能更明显促进大鼠海马神经元的存活,降低细胞凋亡率。
此外,DRE组大鼠采用运动与白藜芦醇相结合进行8周治疗,结果表明,其细胞状态与NC组相近,两组间大鼠海马神经元凋亡率无显著性差异。但相对于DE、DR组,DRE组大鼠海马神经元凋亡率极显著降低。提示,运动与白藜芦醇灌胃给药两种方式能在一定程度上减轻糖尿病导致的大鼠海马神经元细胞凋亡现象。本研究也发现,运动与白藜芦醇共同干预,比单纯运动、单纯白藜芦醇给药,能更有效降低糖尿病大鼠海马的细胞凋亡率,出现功效叠加现象。
细胞凋亡发生的原因和途径是复杂多样的,在细胞凋亡信号转导途径中,Bcl-2家族发挥重要的生理作用[30],而影响细胞凋亡的关键因素主要集中在表达和调控[26]。Bcl-2为细胞凋亡抑制因子。正常情况下,插入到线粒体外膜上,防止线粒体膜的通透性加强,阻止细胞凋亡一切早期征象发生。Bax为促凋亡蛋白,其功能与Bcl-2相反,但两者结构上氨基酸序列具有高度同源性。Bc1-2/Bax可形成同源或异源二聚体相互拮抗,组成一个平衡体系[23]。此外,半胱氨酸天冬氨酸蛋白酶(Caspases)为细胞凋亡的中心环节,与细胞凋亡密切相关。其中,Caspase-3作为细胞凋亡蛋白酶级联反应最核心的凋亡蛋白酶和细胞凋亡的关键指标,在凋亡程序中发挥重要的枢纽作用[19]。
本研究中,DC组大鼠的Bax、Caspase-3阳性产物明显增加,Bcl-2则表达明显降低,提示,高脂毒性促进糖尿病大鼠海马神经细胞相关凋亡蛋白的表达,并降低凋亡抑制因子的表达水平,加剧海马神经细胞凋亡进程。DE、DR组大鼠海马神经细胞凋亡蛋白表达情况较为接近,基本优于DC组。其中,Bcl-2、Caspase-3阳性细胞数目有所增加,且Caspase-3在DE组大鼠海马神经元中其表达显著增加,而Bax阳性细胞在两组中略有下降趋势,并且DE与DR两组间Bax、Caspase-3、Bcl-2 3种蛋白的阳性表达均无显著性差异。说明,糖尿病大鼠单纯采用白藜芦醇或运动方式进行预处理,可抑制其海马神经元凋亡因子表达,上调促抗凋亡蛋白水平,减轻其细胞凋亡状况,但两种方式对糖尿病大鼠细胞凋亡的改善作用并无明显区别。关于白藜芦醇对细胞凋亡的影响,有证据表明[8],大鼠脑缺血再灌注损伤后施予白藜芦醇治疗,可通过抑制诱发前体物Pro-caspase-3去磷酸化转化为活性形式Caspase-3,进一步阻遏神经细胞凋亡,缩小脑梗体积。也有研究指出[11],白藜芦醇可能通过重新调整Bcl-2和Bax之间的平衡,抑制永久性脑缺血小鼠缺血半暗带内Bax的表达,并促进Bcl-2的表达水平,进而改善小鼠的神经功能缺损症状。在本研究中,尽管动物模型、实验方法不同,但结果与上述结论相似,表明,白藜芦醇可能也通过对凋亡因子、凋亡抑制蛋白及相关抗炎因子等的调控以降低神经细胞凋亡,发挥神经保护作用。
同时,本研究中,采用为期8周的运动与白藜芦醇相结合治疗方式的DRE组大鼠与DE、DR组大鼠比较,该组大鼠海马区的凋亡促进蛋白Bax均有降低趋势,Caspase-3阳性细胞数目显著低于DR组,而抑凋亡因子Bcl-2阳性细胞数目略有增加。DRE组的细胞凋亡蛋白表达情况与NC组较为接近。说明,运动与白藜芦醇共同干预对糖尿病大鼠海马神经元细胞凋亡的改善作用较之单纯运动或白藜芦醇更有效,出现功效叠加现象,究其原因仍需进一步深入探讨。
4 结论
8周游泳训练与白藜芦醇给药单独或共同干预,均能改善糖尿病大鼠海马细胞结构形态的受损,但游泳训练与白藜芦醇二者相结合的处理方式较单一因素干预效果更加显著。游泳训练与白藜芦醇给药改善糖尿病大鼠神经元形态结构,可能与其减少Bax、Caspase-3表达,增加Bcl-2表达,降低海马细胞凋亡率,以维持细胞形态结构完整性与生理功能有关。
[1] 董为伟.神经保护的基础与临床[M].北京:科学出版社, 2002:183.
[2] 矫毓娟,刘江红.细胞凋亡的检测方法[J].中国神经免疫学和神经病学杂志,2004,11(1):53-56 .
[3] 李珍,王斌生,孔德虎,等.白藜芦醇预处理对大鼠局灶性脑缺血/再灌注损伤的神经保护作用[J].中国药理学通报,2010,26(6): 802-826.
[4] 刘能保,王西郎. 现代实用组织学与组织化学技术[M].武汉:湖北科学技术出版社, 2003:231.
[5] 刘洁,王尧.血糖波动与糖尿病并发症的关系[J].现代医学,2010,38( 2) : 200-203.
[6] 陆灵美,戴敏超,赵瑛. Drp1在糖尿病大鼠坐骨神经病变中的作用及白藜芦醇的干预影响[J].标记免疫分析与临床,2010, 17 (8): 250-255.
[7] 覃飞,郝选明,王松涛,等.有氧运动对Ⅱ型糖尿病大鼠结肠肌间神经丛及结肠功能障碍的影响[J]. 中国病理生理杂志, 2013, 29( 6): 1059-1064.
[8] 任俊伟,杨琴,陈娜,等.白藜芦醇对脑缺血再灌注后细胞凋亡及Caspase-3表达的影响[J]. 中成药,2011, 33 (4):570-573.
[9] 孙治坤,马兴荣,韩笑,等.白藜芦醇对阿尔茨海默病合并糖尿病大鼠的氧化应激作用[J]. 中国实用神经疾病杂志, 2017, 23 (20): 1-5.
[10] 谭宇亭,刘兰,廖芸茜,等.白藜芦醇对新生SD 大鼠七氟烷麻醉后认知功能改变的影响[J].解放军医学杂志,2018,(7).20:1-11.
[11] 王建平,许栋乾,赵源征,等.白藜芦醇对永久性脑缺血细胞凋亡及Bcl-2表达的影响[J].中风与神经疾病杂志,2011, 28(12):1078-1081.
[12] 温晓妮.运动对海马结构及功能的研究进展[J].西安体育学院学报,2011,28 (1):94-98.
[13] 徐淑云,卞如濂,陈修.药理实验方法学[M]. 3版.北京:人民卫生出版社, 2001: 202.
[14] 尤竹燕,王斌生,解敏,等.白藜芦醇对大鼠海马CA1区诱发癫痫样放电的影响[J].中国药理学通报,2012,28(2):260-265.
[15] 张哲,陈辉.实用病理组织染色技术[M].沈阳:辽宁科学技术出版社,1998:47.
[16] ABDEL-ALEEM G A,KHALEEL E F,MOSTAFA D G,. Neuroprotective effect of resveratrol against brain ischemia reperfusion injury in rats entails reduction of DJ-1 protein expression and activation of PI3K/Akt/GSK3b survival pathway [J]. Arch Physiol Biochem,2016,122(4): 200.
[17] ALEXIS M.Models and mechanisms for hippocampal dysfunction in obesity and diabetes[J]. Neuroscience,2015, 309:125-139.
[18] ANEKONDA T S,ADAM US G. Resveratrol prevents antibody induced apoptotic death of retinal cells through upregulat ion of Sirt1 and Ku70[J]. BMC Res Notes,2008,1(122): 1-8.
[19] DENES L,SZILAGYI G, GAL A,. Talampanel a non-competitive AMPA-antagonist attenuates caspase-3 dependent apoptosis in mouse brain after transient focal cerebral ischemia[J]. Brain Res Bull,2006,70(3): 260-262.
[20] SCOPEL D, FOCHESATTO C, CIMAROSTI H,. Exercise intensity influences cell injury in rat hippocampal slices exposed to oxygen and glucose deprivation[J].Brain Res Bull,2006,70: 155-159.
[21] MCNAY E C, RECHNAGEL A K. Reprint of: Brain insulin signaling: A key component of cognitive processes and a potential basis for cognitive impairment in type 2 diabetes[J]. Neurobiol Learn Mem, 2011,96: 517-528.
[22] FRANCONI F, SEGHIERI G, CANU S,. Are the available experimental models of type 2 diabetes appropriate for a gender perspective? [J]. Pharmac Res, 2008, 57(1) :6-18.
[23] JANG J H, ATUOMA O I, JEN L S,. Ergothioneine rescues PC12 cells from beta-amyloid-induced apoptotic death [J].Free Radic BiolMed, 2004, 36(3): 288-299.
[24] MALONE J, HANNA S, SAPORTA S,. Hyperglycemia not hyporglycemia alters neuronal dendrities and imparis spatial memory [J]. Pediatr Diabetes,2008,9( 6) : 531-539.
[25] MOKNI M, ELKAHOUI S, LIMAM F,.Effect of resveratrol on antioxidant enyme activities in the brain of healthy rat[J].Neurochem Res,2007,32: 981-987.
[26] ORRENIUS S. Mitochondrial regulation of apoptotic cell death[J].Toxicol Lett,2004,149(123): 19-23.
[27] REISI P, BABR S, ALAEI H,.Effects o f treadmill running on short-term pre-synaptic plasticity at dentate gyrus of streptozotocin induced diabetic rats[J]. Brain Res,2008,1211: 30-36.
[28] PLOUG T, STALLKNECHT B M, PEDERSEN O,. Effect of endurance training on glucose transport capacity and glucose transporter expression in rat skeletal muscle[J].Am J Physiol, 1990, 259: E778-E786.
[29] SCHARFMAN H E. The CA3“back projection”to the dentate gyrus [J].Prog Brain Res, 2007, 163: 627-637.
[30] TSUKAHARA S, YAMAMOTO S, SHWE T T W,. Inhalation of low-level formal dehyde increases the Bcl-2 /Bax exp ression ratio in the hippocampus of immunologically sensitied mice[J].Neuroimmunomodulation, 2006,13(2): 63-68.
The Effects of Aerobic Exercise and Oral Resveratrol on Hippocampal Neuron Apoptosis in Diabetic Rats
LI Han1, WANG Song-tao2, CHANG Yun1
1. China Institute of Sport Science, Beijing 100061, China; 2. South China Normal University, Guangzhou 51006, China.
Objective: The purpose of this study is to explore the effects of aerobic exercise combined with oral resveratrol on ultrastructure apoptosis rate and apoptosis related proteins of hippocampus neurons in type 2 diabetic rats. Methods: 45 male Sprague Dawley rats, aged 8 weeks, were randomly divided into 5 groups: normal control (NC), diabetes control (DC), diabetes exercise (DE), diabetes resveratrol (DR) and diabetes exercise and resveratrol (DER). Exercise-related groups performed 8-week swimming training (60 min/d, 5d/week). Oral glucose tolerance, Nissl's staining, Ultrastructure of hippocampus, the expression of Bax, Bal-2 and Caspase-3, and the rate of apoptosis of neurons were measured. Results: 1)The structures of neurons in hippocampus of group DC were serious metaplasia, and the deformation is, the arrangement is loose and chaotic. The karyopycnosis and more vacuoles were observed. The structures of nerve cell in group DRE was better than that of group DE and DR. 2) the ultrastructure of neurons in group DC was significantly reduced, mitochondrial vacuolization and the serious injure of nerve myelin were observed. The ultrastructure of neurons in group DRE was improved obviously. 3) The positive expression of Bax, Caspase-3 in neurons significantly up-regulated in group DC, and the expression of Bcl-2 obviously down-regulated in group DC.(<0.05)4) compared with group NC, the apoptosis rate in DC group increased significantly (<0.01), and the apoptosis rate of group DRE was clearly lower than that of in DC group (< 0.01). Conclusion: 8-week swimming training and/or oral resveratrol could improve the damaged of structure in hippocampal cell, and regulate the related apoptosis proteins then reduce the apoptosis rate of hippocampal neurons. The improving effect of swimming training combined with resveratrol was better.
1002-9826(2018)05-0077-11
10.16470/j.csst.201805012
G804.7
A
国家体育总局体育科学研究所基本科研业务费资助项目(基本12-30)。
李翰,女,助理研究员,博士,主要研究方向为运动人体科学,E-mail:lihan@ciss.cn。
常芸,女,博士,研究员,主要研究方向为运动心脏,E-mail:changyun2518@vip.sina.tom。
