葛仙米多糖中单糖定性定量分析方法研究
2018-10-10熙王希刘水平罗诚王宗成张瑞华
周 熙王 希刘水平罗 诚王宗成张瑞华
(1. 株洲市食品药品检验所,湖南 株洲 412000; 2. 湖南科技学院化学与生物工程学院,湖南 永州 425199;3. 湖南炎帝生物工程有限公司,湖南 株洲 412007)
葛仙米学名拟球形念珠藻(Nostoc sphaeroides),发育成熟后呈蓝绿色胶质状,颗粒圆润,玲珑剔透[1],为中国独有的淡水野生蓝藻,与发菜同属。葛仙米不含蓝藻毒素,是一种有较高药用和食用价值的经济蓝藻[2],而且富含蛋白质及丰富的多糖[3-5]。多糖类物质往往具有许多生物活性,葛仙米多糖主要成分为半乳糖、甘露糖和木糖,对HCT116细胞增殖具有很强的抑制活性[3]。随着技术的进步和多糖研究的深入,葛仙米必将进一步在食品、保健食品及医疗行业发挥巨大作用[6-7]。现有多糖测定的标准方法均为化学法:SN/T 4260—2015《出口植物源食品中粗多糖的测定 苯酚—硫酸法》、NY/T 1676—2008《食用菌中粗多糖含量的测定》等。这2种方法经过不断优化后,已经广泛用于植物、真菌等多糖的测定。但由于葛仙米中多糖含量高,而且黏度非常大,采用化学法分析时,多糖较难完全提取出来,测定结果不稳定,无法准确测定[7-9]。
对葛仙米有效成分多糖进行检验方法研究及质量分析,可为企业原料规模化养殖、提取方法优化筛选、进一步的开发利用等提供试验依据,为食品药品监管部门对其质量及安全风险评估提供准确可靠的数据,为质量监控提供技术指标。
目前,有关葛仙米多糖的化学结构研究较少,其多糖的单糖组成是研究多糖生物活性的基础[10-11]。1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生化高效液相色谱测定多糖含量的方法,目前被广泛用于各种多糖的单糖组分检测研究[12]。气相色谱法亦可定性、定量分析多糖的组分和含量,一般是将多糖酸水解或甲醇醇解,再用衍生物法以增加其挥发性[13]。相比化学法,色谱法灵敏度应更高、稳定性更好,可定性、定量分析多糖的组分和含量[14]。但由于多糖的结构比较复杂,其水解前处理方法多样,水解条件各有不同,因此有必要找到稳定的前处理方法,与化学法测定多糖含量进行对比,同时对该方法的精密度、重现性、显色稳定性和加样回收率进行考察,为葛仙米多糖提取物中多糖含量的准确测定提供依据。
1 材料与方法
1.1 试剂与材料
葛仙米多糖提取物:湖南炎帝生物工程有限公司。其中Y1与Y2为野生葛仙米,Y3~Y6分别为春夏秋冬4个季节的样品,样品信息见表1。
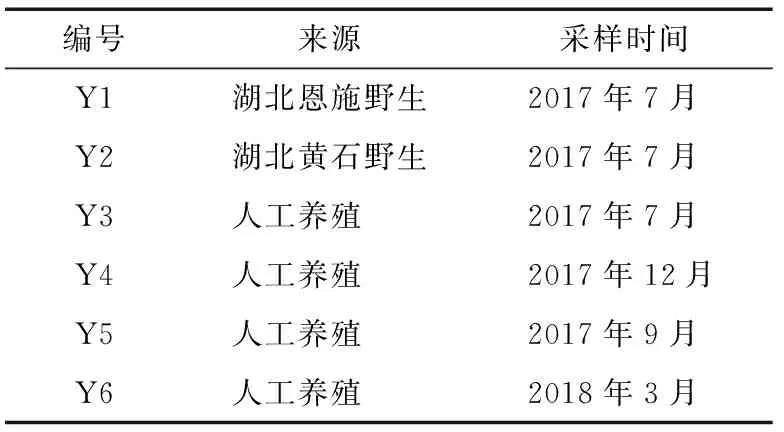
表1 样品Table 1 Sample
1.2 仪器与设备
电子天平:MS205DU型,瑞士梅特勒-托利多国际贸易有限公司;
液相色谱仪:Thermo U3000型,美国赛默飞世尔科技公司;
pH计:FE-20型,瑞士梅特勒-托利多国际贸易有限公司。
1.3 HPLC法测定葛仙米多糖提取物的总糖含量
葛仙米多糖提取物的前处理水解条件经过单因素考察确定,参考相关文献资料[15-17]主要考察水解温度高低、时间长短以及三氟乙酸对水解程度的影响;通过单因素的考察确定最佳的水解条件。
1.3.1 标准单糖溶液的配置及衍生 分别精密称取甘露糖、氨基葡萄糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖及岩藻糖标准品100 mg于10 mL容量瓶中,加水稀释至刻度,摇匀,即得9种单糖的标准储备溶液。再配置成浓度分别为0.1,0.5,1.0,1.5,2.0 mg/mL的单糖混合标准溶液。分别取50 μL的单糖标准液及不同浓度梯度的混合标准溶液,各加0.6 mol/L的NaOH溶液50 μL,置于5 mL的具塞试管中,漩涡混匀;再加0.5 mol/L的PMP(0.435 5 g/5 mL)甲醇溶液100 μL,漩涡混匀,在70 ℃的烘箱中避光反应80 min,取出避光冷却至室温,加0.3 mol/L的HCl溶液100 μL中和,加水至2 mL,再加等体积的氯仿,漩涡混匀,静置,弃去氯仿相,如此萃取3次。将水相用0.45 μm 微孔膜过滤后供HPLC进行分析,作为定性定量的依据[15-18]。
1.3.2 葛仙米多糖提取物的水解 吸取0.1 mL质量分数为5 mg/mL的多糖样品溶液于2 mL的西林瓶中,加入浓度为3 mol/L的三氟乙酸(trifluoroacetic acid,TFA)溶液100 μL,充N2封管,在110 ℃的烘箱中水解4 h;冷却后将水解液转移至5 mL的离心管中,并用0.2 mL甲醇冲洗转移残余水解液,加0.2 mL甲醇后用N2吹干,如此重复加甲醇并用N2吹干3次,去除TFA,得水解样品。取本品水解的残渣,加入50 μL超纯水溶解残渣,按照“1.3.1”方法进行衍生、中和、萃取,用0.45 μm微孔膜过滤后,超声脱气,进行HPLC检测分析[15-18]。
1.3.3 色谱条件 色谱柱:Welch Xtimate(4.6 mm×250 mm,5 μm);流动相:以0.1 mol/L磷酸盐缓冲溶液(用3 mol/L 氢氧化钠调节pH值至6.7)为流动相A,乙腈为流动相B,梯度洗脱(表2);检测波长:260 nm;柱温:30 ℃;流速:1.0 mL/min;进样量:10 μL。
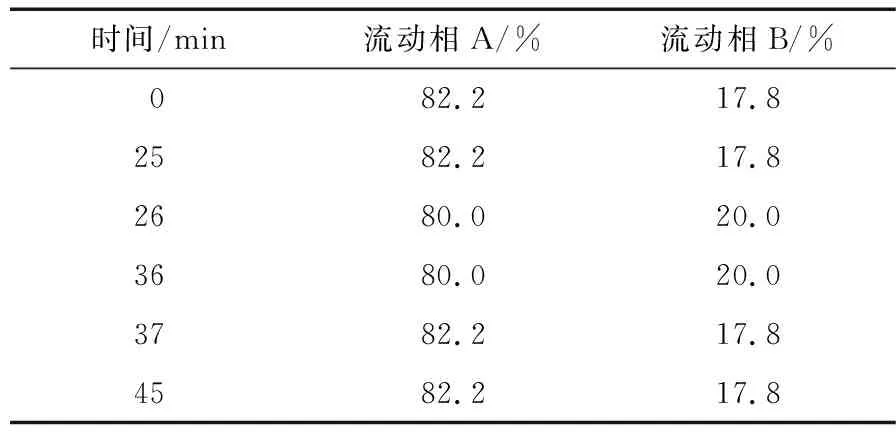
表2 梯度洗脱程序Table 2 Gradient elution program
1.4 苯酚-硫酸法测定葛仙米多糖提取物的总糖含量
1.4.1 溶液的配置 精确称取重蒸酚25.0 g,加水溶解后,转移至500 mL的容量瓶中,稀释至刻度处,混匀,得到质量浓度为5%的苯酚溶液,将其保存在4 ℃中,备用。标准葡萄糖溶液配置:精准称取无水葡萄糖10.0 mg于100 mL容量瓶中,加入蒸馏水至刻度处、摇匀,配成葡萄糖溶液浓度为0.10 mg/mL,备用[19]。
1.4.2 标曲的绘制 准确吸取葡萄糖标准溶液0.00,0.10,0.20,0.40,0.60,0.80,1.00 mL置于25 mL的离心管中,补加水至2.0 mL,加入5%的苯酚溶液1.0 mL,混合均匀后,继续加入浓硫酸10 mL,混匀后,沸水浴2 min,冷却至室温,在485 nm波长处以试剂空白为参比,1 cm比色皿测定吸光光度值[19]。以葡萄糖质量为横坐标,吸光光度值为纵坐标,绘制标曲,见图1。
1.4.3 样品中总糖的测定 称取0.1 g的葛仙米多糖提取物在水中溶解,定容至100 mL(V1)。准确吸取2 mL(V2)的葛仙米多糖提取物溶液置于25 mL的离心管中,加入10 mL无水乙醇,混匀,于4 ℃冰箱中静置4 h,离心(5 000 r/min, 5 min),弃去上清液,残渣用2 mL 80%乙醇洗涤,洗涤3遍,残渣溶解定容至25 mL(V3)[19]。准确吸取前处理好的葛仙米多糖提取物1.0 mL(V4),补加水至2.0 mL,然后照“1.4.2”方法测定吸光光度值,依照标曲计算葛仙米多糖提取物的浓度,按式(1)计算总糖含量[19]。

图1 葡萄糖标准曲线Figure 1 Standard curve of glucose
(1)
式中:
X——总糖含量,%;
m1——样品中葡萄糖测定量,mg;
m2——样品的质量,g;
V1——样品提取液的定容体积,mL;
V2——沉淀粗多糖所用溶液的体积,mL;
V3——粗多糖溶液体积,mL;
V4——测定样品溶液体积,mL。
2 结果与分析
2.1 单糖PMP衍生物的色谱图及线性关系
单糖PMP衍生物的标样图以及代表性样品单糖衍生图见图2。表3表明:甘露糖、氨基葡萄糖、鼠李糖以及葡萄萄醛酸等9种单糖的衍生物在0.1~2.0 mg/mL时线性关系良好。
2.2 葛仙米多糖水解单因素试验
2.2.1 水解时间的考察 按“1.3”水解衍生多糖样品,分别考察水解2,3,4,5,6 h多糖的水解程度。最后结果如表4所示,随着水解时间的延长,单糖的总峰面积增加,水解4 h时最大,随后减少。由此可见,水解4 h最佳。
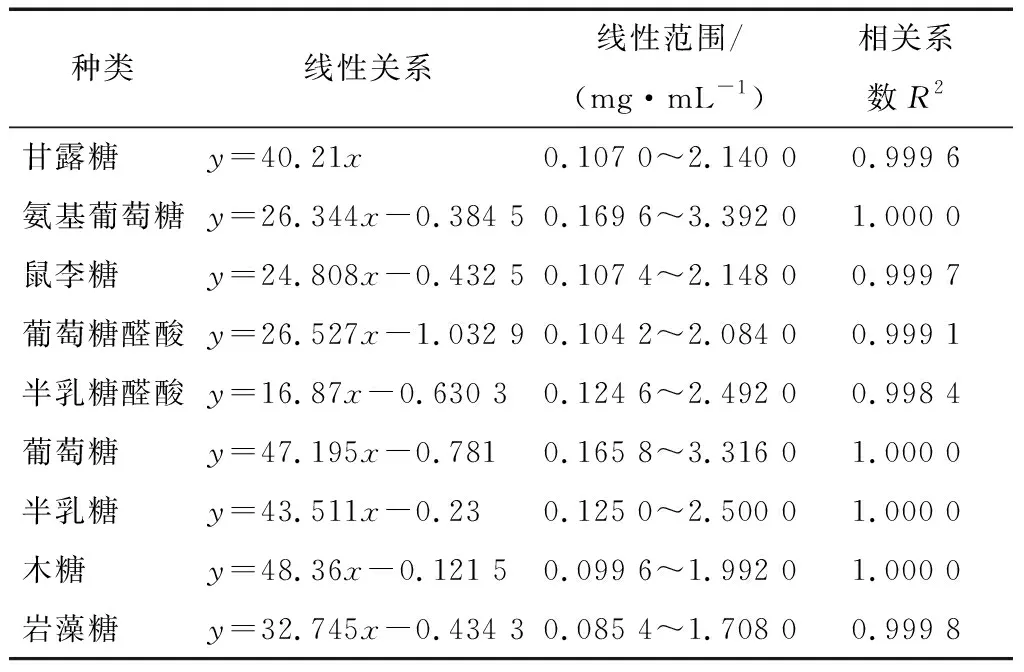
表3 单糖的标准曲线Table 3 The monosaccharide of lineal relation
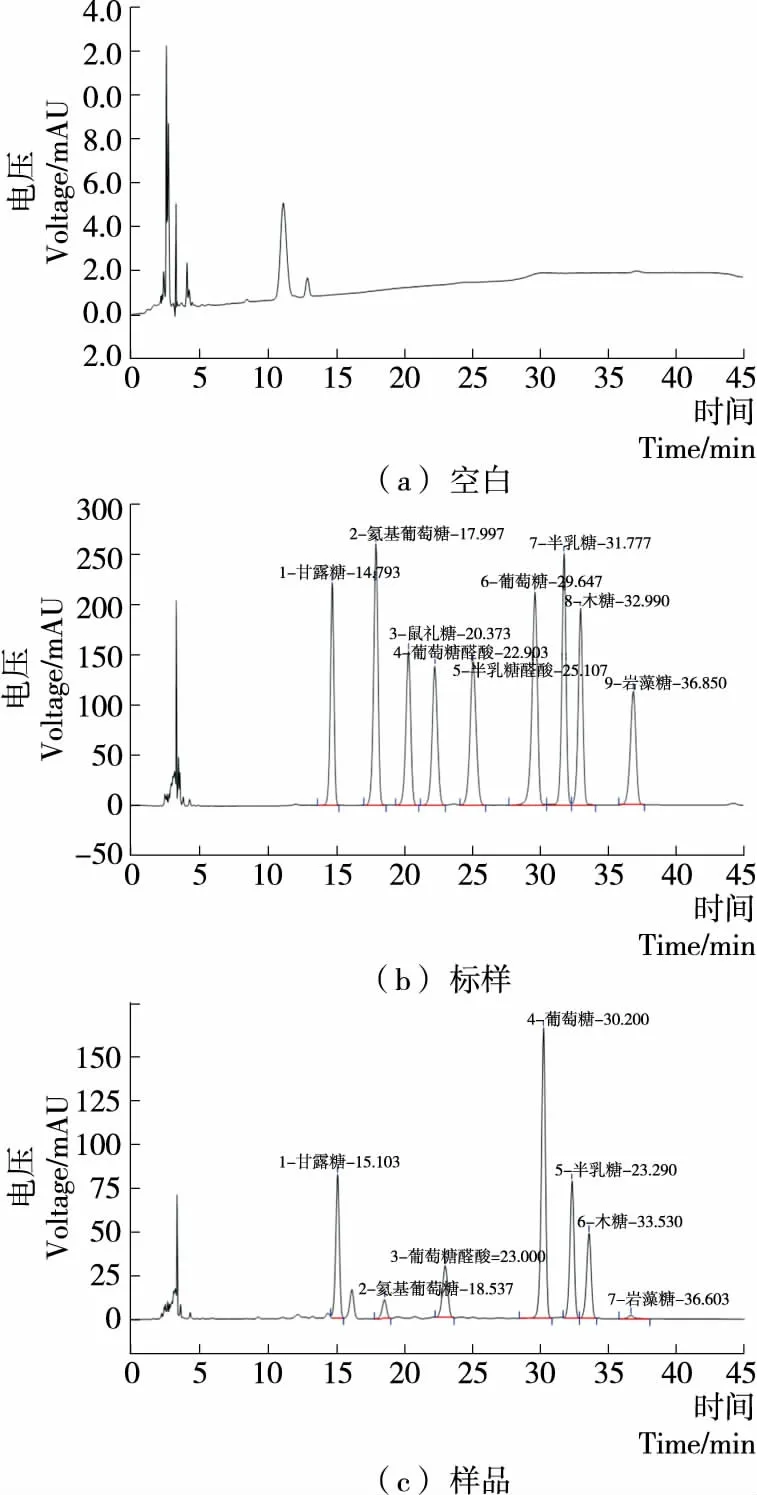
图2 多糖水解样品和标样衍生物的HPLC分离效果图Figure 2 Separation of polysaccharide hydrolysate and standards derivatives by HPLC
2.2.2 TFA浓度的考察 照“1.3”项,水解衍生多糖样品,分别考察不同浓度TFA(2,3,4,5,6 mol/L)对多糖水解的影响。如表5所示,随TFA的浓度的增加,单糖的总峰面积先增加然后降低,当TFA的浓度为3 mol/L时水解衍生结果最佳。
2.2.3 水解温度的考察 照“1.3”项,水解衍生多糖样品,分别考察不同温度(100,110,120 ℃)对多糖水解的影响,如表6所示,根据峰面积总和的大小,确定110 ℃最佳。
2.3 系统适用性试验
取“1.3.1”和“1.3.2”的对照品溶液和样品溶液,按“1.3.3”的色谱条件进行分析,同时做空白试验,记录色谱图,9种单糖分离良好,理论板数均不低于5 000(见图2)。
2.4 方法学考察
2.4.1 仪器精密度 按“1.3.1”项下衍生混合标准溶液,再依照“1.3.3”项下色谱条件进样,连续进样6针,计算其RSD,测定结果见表7。结果表明仪器的精密度良好。
2.4.2 精密度试验 分别精密量取同一对照品溶液50 μL,置于15 mL离心管中,共6份,按“1.3.1”项下衍生条件处理。然后,照“1.3.3”项下的色谱条件进行分析,计算甘露糖、氨基葡萄糖、鼠李糖以及葡萄糖醛酸等9种单糖衍生物的峰面积以及RSD值,测定结果见表8。结果表明本试验精密度良好,说明样品水解衍生的处理方法可靠。
2.4.3 稳定性试验 精密量取同一对照品溶液50 μL,置于15 mL离心管中,按“1.3.1”项下衍生条件处理。放置在室温条件下,分别于0,1,2,4,8,16,24,48 h,按照“1.3.3”的色谱条件进行分析,计算9种单糖衍生物峰面积的RSD值,结果见表9。结果表明衍生后9种单糖溶液24 h内均稳定。
2.4.4 重复性试验 吸取5 mg/mL的葛仙米多糖提取物样品溶液0.1 mL,按“1.3.2”的试验方案,取样6份水解衍生处理,然后照按“1.3.3”的色谱条件进行分析,计算样品中主要5种单糖的RSD,结果见表10。其重复性尚可,葡萄糖醛酸以及木糖的RSD偏高,可能是水解后的稳定性稍差。
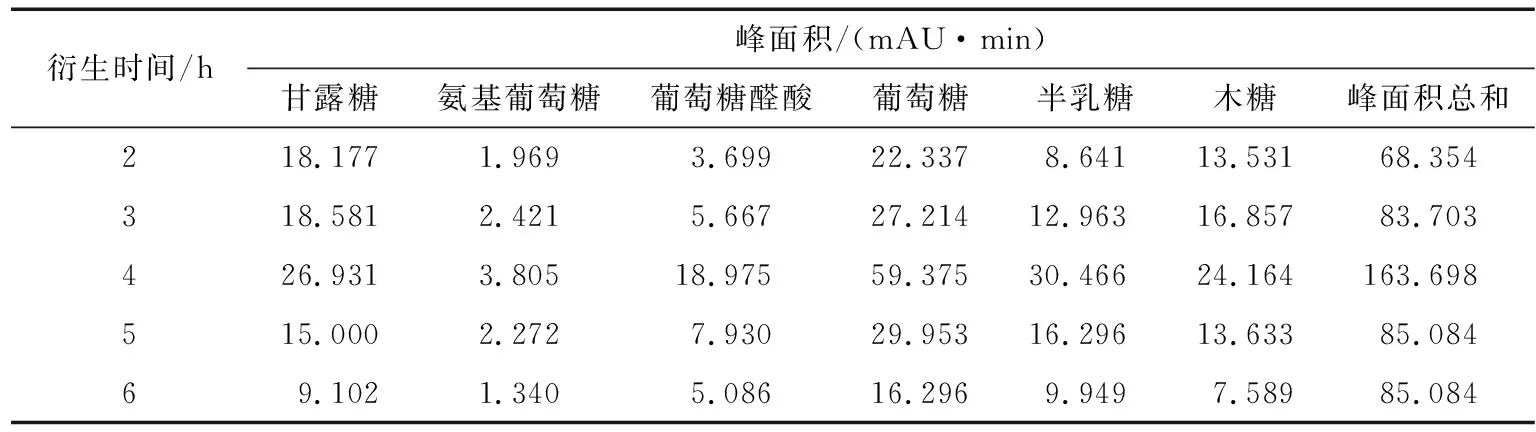
表4 水解时间对单糖峰面积的影响Table 4 The analysis of hydrolysis time (n=5)
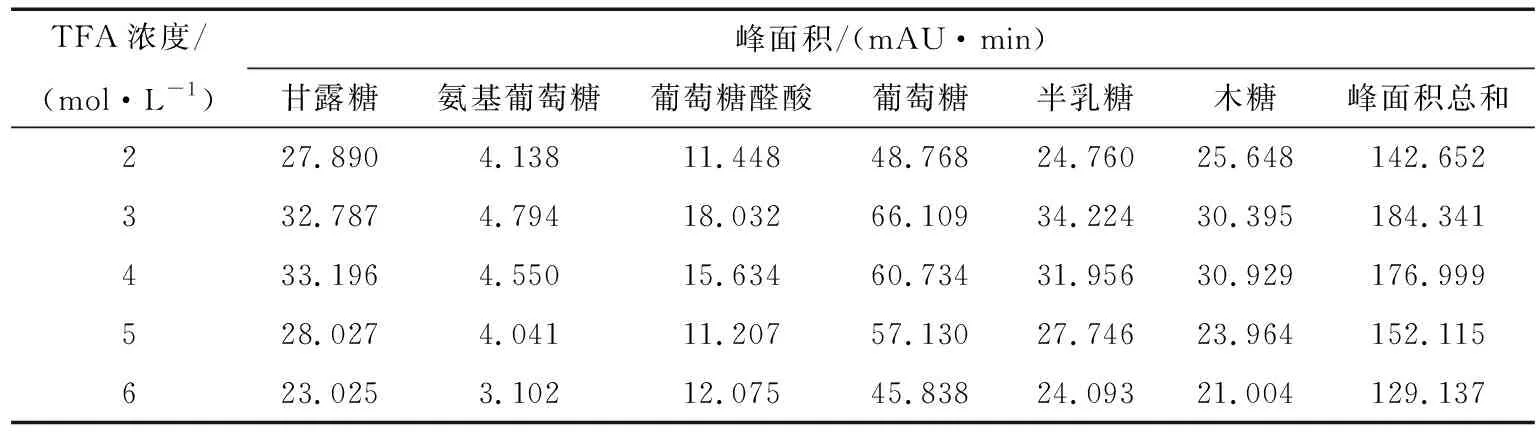
表5 TFA浓度对单糖峰面积的影响Table 5 The analysis of TFA concentration (n=6)
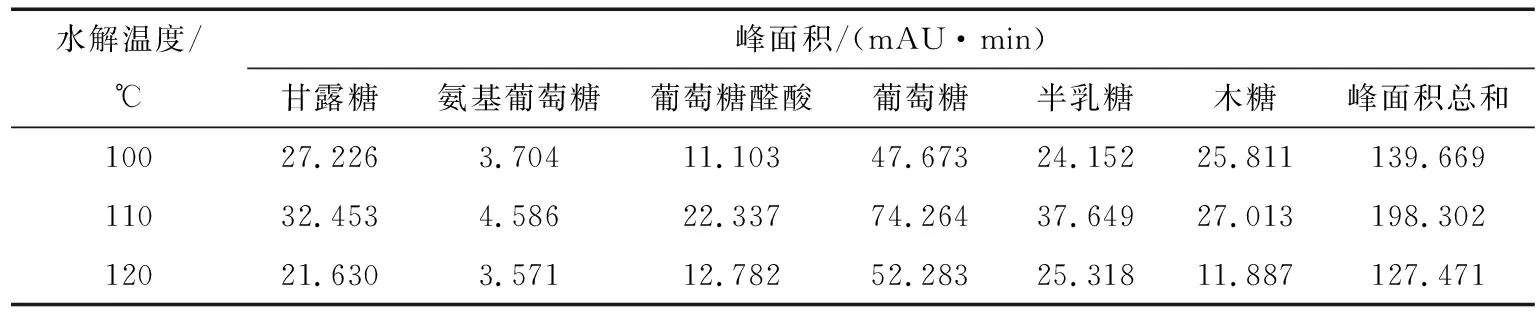
表6 水解温度对单糖峰面积的影响Table 6 The analysis of hydrolysis temperature (n=3)

表7 仪器精密度Table 7 The precision of instrument
2.4.5 回收率试验 吸取5 mg/mL的葛仙米多糖提取物样品溶液0.05 mL,同时每份样品中加入0.05 mL混合标准溶液(1 mg/L),按“1.3.2”的试验方案,取样6份水解衍生处理,然后照按“1.3.3”的色谱条件进行分析,计算样品中主要9种单糖的回收率,结果见表11。回收率在80%~110%时,葡萄糖与甘露糖的回收率偏低。
2.4.6 检出限试验 精密量取“1.3.2”项下的混合标准溶液(1 mg/L) 0.25 mL置于100 mL量瓶中,用水稀释至刻度,摇匀。按“1.3.1”的衍生条件处理。然后,照“1.3.3”的色谱条件进行分析,以信噪比(S/N)为3计算9种单糖的检出限为4.27~8.48 μg/mL。检出限计算结果见表12,与化学法相比,HPLC方法的检出限更低。
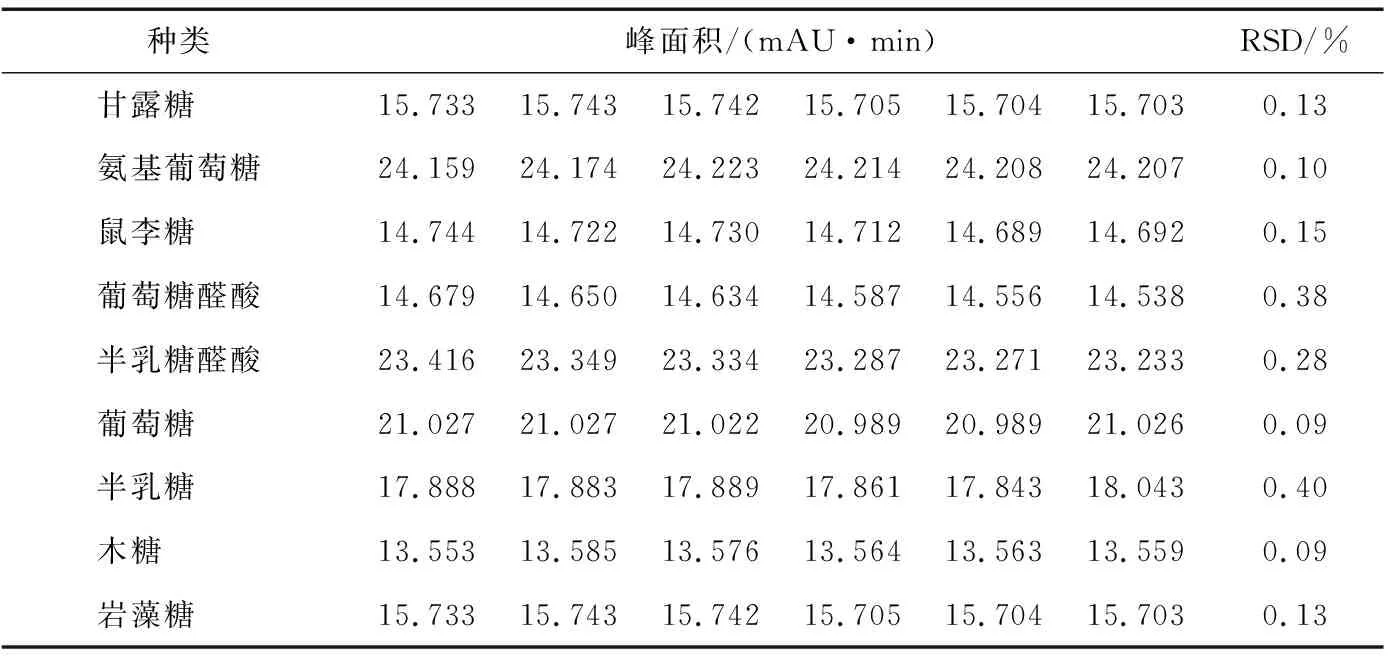
表8 精密度试验Table 8 The precision test (n=6)
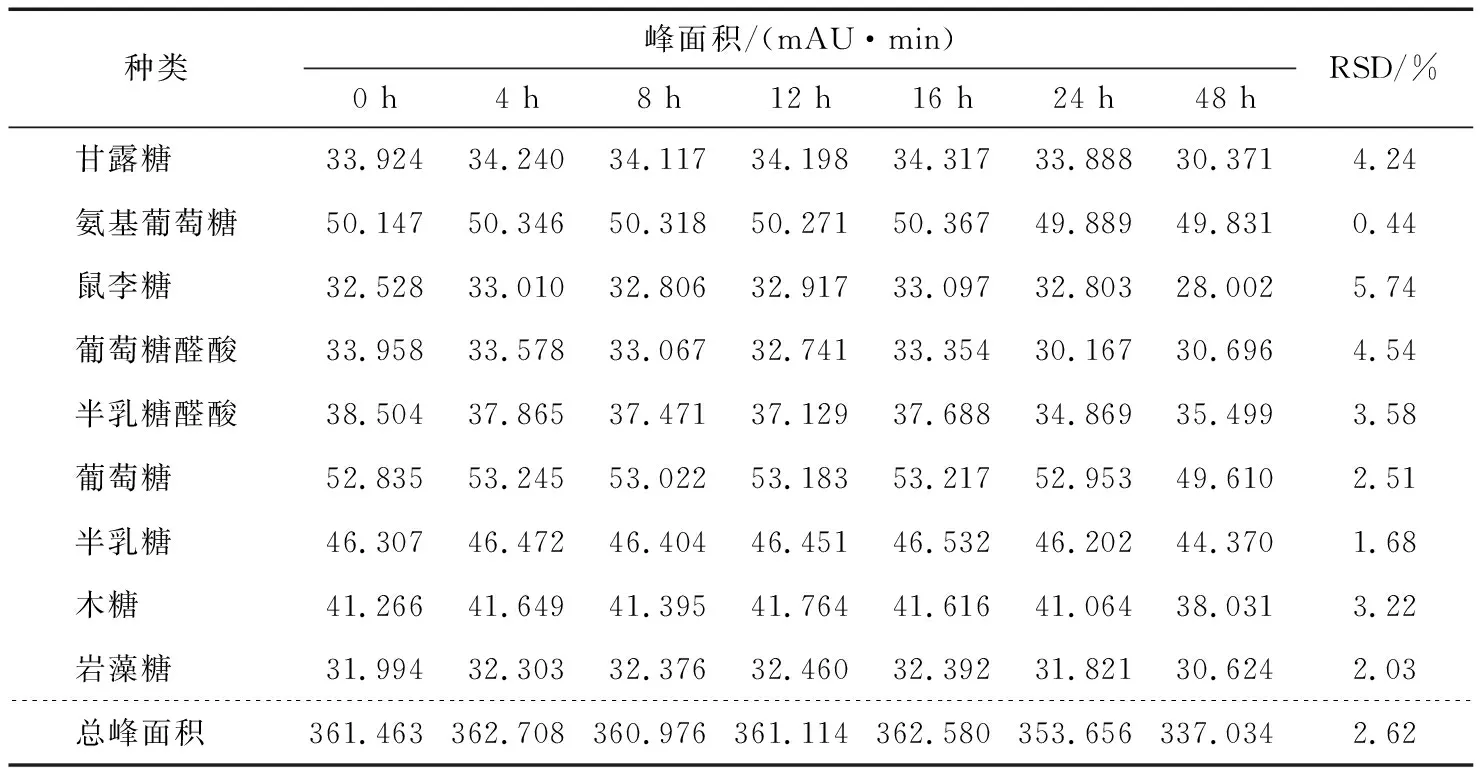
表9 稳定性试验Table 9 The stability test (n=7)

表10 重复性试验Table 10 The reproducibility test (n=6)

表11 回收率试验Table 11 The recovery test (n=6)
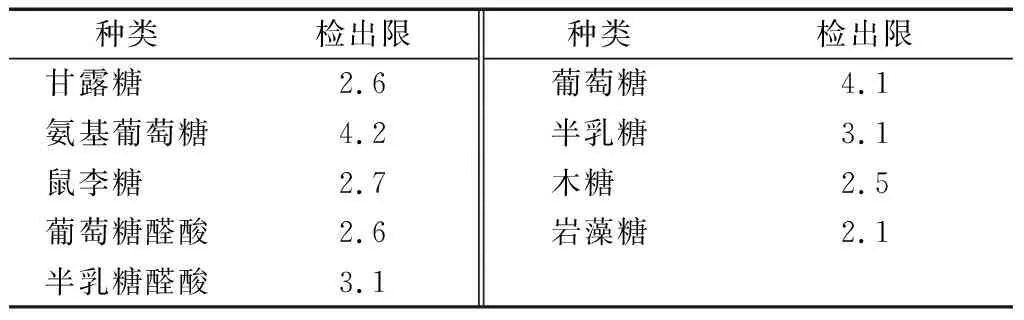
表12 检出限Table 12 The detection limit (n=9) μg/mL
2.4.7 样品测定 按“2.2”的方法制备对照品溶液和供试品溶液(共6批样品),按“2.1”的色谱条件进行分析测定。以单糖的含量计算多糖的含量,选取6种主要的单糖来计算,即甘露糖、氨基葡萄糖、葡萄糖醛酸、葡萄糖、半乳糖以及木糖,9种单糖含量的计算结果见表13、14。同样6批次样品用化学法测定总糖含量,结果见表15。可以看出化学法测定结果整体数值偏高,平行试验结果差别较大。
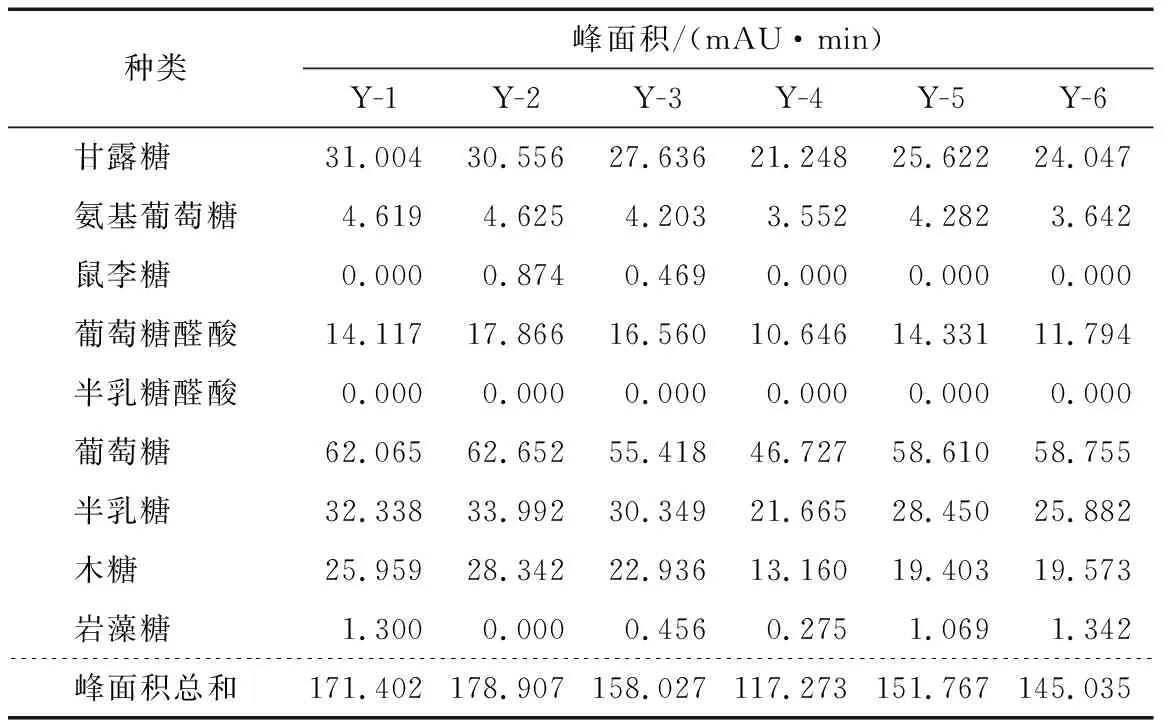
表13 HPLC法样品测定结果Table 13 The content determination of samples by HPLC (n=6)
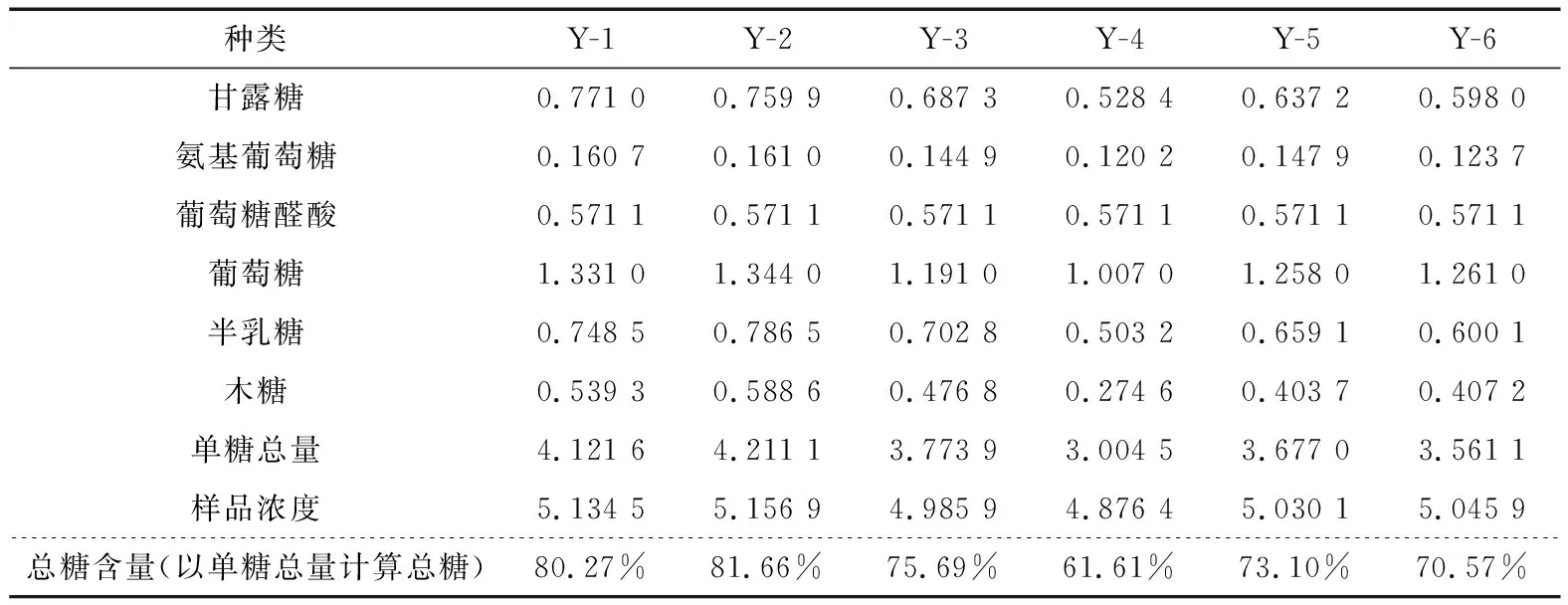
表14 HPLC法单糖含量的计算结果Table 14 The content determination of monosaccharide by HPLC (n=6) mg/mL

表15 化学法测定总糖含量的计算结果Table 15 The content determination of polysaccharides by chemical method (n=6)
2.5 单糖含量结果分析
柱前PMP衍生高效液相色谱法测多糖,以单糖总量计算多糖,存在操作步骤较多,数值整体偏低的问题。但相较于化学法,该方法准确可靠,线性关系良好,重复性和专属性好,可以很好地完成葛仙米多糖提取物中的单糖组成及定性定量分析。虽然化学法操作步骤简单、易行,但其测定值平行性差,检出限不高,结果的可靠性较低。另外,按照上述所建立的水解衍生方法,并针对此方法进行方法学考察,测定6批样品,同时与化学法进行了比较发现,其中野生的葛仙米多糖提取物多糖含量高于人工养殖的,夏秋季采样的葛仙米多糖提取物所测多糖含量亦高于其他季节,可能是夏季葛仙米生长旺盛,存储多糖含量较高。野生葛仙米的多糖提取物中的多糖含量明显高于养殖的,可能有以下几个原因:① 养殖的密度偏大;② 模拟野生环境可能有所欠缺;③ 经纬度的问题,日照、温度等有所影响。
3 结论
本试验采用三氟乙酸水解葛仙米多糖提取物,对水解条件进行了单因素考察。通过考察发现,在110 ℃下,采用3 mol/L 的三氟乙酸水解4 h,其水解效果更好。然后,进行方法学验证,结果表明,相较于化学法新建立的分析方法可靠准确、灵敏度高,可同时用于9种单糖的分析,且分离效果较理想。样品测定结果显示,葛仙米多糖提取物中主要含有甘露糖、氨基葡萄糖、葡萄糖醛酸、葡萄糖、半乳糖及木糖6种单糖,其中甘露糖、葡萄糖、半乳糖以及木糖含量较高,与莫开菊等[15]报道的结果类似,通过对比,发现葛仙米多糖提取物中有一种单糖种类不一致,其文中报道含有阿拉伯糖。经加标试验确认,木糖与阿拉伯糖保留时间极为接近,样品中峰的保留时间与木糖衍生物一致,最终确认葛仙米多糖提取物中的单糖组成之一应是木糖。不足之处在于所测样品批次少,野生葛仙米的样品难以收集,没能比较不同月份以及不同年份野生和人工养殖的葛仙米中多糖含量的差异,如有大样本的数据,更能找出其中的规律,为葛仙米的人工养殖提供科学的依据。
此外,现有研究表明葛仙米多糖的分子量与其生物活性存在直接关联,但由于多糖结构的复杂性,大部分研究都只是在一级结构上。而葛仙米多糖的研究起步较晚,相关的生物活性研究亦较少。确定葛仙米多糖单糖的组成和含量可以为进一步研究、开发葛仙米的相关活性提供理论基础[3,10-11]。
