美罗培南与亚胺培南治疗重症感染的疗效及其对降钙素原、C-反应蛋白的影响对比分析
2018-10-10卢珏
卢珏
江苏省昆山市第二人民医院药剂科,江苏昆山 215300
感染性疾病是临床常见病和多发病之一,且发病率呈逐年上升态势,感染性疾病特别是重症感染严重威胁着患者的生命。重症感染临床以高热、寒战等为首发症状,易出现脓毒血症、感染性休克、弥散性血管内凝血(DIC)等危重症[1]。虽然近年来临床在抗感染治疗和生命功能支持方面取得了显著成效,但重症感染的致死率仍高达30%。抗感染治疗是重症感染治疗中的最重要手段,选择精准的抗生素是治愈疾病和降低致死率的关键。研究发现,碳青霉烯类抗生素具有超广谱抗菌活性,能够覆盖大部分引起重症感染的需氧菌及厌氧菌,对部分耐药菌株仍保持较高的抗菌活性[2]。降钙素原(procalcitonin,PCT)作为一种指标蛋白,在患者出现严重细菌、真菌等感染时,血浆中PCT水平急剧升高,且能反应全身炎症的活跃程度;血浆中的C-反应蛋白(C-reactive protein,CRP)能够激活补体并且增强吞噬细胞的作用而抵抗细菌的侵袭,CRP的上升水平能够反应细菌感染的严重程度。该研究收集2017年4月—2018年3月期间该院收治的64例重症感染患者的人口学资料和临床数据,回顾性分析重症感染患者应用碳青霉烯类抗生素美罗培南和亚胺培南的疗效及其对PCT和CRP的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的64例重症感染患者为研究对象,回顾性分析患者的治疗方案,根据抗感染药物选择分为美罗培南组和亚胺培南组。美罗培南组34例,患者年龄 39~60 岁,平均(50.71±6.88)岁;男 18 例(52.94%),女 16例(47.06%);其中重症肺炎 13例,急性胰腺炎8例,胆道感染5例,细菌性痢疾4例,尿路感染4例;亚胺培南组30例,患者年龄41~59岁,平均(51.35±7.14)岁;男 16 例(53.33%),女 14 例(46.67%);其中重症肺炎12例,急性胰腺炎6例,胆道感染6例,细菌性痢疾3例,尿路感染3例。2组患者之间年龄、性别、疾病种类之间差异无统计学意义(P>0.05)。该研究经该院伦理委员会审查通过,受试者均知晓该研究的目的和经过,并签署知情同意书。
1.2 纳入及排除标准
纳入标准:重症肺炎标准参照美国《成人医院获得性肺炎和呼吸机相关性肺炎临床实践指南》[3]。主要指除肺炎常见呼吸系统症状外合并急性呼吸衰竭及其他器官功能障碍。
严重腹腔感染标准参照2001年美国外科感染学会和美国感染病学会发布的《腹腔内感染诊治指南》[4]。主要指合并脓毒血症或合并脓毒血症休克的急性胰腺炎、胆道感染和消化道穿孔等继发腹腔感染。
严重尿路感染标准参照《尿路感染诊断与治疗中国专家共识(2015版)》[5]。主要指病原菌在泌尿系统中生长并繁殖,进而侵犯泌尿道黏膜或组织而引起的严重炎症反应,并伴有发热、侧腹痛等症状,并能导致肾损伤甚至肾衰竭。
排除标准:①年龄<18岁或≥70岁者;②入院前60 d内有激素治疗史或免疫抑制剂治疗史者;③妊娠期及哺乳期女性;④合并严重基础疾病者,如重度高血压等;⑤合并神经系统疾病或合并精神障碍依从性差者。
1.3 治疗方法
两组患者入院后均行各项相关检查,心电监护,给予吸氧、糖皮质激素等生命支持治疗。抗感染方案:美罗培南组:给予患者注射用美罗培南(批准文号:国药准字H20010250),给药方法:取1.0 g本品(规格:0.5 g/瓶)溶于100 mL 0.9%氯化钠注射液中,静脉滴注(时间≥40 min),q8 h;亚胺培南组:给予患者注射用亚胺培南西司他丁钠 (进口商品注册证号:H20130347;批准文号:国药准字 J20130123),给药方法:取1.0 g本品(规格:亚胺培南0.5 g和西司他丁0.5 g)溶于100 mL 0.9%氯化钠注射液中,静脉滴注(时间≥40 min),q8 h。2种方案抗感染治疗疗程均为2周。
1.4 评价指标
实验室检查指标:治疗前、后分别空腹抽取两组患者3 mL外周静脉血,检测患者降钙素原(PCT)、C-反应蛋白(CRP)、白细胞计数(WBC)及中性粒细胞计数(NE#)。
疗效评价:参照2015年《抗菌药物临床应用指导原则》[6]进行判定:痊愈:患者症状、体征、实验室检查及细菌学检查4项结果均恢复正常;显效:患者症状及体征有明显好转,但实验室检查及细菌学检查未恢复正常;好转:患者症状、体征有一定程度好转,同时实验室检查及细菌学检查未恢复正常;无效:患者病情无任何改变或进一步加重。总有效率=(治愈例数+显效例数+好转例数)/总例数。
不良反应评价:收集两组患者抗感染过程中出现的不良反应并进行准确记录。
1.5 统计方法
采用SPSS 19.0统计学软件进行数据统计,计量资料以(±s)表示,采用t检验,计数资料用[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后PCT、CRP、WBC和NE#水平对比
治疗前后两组患者的PCT、CRP、WBC和NE#指标均有不同程度的回落,治疗前后对比差异有统计学意义 (P<0.05)。两组患者治疗后各指标对比分析显示,美罗培南组患者的PCT和CRP改善程度优于亚胺培南组,差异有统计学意义(P<0.05)。见表1。
2.2 两组患者临床疗效对比
美罗培南组总有效率为94.12%,亚胺培南组总有效率为70.00%,差异有统计学意义(P<0.05)。见表2。
表1 两组患者治疗前后PCT、CRP、WBC和NE#水平对比(±s)
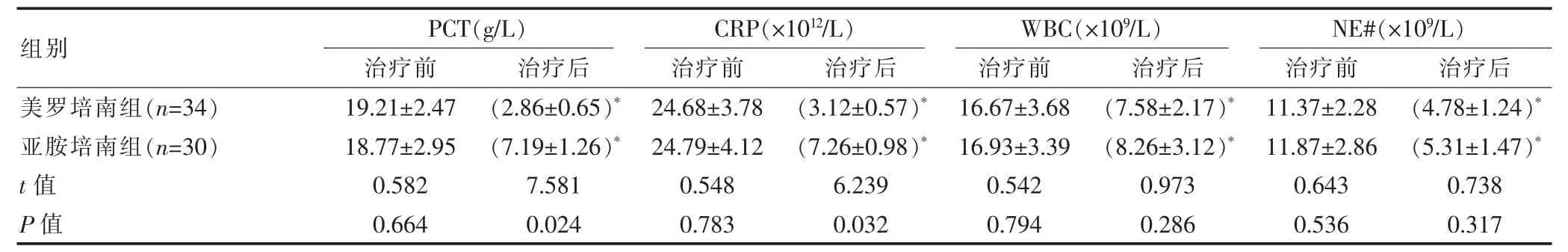
表1 两组患者治疗前后PCT、CRP、WBC和NE#水平对比(±s)
注:同一组治疗后与治疗前相比,*P<0.05。
组别美罗培南组(n=3 4)亚胺培南组(n=3 0)t值P值P C T(g/L)治疗前 治疗后C R P(×1 0 12/L)治疗前 治疗后W B C(×1 0 9/L)治疗前 治疗后N E#(×1 0 9/L)治疗前 治疗后1 9.2 1±2.4 7 1 8.7 7±2.9 5 0.5 8 2 0.6 6 4(2.8 6±0.6 5)*(7.1 9±1.2 6)*7.5 8 1 0.0 2 4 2 4.6 8±3.7 8 2 4.7 9±4.1 2 0.5 4 8 0.7 8 3(3.1 2±0.5 7)*(7.2 6±0.9 8)*6.2 3 9 0.0 3 2 1 6.6 7±3.6 8 1 6.9 3±3.3 9 0.5 4 2 0.7 9 4(7.5 8±2.1 7)*(8.2 6±3.1 2)*0.9 7 3 0.2 8 6 1 1.3 7±2.2 8 1 1.8 7±2.8 6 0.6 4 3 0.5 3 6(4.7 8±1.2 4)*(5.3 1±1.4 7)*0.7 3 8 0.3 1 7

表2 两组患者临床疗效对比[n(%)]
2.3 两组患者不良反应发生率对比
美罗培南组不良反应总发生率为14.71%,亚胺培南组不良反应总发生率为30.00%,差异无统计学意义(P>0.05)。 见表 3。

表3 两组患者不良反应发生率对比[n(%)]
3 讨论
重症感染患者入院前由于感染时间较长和不规律抗感染治疗,有些患者存在合并革兰氏阴性杆菌感染的情况,更有患者合并多重耐药(Multiple resistant bacteria,MDR)革兰阴性杆菌感染。近年来,国内外已有将亚胺培南和美罗培南用于重症感染治疗的临床实践[7]。美罗培南和亚胺培南均属于碳青霉烯类抗生素,该类抗生素抗菌谱较广,对大多数需氧菌、厌氧菌均有明显效果,能对阴沟肠杆菌等革兰氏阴性菌产生较好的抗菌效果,且这2种药物的耐药菌数量较少。
实验室检查结果显示,治疗前后两组患者的PCT、CRP、WBC和NE#指标均有不同程度的回落,均取得良好的抗菌效果,进一步对比分析两组患者治疗后各指标发现,两组CRP和PCT水平存在差异。CRP是一种急性期炎性反应蛋白,由肝脏合成,能够反映机体的炎症状态。该研究结果显示,美罗培南组治疗后CRP水平显著低于亚胺培南组 (P<0.05),提示其更有助于改善患者的炎性症状。PCT是近年来应用于临床的一种炎症标志物,且在机体感染后12 h内达到高峰,不仅能反映炎症水平,其变化幅度还能反映感染的严重程度和抗感染治疗的效果[8]。该研究结果表明,治疗后美罗培南组PCT水平为 (2.86±0.65)g/L,显著低于亚胺培南组的(7.19±1.26)g/L,而美罗培南组总有效率(94.12%)显著高于亚胺培南组(70.00%),提示其能在改善炎症反应的同时能够快速控制细菌感染,防止病情进展。国内相关研究[9]中也显示,美罗培南治疗重症感染的总有效率高于亚胺培南(95.24%vs 61.90%),与该研究结果一致。因而对于重症感染患者而言,美罗培南能够取得较好的抗感染效果。有研究显示,这种差异可能与两种药物的构效关系有关,美罗培南在其化学结构式的C-1β位引入甲基,从而提高了药物的稳定性,增强对细菌细胞膜的穿透性,对细菌产生较高的亲和力因而提高了抗菌效果[10]。值得注意的是,WBC和NE#是反映细菌感染的传统指标,该研究中两组患者治疗后WBC和NE#两项指标均有回落,然而未见统计学差异,而美罗培南组CRP和PCT的降低幅度显著大于亚胺培南组(P<0.05),提示CRP和PCT更够更灵敏的反映感染的变化情况,特别是在抗感染疗效的评价中有重要意义。
对两组患者进行不良反应分析发现,主要的不良反应集中在恶心呕吐、腹泻、转氨酶升高、皮疹和口腔真菌感染,两组患者出现的不良反应均较轻微,对症治疗后均缓解,并未延长住院时间。两组不良反应发生率差异无统计学意义(P>0.05)。临床应用中,应动态监测各项指标,并根据患者症状体征调整给药剂量/间隔并辅以对症处理,同时,重点患者可行血药浓度监测(Therapeutic Drug Monitoring,TDM),保证合理血药浓度规避不良反应。就该研究而言,2种抗感染药物的使用均有较高的安全性,然而鉴于该研究例数偏少,因此对不良反应及安全性的评价还需要进行大量样该研究来进一步论证。
综上所述,对于重症感染患者而言,在排除病理、生理因素和用药禁忌后,应优选美罗培南用于抗感染治疗。联合监测PCT和CRP对抗感染效果进行精确评价,提高治愈率,同时密切关注患者不良反应,适时调整用药方案,使患者获得满意治疗效果和良好预后。
