普通小麦–大赖草易位系T5AS-7LrL·7LrS分子细胞遗传学鉴定
2018-10-10王林生张雅莉南广慧
王林生 张雅莉 南广慧
普通小麦–大赖草易位系T5AS-7LrL·7LrS分子细胞遗传学鉴定
王林生*张雅莉 南广慧
河南科技大学农学院 /洛阳市作物遗传改良与种质创新重点实验室, 河南洛阳 471023
大赖草对赤霉病具有较好的抗性, 将大赖草赤霉病抗性基因转入普通小麦, 对拓宽小麦赤霉病抗性基础有重要意义。本研究在获得抗赤霉病普通小麦–大赖草异附加系基础上, 采用60Co-γ射线(1200 Rad, 剂量率100 Rad min−1)处理小麦–大赖草二体附加系DA7Lr, 并用处理后的花粉授给去雄的普通小麦中国春, 对其M1代种子根尖细胞有丝分裂中期染色体进行GISH分析, 获得1株具有一条普通小麦–大赖草易位染色体的植株, 对其自交后代中具有2条易位染色体植株的花粉母细胞减数分裂中期I观察发现, 2条易位染色体形成了稳定的环状二价体, 表明该植株为纯合体。利用顺序GISH–双色FISH分析, 结合C-分带、小麦D组专化探针Oligo-pAs1-2和B组专化探针Oligo-pSc119.2-2, 进一步鉴定出该易位系为T5AS-7LrL·7LrS, 同时筛选出可追踪该易位系的3个EST-STS分子标记, 即BE591127、BQ168298和BE591737。该易位系的育成也为小麦赤霉病遗改良提供了新种质。
普通小麦–大赖草易位系; 分子细胞遗传学; 赤霉病抗性;60Co-γ射线
赤霉病是世界小麦主要病害之一, 随着全球气候的变暖, 在我国由南向北有逐渐蔓延加重趋势, 近几年黄淮麦区的赤霉病大发生已得到证实, 仅河南省年发生面积超过100万公顷。2017年国审通过的20个半冬性小麦品种及河南省审定通过的27个小麦品种全部感赤霉病, 且多为高感, 究其原因是遗传基础狭窄。目前, 生产上使用的赤霉病抗源局限于苏麦3号、Frontana等少数品种及其衍生系, 致使我国小麦主产区存在巨大的安全隐患。寻找与拓宽赤霉病抗性资源, 选育和利用抗赤霉病小麦品种是一条经济有效的措施, 越来越受到重视。
大赖草()是一种与小麦亲缘关系较远的多年生植物, 具有耐盐、抗旱、抗多种病害等多种优良特性[1-2], 尤其高抗赤霉病, 是一种具有潜在应用价值的基因源。自Mujeeb-Kazi和Rodriguez[3]报道大赖草抗小麦赤霉病以来, 许多遗传育种工作者开展了大量的研究工作。南京农业大学细胞研究所通过远缘杂交、回交获得并鉴定出3个高抗赤霉病的普通小麦一大赖草附加系AddLr.2、AddLr.7和AddLr.14[4], 其中Lr.2和Lr.14分别属于小麦第7和第5部分同源群[5]。由于异附加系携带的是整条大赖草染色体, 在导入有益基因的同时也伴随带入对产量、品质等农艺性状不利的冗余基因。为此研究者利用电离辐射、杀配子染色体诱导和遗传控制体系等方法创造易位系, 以减少不利基因对普通小麦造成的不良影响。刘文轩等[6-8]通过辐射Lr.14 (5Lr)二体附加系和Lr.2 (7Lr)、Lr.7单体附加系, 选育了纯合易位系T6BL·6BS-L.14L、T4BS·4BL- 7Lr#1S-1、T02和T08。杨宝军等[9]通过辐射Lr.2和Lr.7单体异附加系获得易位系NAU618和NAU601。袁建华等[10]采用杀配子染色体诱导方法得到3个易位系, 分别为T1DS·Lr7L、T4AL·4AS-Lr7S和T1BL-Lr2S。王林生等[11]通过60Co-γ射线处理小麦–大赖草二体附加系DA5Lr雌配子, 获得普通小麦–大赖草染色体相互易位系T7DS·5LrL/T5LrS·7DL; 崔承齐等[12]通过电离辐射, 得到T7BS·7Lr#1S和T2AS·2AL-7Lr#1S易位系。Wang和Chen[13]证实7Lr#1S上存在抗赤霉病的主效基因, 后人把7Lr#1S携带的抗赤霉病基因定位在该染色体的近端部[12,14]。
本研究利用染色体C-分带、荧光原位杂交、分子标记技术和赤霉病抗性鉴定等技术, 对抗赤霉病的普通小麦–大赖草异附加系DA7Lr成熟花粉辐射的后代进行鉴定, 筛选出抗赤霉病的普通小麦–大赖草易位系, 为小麦抗赤霉病育种提供新的基因资源。
1 材料与方法
1.1 试验材料
DA7Lr为普通小麦–大赖草二体异附加系[5], 用60Co-γ射线照射其开花期麦穗, 照射剂量为1200 Rad, 剂量率100 Rad min−1。普通小麦中国春去雄, 用上述辐照处理材料的花粉授粉, 其后代种子自交, 获得M2代, 从中鉴定出纯合易位系。抗赤霉病对照品种苏麦3号和感赤霉病品种绵阳85-45均由河南科技大学农学院小麦遗传育种研究室引进保存。
1.2 染色体制片
1.2.1 根尖细胞有丝分裂中期 将小麦种子放入垫有湿滤纸的培养皿内发芽(23℃), 待根长至1.0~2.0 cm时, 剪取1~2条种子根在冰水中处理20~24 h。用无水乙醇∶冰醋酸(v:v)为3︰1的固定液固定, 4℃冰箱中保存3 d, 然后于45%醋酸中进行根尖压片, 相差显微镜下观察染色体, 放入−70℃冰箱或液氮中冷冻揭去盖玻片, 脱水备用。
1.2.2 花粉母细胞减数分裂中期I 挑取处于减数分裂中期I的花药, 用上述固定液固定, 按根尖细胞有丝分裂中期制片方法压片备用, 用于易位系花粉母细胞染色体配对分析。
1.3 染色体C-分带和荧光原位杂交
参照Gill和Friebe[15]的方法进行染色体C-分带。参照Mukai等[16]描述的荧光原位杂交方法, 并稍加修改。参照Zhang等[17]的方法顺次原位杂交, 首先以荧光素Fluorescein-l2-dUTP标记的大赖草基因组DNA为探针进行GISH (genomichybridization), 通过SPOT CCD (charge coupled device)获取FISH (fluorescencehybridization)图像, 参照Pedersen和Linde-Laursen[18]描述的方法将信号洗脱, 再以红色荧光素TAMRA (6-carboxytetramethylrhodamine)标记的B组专化探针Oligo- pSc119.2-2 (其寡核苷酸重复序列为6-TAMRA-5′- TTCCA CGATT GACGA TTCCG GGGGT GCGTT TACGT GTCCG TCGTC-3′)和绿色荧光素FAM (6-carboxyfluorescein)标记的D组专化探针Oligo-pAs1-2 (其寡核苷酸重复序列为FAM-5′- CATTT CATCC ACATA GCATG TGCAA GAAAT TTGAG AGGGT TACGG CAAAA ACTGGAT-3′)进行双色荧光原位杂交, 用DAPI (4’,6-diamidino-2- phenylindole)染色; 单色荧光原位杂交用碘化丙锭(propidium iodide, PI)染色。SPOT CCD获取图像, 参考Tang等[19]的标准FISH图谱分析图像结果。所用绿色荧光素和两种专化探针均由上海英骏生物科技有限公司合成。
1.4 分子标记鉴定
利用SDS法[20]提取植物基因组DNA。PCR反应体系总体积10 μL, 含1× buffer 10mL, 1.5 mmol L−1MgCl2, 模板DNA 20 ng, 200 mmol L−1dNTP, 终浓度为0.2 μmol L−1的左右引物, 0.5 UDNA聚合酶。反应程序为94℃预变性3 min; 94℃变性30 s, 50~60℃退火40 s, 72℃延伸50 s, 34个循环; 72℃延伸10 min, 4℃保存。扩增产物经8%非变性聚丙烯酰胺凝胶电泳, 硝酸银染色后照相。
从小麦SNP数据库(https://wheat.pw.usda.gov/ SNP/new/pcr_primers.shtml)选择位于小麦第7同源群上的81对EST-STS引物进行PCR扩增, 筛选出可追踪易位系的3对特异引物(表1)。
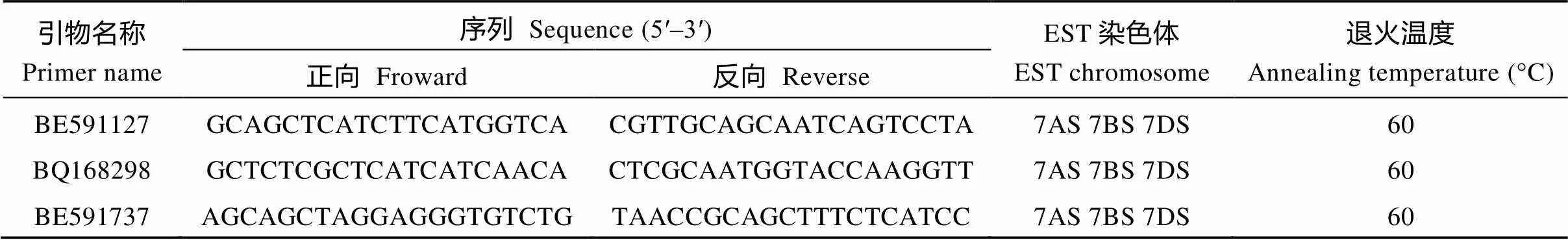
表1 鉴定易位染色体的特异性引物
1.5 赤霉病抗性鉴定
在河南科技大学开元校区农场进行抗性鉴定, 按照随机区组设计, 每个处理3次重复, 每个小区播种20行, 行长2 m, 行距21 cm, 株距5 cm, 开沟点播。采用王裕中等[21]的单花滴注法接种禾谷镰刀菌(由河南科技大学林学院植物病理学系徐建强博士提供菌种), 接种后早、晚2次喷雾, 保证发病湿度。2015—2017年连续3年均使用编号为LHLY-2的高强毒菌株分生孢子悬浮液接种, 每小区接种10穗, 接种21 d后调查接种穗的发病小穗数和总小穗数。病小穗率(%) = (病小穗数/总小数) × 100。采用SPSS20.0软件分析不同材料间的抗病性差异。
2 结果与分析
2.1 易位系T5AS-7LrL·7LrS的分子细胞遗传学鉴定
用DA7Lr经辐射处理的花粉, 授给已去雄的中国春, 获得11粒种子, 发现其中编号为NGH-01的单株具有1条普通小麦–大赖草易位染色体。从该材料自交后代(M2代)种子中得到一株含有2条易位染色体的单株, 有丝分裂中期染色体制片观察结果显示2= 44 (图1)。
以绿色荧光标记的大赖草基因组DNA作为探针, 对NGH-01纯合单株根尖染色体制片进行GISH分析。在450~490 nm激发光波长下观察到易位染色体的大赖草片段有弥散的黄绿色荧光杂交信号, 且染色体末端的荧光杂交信号明显强于其他部分, 小麦染色体的易位片段大约占易位染色体短臂的1/2, 而大赖草染色体易位片段占整个易位染色体的长臂及短臂的1/2区段, 约占易位染色体全长的80%, 属于染色体大片段易位(图1-A)。
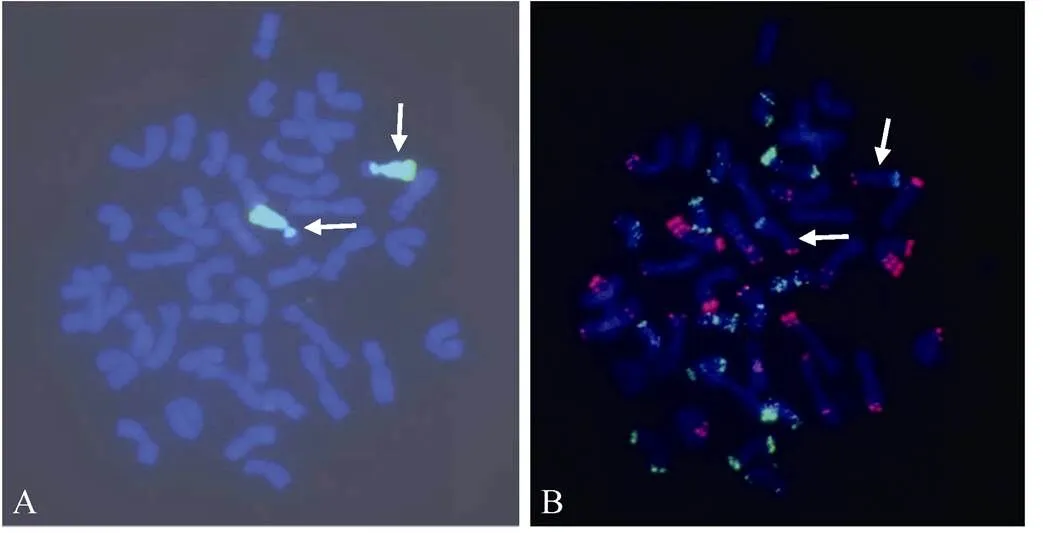
图1 易位系T5AS-7LrL·7LrS荧光原位杂交(2n=44)
有丝分裂中期的顺次GISH-FISH, A图中绿色信号为Fluorescein-l2-dUTP标记的大赖草基因组DNA, B图中的红色信号为TARAM标记的Oligo-pSc119.2-2, 绿色信号为6-FAM标记的Oligo-pAs1-2, 箭头指示易位染色体。
Sequential GISH–FISH of mitotic metaphase chromosomes. In panel A,genomic DNA was labeled with fluorescein-12-dUTP and visualized with green signals. In panel B, Oligo-pSc119.2-2 was labeled with TARAM and visualized with red signals ,and Oligo-pAs1-2 was labeled with 6-FAM and visualized with green signals. The arrows show translocation chromosomes.
将上述片子的信号洗脱干净, 再以红色荧光标记的小麦B组专化探针寡聚核苷酸Oligo-pSc119.2-2和绿色荧光标记的小麦D组专化探针寡聚核苷酸Oligo-pAs1-2为探针进行双色FISH分析, 发现在易位染色体短臂顶端(小麦染色体片段)有两个比较明显的红色点状杂交信号, 但在小麦染色体片段上没有发现绿色杂交信号。参照Tang等[19]的标准图谱, 符合这一荧光杂交信号特征的小麦染色体有5A、2B、4B、6B、2D、3D和4D, 而小麦染色体2D、3D和4D端部或近端部除了有Oligo-pSc119.2-2杂交信号同时还应具有Oligo-pAs1-2荧光信号。该易位染色体小麦片段上只有Oligo-pSc119.2-2的杂交信号, 因此可排除2D、3D和4D染色体(图1-B)。结合C-分带结果, 2B、4B和6B染色体短臂的端部和近端部都有较强的C带, 而易位染色体小麦片段上只有较弱的C带(图2), 故可排除2B、4B和6B染色体, 发生易位的应为5A染色体, 且为5A短臂的端部片段。

图2 易位染色体T5AS-7LrL·7LrS的C-分带及荧光原位杂交
从左至右依次为C-分带的5A、C-分带的T5AS-7LrL·7LrS、荧光原位杂交的T5AS-7LrL·7LrS、Oligo-pSc119.2-2 (红色)杂交的T5AS-7LrL·7LrS、Oligo-pSc119.2-2 (绿色)杂交的5A、荧光原位杂交的7Lr和C分带的7Lr。
Chromosomes from left to right are C-banded 5A, C-banded T5AS-7LrL·7LrS, FISH T5AS-7LrL·7LrS, T5AS-7LrL·7LrS with red Oligo-pSc119.2-2, 5A with green Oligo-pSc119.2-2, FISH 7Lr, and C-banded 7Lr.
C-分带荧光原位杂交对比发现, 大赖草7LrL顶端有很强的荧光原位杂交信号, 易位的大赖草7Lr染色体片段包含了整个7LrS短臂和一部分7LrL长臂, 荧光原位杂交结果该易位染色体与7Lr相符(图2)。对其花粉母细胞减数分裂中期I染色体配对行为观察, 发现其易位染色体正常配对, 形成稳定的环状二价体(图3)。综上所述, 将该易位系命名为T5AS-7LrL·7LrS。
2.2 易位系T5AS-7LrL·7LrS的分子标记鉴定
利用位于小麦第7部分同源群不同区段的81对EST-STS引物进行多态性分析, 发现BE591127、BQ168298和BE591737在大赖草、DA7Lr和易位系T5AS-7LrL·7LrS上有特异扩增。这3个标记分别定位在7AS、7BS和7DS上, 可用于追踪大赖草染色体片段, 特异扩增条带大小分别为1000、1733和398 bp (图4)。
2.3 易位系T5AS-7LrL·7LrS的赤霉病抗性鉴定
经过连续3年的赤霉病接种鉴定结果表明, 易位系T5AS-7LrL·7LrS的病小穗率显著低于感病亲本中国春和感病对照绵阳8545, 但稍高于抗病对照苏麦3号(表1和图5), 表现出较好的赤霉病抗性。
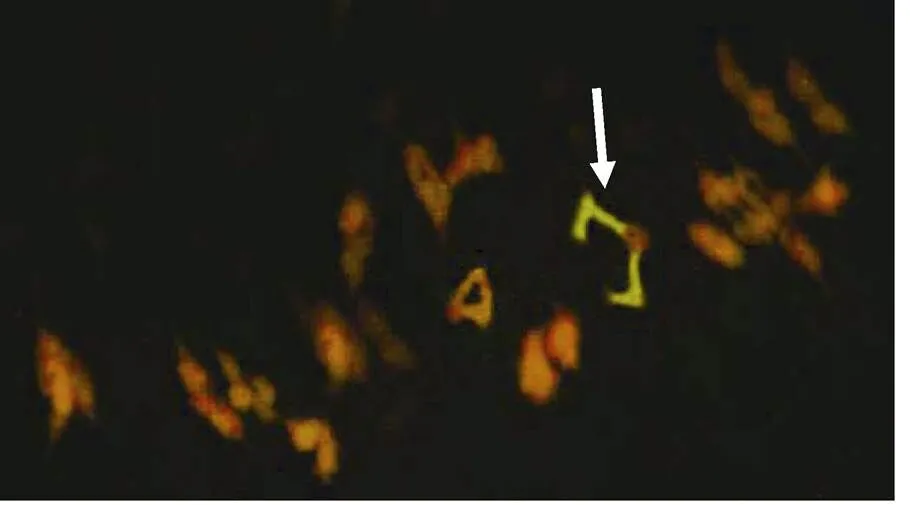
图3 易位系T5AS-7LrL·7LrS花粉母细胞减数分裂中期I染色体的荧光原位杂交
图中绿色信号为荧光素Fluorescein-l2-dUTP标记的大赖草基因组DNA, 箭头指示配对的二价体易位染色体T5AS-7LrL·7LrS。
genomic DNA was labeled with Fluorescein-l2-dUTPand visualized with green signals. The arrow shows the ring bivalent formed by a pair of translocation chromosomes T5AS-7LrL·7LrS.
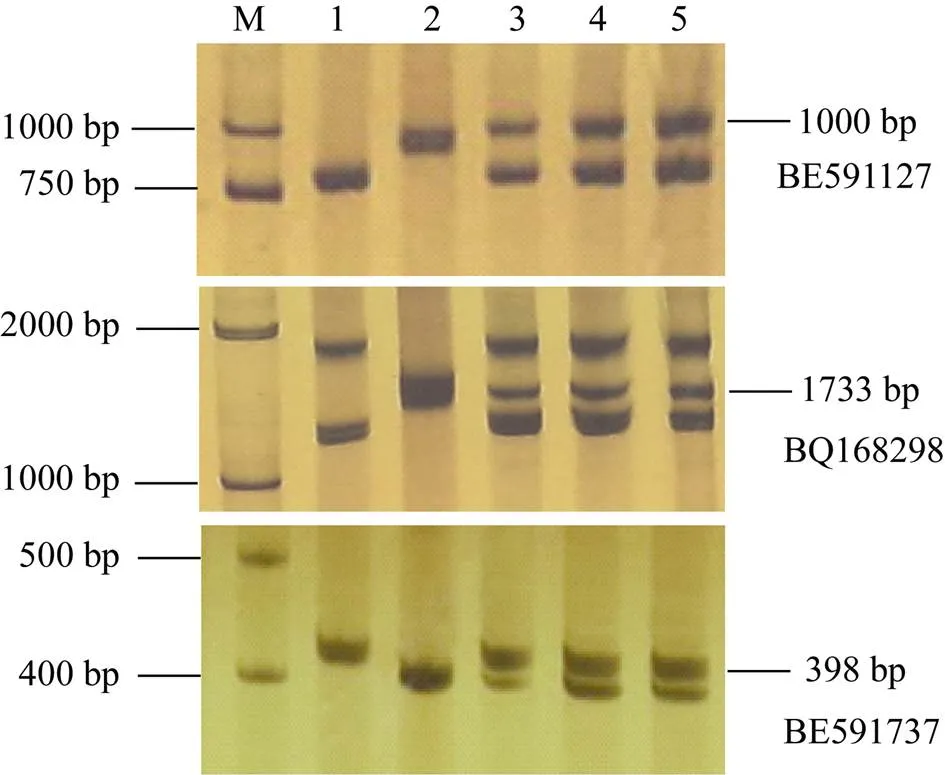
图4 引物BE591127、BQ168298和BE591737的PCR扩增结果
1: 中国春; 2: 大赖草; 3: DA7Lr; 4: T5AS-7LrL·7LrS。
1: Chinese Spring; 2:(Lr); 3: DA7Lr; 4: T5AS-7LrL·7LrS.

表1 不同材料赤霉病抗性(病小穗率)的田间鉴定
**表示与中国春在0.01概率水平上有显著差异。
**indicate significant difference at< 0.01 compared with Chinese Spring.

图5 易位系T5AS-7LrL·7LrS的赤霉病抗性鉴定
A: T5AS-7LrL·7LrS; B: 中国春; C: 绵阳85-45; D: 苏麦3号。
A: T5AS-7LrL·7LrS; B: Chinese Spring; C: Mianyang 85-45; D: Sumai 3.
3 讨论
通过电离辐射将外源遗传物质导入普通小麦已成为拓宽小麦育种遗传基础的有效途径。自从1956年Sears[22]获得小麦–小伞山羊草易位系以来, 采用电离辐射创造了许多具有外源有益基因的小麦新种质[23-28], 为小麦育种开拓了新视野。但由于电离辐射造成染色体断裂重接完全是随机的, 产生的易位染色体补偿性往往较差, 直接利用还存在一定困难, 因此, 创造携带外源有益基因的补偿性易位, 尤其是中间插入小片段易位, 已成为研究者追求的目标。
Chen等[29]通过电离辐射选育的小麦一簇毛麦T6AL/6VS补偿性易位系, 目前已经成为我国小麦抗白粉病育种的重要亲本, 以此易位系为亲本, 已选育出20 余个小麦新品种并在生产上大面积推广[30]。本研究利用C-分带结合顺序GISH–FISH, 从普通小麦–大赖草7Lr二体异附加系辐射后代中选育出的易位系T5AS-7LrL·7LrS, 属于非补偿性易位, 且易位染色体具有较长的大赖草染色体片段, 超过整条染色体的80%, 携带大赖草许多冗余基因, 对小麦的农艺性状造成一定的负面效应, 主要表现为植株偏高、晚熟、穗部顶端有秃尖、千粒重低、结实性差等问题。但该易位系经鉴定对赤霉病有较高的抗性, 3年的病小穗率分别为8.70%、11.22%和9.67%, 显著低于感病品种中国春和绵阳85-45, 表明其具有抗赤霉病的主效基因, 可以作为抗赤霉病的新资源。本课题组正在以该易位系为材料, 采用辐射、杀配子染色体诱导等手段创造小片段易位系, 同时与当前黄淮海主推骨干品种回交, 以期选育出农艺性状优良, 在生产上可利用的抗赤霉病小麦新品系。
本研究分析了易位染色体5AS-7LrL·7LrS的配子传递特性, 发现该易位染色体具有花粉的优先传递性, 但对其易位系所产生的花粉育性观察发现, 没有大量的不育花粉, 育性基本正常, 表明该易位染色体具有与杀配子染色体不同的花粉优先传递基因。
Subbarao等[29]研究发现大赖草第7部分同源群染色体上携有生物硝化抑制基因, 将其导入栽培小麦, 可延缓铵态氮(NH4+-N)向硝态氮(NO3-)的转化,减少土壤中氮的损失, 改善作物氮素营养, 提高氮素利用率。同时也减少地表水和地下水的污染。本研究创造的易位系T5AS-7LrL·7LrS, 是大赖草第7部分同源群染色体与普通小麦染色体发生的易位, 因此, 在易位系获得抗赤霉病的同时有可能又具有生物硝化抑制特性, 成为有双重利用价值的种质资源, 在小麦生产中发挥更大的作用。
4 结论
采用电离辐射的方法创造普通小麦大赖草易位系, 利用C-分带、GISH–FISH双色荧光原位杂交技术鉴定出易位系T5AS-7LrL·7LrS, 并筛选出3个在易位系T5AS-7LrL·7LrS上有特异扩增的EST-STS多态性标记, 可用于追踪大赖草染色体片段。
[1] McGuire P E, Dvorak J. High salt-tolerance potential in wheatgrasses., 1981, 21: 702–705
[2] Mujeeb-Kazi A, Bekele G T, Mirand J L. Incorporation of alien genetic information frominto. In: Proc the 6th Int Wheat Genet Symp, Kyoto, Japan, 1983. pp 223–231
[3] Mujeeb-Kazi A, Rodriguez R. An intergeneric hybrid ofL. ×., 1981, 72: 253–256
[4] 陈佩度, 王兆悌, 王苏玲, 黄俐, 王裕中, 刘大钧. 将大赖草种质转移给普通小麦的研究: III. 抗赤霉病异附加系选育. 遗传学报, 1995, 22: 206–210 Chen P D, Wang Z T, Wang S L, Huang L, Wang Y Z, Liu D J. Transfer of useful germplasm fromLam. to common wheat: III. Development of addition lines with wheat scab resistance., 1995, 22: 206–210 (in Chinese with English abstract)
[5] Qi L L, Wang S L, Chen P D. Molecular cytogenetic analysis ofchromosomes added to wheat., 1997, 95: 1084–1091
[6] 刘文轩, 陈佩度, 刘大钧. 利用减数分裂期成株电离辐射选育小麦–大赖草易位系的研究. 植物学报, 1999, 41: 463–467 Liu W X, Chen P D, Liu D J. Development of–translocation lines by irradiating adult plants at meiosis., 1999, 41: 463–467 (in Chinese with English abstract)
[7] 刘文轩, 陈佩度, 刘大钧. 利用花粉辐射诱发普通小麦与大赖草染色体易位的研究. 遗传学报, 2000, 27: 44–49 Liu W X, Chen P D, Liu D J. Studies of the development of–translocation lines by pollen irradiation., 2000, 27: 44–49 (in Chinese with English abstract)
[8] 刘文轩, 陈佩度, 刘大钧. 一个普通小麦–大赖草易位系T01的选育与鉴定. 作物学报, 2000, 26: 305–309 Liu W X, Chen P D, Liu D J. Selection, breeding and identification of T01: a–translocation line., 2000, 26: 305–309 (in Chinese with English abstract)
[9] 杨宝军, 窦全文, 刘文轩, 周波, 陈佩度. 普通小麦–大赖草易位系NAU601和NAU618的选育及双端二体测交分析. 遗传学报, 2002, 29: 350–354 Yang B J, Dou Q W, Liu W X, Zhou B, Chen P D. Development of–translocation lines NAU601 and NAU618 and their test-cross analysis with double ditelosomic., 2002, 29: 350–354 (in Chinese with English abstract)
[10] Yuan J H, Chen P D, Liu D J. Development of–translocation lines using gametocidal chromosomes.:, 2003, 46: 522–530
[11] Wang L S, Chen P D, Wang X E. Molecular cytogenetic analysis of–reciprocal chromosomal translocation T7DS·5LrL/T5LrS·7DL., 2010, 55: 1026–1031
[12] 崔承齐, 王林生, 陈佩度. 普通小麦–大赖草易位系T7BS·7Lr#1S和T2AS·2AL-7Lr#1S的分子细胞遗传学鉴定. 作物学报, 2013, 39: 191–197 Cui C Q, Wang L S, Chen P D. Molecular and cytogenetic identification of–translocation lines T7BS·7Lr#1S and T2AS·2AL-7Lr#1S.,2013, 39: 191–197 (in Chinese with English abstract)
[13] Wang L S, Chen P D. Development of–sub.7Lr#1S(7A) with resistance to wheat scab and their analysis with meiosis., 2008, 53: 3522–3529
[14] Qi L L, Pumphrey M O, Friebe B, Gill B S. Molecular cytogenetic characterization of alien introgressions with genefor resistance tohead blight disease of wheat., 2008, 117: 1155–1166 (in Chinese with English abstract)
[15] Gill B S, Friebe B. Standard karyotype and system for description of chromosome bands and structural aberrations in wheat ()., 1991, 34: 830–839
[16] Mukai Y, Nakahara Y, Yamamoto M. Simultaneous discrimination of the three genomes in hexaploid wheat by multicolor fluorescencehybridization using total genomic and highly repeated DNA probes., 1993, 36: 489–494
[17] Zhang P, Li W L, Friebe B, Gill B S. Simultaneous painting of three genomes in hexaploid wheat by BACK-FISH., 2004, 47: 979–878
[18] Pedersen C, Linde-Laursen I. Chromosomal locations of four minor rDNA loci and a marker microsatellite sequence in barley., 1994, 2: 65–71
[19] Tang Z X, Yang Z J, Fu S L. Oligonucleotides replacing the roles of repetitive sequences pAs1, pSc119.2, pTa-535, pTa71, CCS1, and pAWRC.1 for FISH analysis., 2014, 55: 313–318
[20] Sharp P J, Cao S, Desai S,Gale M D.The isolation characterization and application in the Triticae of a set of wheat RFLP probes identifying each homoeologous chromosome arm., 1989, 78: 342–348
[21] 王裕中, 杨新宁, 尚庆璞. 小麦赤霉病抗性鉴定技术的改进及其抗源的开拓. 中国农业科学, 1982, 23(5): 66–67 Wang Y Z, Yang X N, Shang Q P. The improvement of identification technique of scab (Petch.) resistance of wheat and the development of resistant sources., 1982, 23(5): 66–67 (in Chinese with English abstract)
[22] Sears E R. The transfer of leaf rust resistance fromto wheat., 1956, 9: 1–22
[23] Sharma D, Knott D R. The transfer of leaf-rust resistance fromtoby irradiation.,1966, 8: 137–143
[24] Sears E, Gustafson J. Use of radiation to transfer alien chromosome segments to wheat., 1993, 33: 897–901
[25] Friebe B, Jiang J M, Raupp W J, McIntosh R A, GillB S. Characterization of wheat-alien translocations conferring resistance to diseases and pets: current status., 1996, 91: 59–87
[26] Luan Y, Wang X, Liu W, Li C, Zhang J, Gao A, Wang Y, Yang X ,Li L. Production and identification of wheat–6P translocation lines., 2010, 232: 501–510
[27] Zhang J, Liu W, Wu X, Yang X, Li X, Lu Y, Li L. An intercalary translocation from6P chromosome into common wheat confers enhanced kernel number per spike., 2016, 244: 853–864
[28] Song L, Lu Y, Zhang J, Pan C, Yang X, Li X, Liu W, Li L. Physical mapping ofchromosome 6P using deletion lines in common wheat background., 2016, 129: 1023–1034
[29] Chen P D, Qi L L, Zhou B, Zhang S Z, Liu D J. Development and molecular cytogenetic analysis of wheat–6VS/6A: I. Translocation lines specifying resistance to powdery mildew., 1995, 91: 1125–1128
[30] 李桂萍, 陈佩度, 张守忠, 赵和. 小麦–簇毛麦6VS/6AL易位染色体对小麦农艺性状的影响. 植物遗传资源报, 2011, 12: 744–749 Li G P, Chen P D, Zhang S Z, Zhao H. Effects of the 6VS/6AL translocation chromosome on agronomic characteristics of wheat., 2011, 12: 744–749 (in Chinese with English abstract)
[31] Subbarao G V, Ban T, Masahiro K, Osamu I, Samejima H, Wang H Y, Pearse S J, Gopalakrishnan S, Nakahara K, Zakir Hossain A K M, Tsujimoto H, Berry W L. Can biological nitrification inhibition (BNI) genes from perennial(Triticeae) combat nitrification in wheat farming?, 2007, 299: 55–64
[32] Subbarao G V, Sahrawat K L, Nakahara K, Rao I M, Ishitani M, Hash C T, Kishii M, Bonnett D G, Berry W L, Lata J C. A paradigm shift towards low-nitrifying production systems: the role of biological nitrification inhibition (BNI)., 2013, 112: 297–316
Molecular and Cytogenetic Identification of–Translocation Line T5AS-7LrL·7LrS
WANG Lin-Sheng*, ZHANG Ya-Li, and NAN Guang-Hui
Key Laboratory of Crop Genetic Improvement and Germplasm Innovation / College of Agriculture, Henan University of Science and Technology, Luoyang 471023, Henan, China
is highly resistant to wheat scab. The transfer of resistance genes fromto common wheat () is important for broadening the resistant sources against scab in common wheat. In this study, the pollen of DA7Lr, a–disomic addition line with scab resistance, was irradiated with60Co-γ ray at 1200 Rad (100 Rad min−1) before pollinating to emasculatedcv. Chinese Spring. One plant with one translocation chromosome was detected in the M1generation by GISH. This plant was then self-pollinated and the pollen mother cells (PMCs) of the offspring plants with two translocation chromosomes were cytologically observed, and one ring bivalent was found at meiotic metaphase I, indicating that the plant with two translocation chromosomes was one translocation homozygote. The translocation line was proved to be T5AS-7LrL·7LrS by C-banding, and sequential GISH–FISH using Oligo-pAs1-2 and Oligo-pSc119.2-2 as probes. Three EST-STS markers (BE591127, BQ168298, and BE591737)were identified to be able to track theT5AS-7LrL·7LrSline. The translocation line also serves as an resistant source against wheat scab in wheat breeding programs.
–translocation line; molecular cytogenetics; scab resistance;60Co-γ ray
2018-03-07;
2018-06-12;
2018-07-17.
10.3724/SP.J.1006.2018.01442
王林生, E-mail: 964965931@qq.com
本研究由国家自然科学基金项目(31501301), 河南省国际合作项目(172102410052)和河南省教育厅自然科学研究项目(2011A180011)资助。
This study was supported by the National Natural Science Foundation of China (31501301), the International Cooperation Program of Henan Province (172102410052), and the Natural Science Research Program of Henan Education Department (2011A180011).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180717.1355.002.html
