Bacillus sp.C62的砷氧化功能及亚砷酸盐氧化酶活力测定
2018-10-10彭兆丰陈晓明侯新东
杨 成,彭兆丰,陈晓明,侯新东
(中国地质大学(武汉)环境学院,湖北 武汉 430074)
砷(As)是普遍存在的污染物,来源于天然[1]和不断增加的人为活动[2]。据报道,砷污染已成为严重威胁人类健康的问题,越来越多的人深受其害[3]。砷污染除了影响人体的健康外,土壤中砷的累积还会导致作物产量的下降[4]。因此,砷污染的防治已成为当前环境问题的重要议题。目前,砷污染的修复主要有物理化学方法和生物方法。在生物方法中,微生物是砷转化和运输的关键驱动力[5-7],其生物转化包括三价砷[As(III)]氧化、五价砷[As(V)]还原以及三价砷甲基化[5]。
由于As(III)的毒性比As(V)更高[5,8],由砷氧化细菌介导的As(III)到As(V)的氧化作用可以降低砷的毒性[5],因此微生物的砷氧化研究对砷污染的自然修复意义重大。微生物的砷氧化作用是由亚砷酸盐氧化酶催化的,亚砷酸盐氧化酶属于二甲基亚砜还原酶家族,它由两个异源亚基组成,一个是含有3Fe-4S簇的大亚基,另一个是含有2Fe-2S簇的小亚基[9]。与As(III)的化学氧化作用相比,其生物氧化作用更高效、经济[10]。亚砷酸盐氧化酶催化亚砷酸盐氧化成砷酸盐,氧气作为电子受体被还原[10-11],其化学反应式如下:

(1)
本研究从位于湖南省石门县雄黄矿区的高砷土壤中筛选出耐砷菌株C62,该菌株能有效地催化As(III)到As(V)的氧化反应,降低环境中砷的毒性。本次试验中,首先对菌株C62进行了初步的分类鉴定;然后通过分析化学和分子生物学手段验证了菌株C62的砷氧化功能;最后从培养的细胞中提取了亚砷酸盐氧化酶,对酶活力的测定条件进行了优化[11-16],并测定了菌株C62粗酶的活力,以为后续的分离纯化、酶学性质表征以及实际应用奠定基础。
1 材料与方法
1. 1 试验材料
1.1.1 菌株
本试验所用的耐砷菌株C62,由中国地质大学(武汉)分子细胞与地质微生物实验室筛选并提供。
1.1.2 主要试剂和仪器
主要试剂:2-N-吗啡啉乙磺酸(MES)、苯基甲磺酰氟(PMSF)、吩嗪硫酸甲酯(PMS)、2,6-二氯酚靛酚钠 (DCIP),购自南京奥多福尼生物科技有限公司,均为sigma品牌;细菌生化鉴定试剂盒购自北京路桥技术股份有限公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;PCR相关试剂为TaKaRa系列;其他试剂为国产分析纯。
主要仪器:恒温培养箱(上海博迅实业有限公司);高压蒸汽灭菌锅(上海三申医疗器械有限公司);UV-3200PC分光光度计(上海美谱达仪器有限公司);AFS-9600原子荧光分光光度计(北京科创海光仪器有限公司)。
1. 2 菌株C62的筛选和分类鉴定
1.2.1 菌株C62的筛选和生理生化特征鉴定
菌株C62的筛选参考Lieutaud等[15]的方法,在CDM(Chemically Defined Medium)培养基[17]中添加5 mmol/L的As(III)。菌株C62的生理生化特征鉴定参照《常见细菌系统鉴定手册》[18],接触酶和甲基红试验等采用实验室试剂完成,葡萄糖发酵和硝酸盐还原试验等采用细菌生化鉴定试剂盒完成。
1.2.2 菌株C62的16S rRNA基因序列同源性分析
采用细菌基因组DNA提取试剂盒提取菌株C62的基因组DNA,作为16S rRNA基因序列扩增的模板;扩增引物采用通用引物[19],正向引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物为1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR反应程序为:首先94℃预变性5 min;然后94℃变性30 s,55℃退火30 s,72℃延伸1.5 min,30次循环;最后72℃延伸10 min。PCR扩增产物纯化后,送武汉擎科创新生物科技有限公司测序。其测序结果利用Blast程序与NCBI数据库中的已知序列进行比对分析。选取相关菌种的同源序列,利用软件MEGA7构建菌株C62的系统发育树。
1. 3 菌株C62的砷氧化功能
1.3.1 菌株C62的生长曲线测定
首先取出保存的菌种C62,在固体CDM培养基[17]上划线进行活化;然后挑取单菌落接种于液体CDM培养基中;最后按1%的接种量接种于含5 mmol/L As(III)的CDM培养基中,于30℃恒温培养箱中培养,转速为150 r/min。菌株C62的生长曲线绘制采用比浊法:从0 h开始,每隔4 h取一次样,一直取到56 h,测量600 nm处的OD600(Optical Density)值,并以培养时间为横坐标、OD600值为纵坐标绘制菌株C62的生长曲线。
1.3.2 菌株C62的砷氧化曲线测定
砷形态分析采用原子荧光光谱法[20]。首先菌株C62在含5 mmol/L As(III)的CDM培养基中培养,从0 h开始,每隔4 h取一次样,一直取到56 h,将不同时间所取样品稀释5 000倍后,分成两份,一份测总砷含量,一份过supelclean LAC-SAX SPE柱测As(III)含量;然后测出总砷和As(III)的含量,由两者之差计算出As(V)的含量;最后以时间为横坐标、砷含量为纵坐标绘制菌株C62的砷氧化曲线。以不接种微生物的灭菌培养基作为试验的对照组。
1.3.3 菌株C62亚砷酸盐氧化酶大亚基(aoxB)基因序列的测定及同源性分析
以菌株C62的基因组DNA作为亚砷酸盐氧化酶大亚基(aoxB)基因序列扩增的模板;扩增引物参考Quéméneur等[21],正向引物为aoxBM1-2F:5′-CCACTTCTGCATCGTGGGNTGYGGNTA-3′;反向引物为aoxBM3-2R:5′-TGTCGTTGCCCCAGATGADNCCYTTYTC-3′。PCR反应程序为:首先94℃预变性5 min;然后94℃变性45s,52℃退火30 s,72℃延伸1.2 min,35次循环;最后72℃延伸10 min。PCR扩增产物纯化后,连接到载体pClone007-T上,并转化大肠杆菌DH5α,挑选单菌落培养,阳性鉴定后送武汉擎科创新生物科技有限公司测序。其测序结果利用BlastX程序与NCBI数据库中的已知序列进行比对分析。选取相关菌种的同源蛋白序列,利用软件MEGA7构建菌株C62的系统发育树。
1.4 菌株C62亚砷酸盐氧化酶(Aro)的提取
菌株C62亚砷酸盐氧化酶(Aro)的提取参考Anderson等[13]的方法。首先当培养基在600 nm处的OD600值达到0.6时,停止培养,4℃下以5 000×g离心30 min收集菌体,沉淀用缓冲液A (20 mmol/L Tris-HCl、0.1 mmol/L PMSF、0.6 mmol/L EDTA、0.9% NaCl,pH=8.4) 洗3次;然后按每克湿菌加5 mL提取液(50 mmol/L Tris-HCl、1 mmol/L PMSF、0.6 mmol/L EDTA,pH=8.4)进行悬浮,并按1 mg/mL的量添加溶菌酶于室温下孵育30 min;最后添加Mg(CH3COO)2和MgSO4至终浓度分别为20 mmol/L和100 mmol/L以及适量DNase和RNase,并超声破碎处理15 min,超声功率为120 W,超声5 s、停止5 s,4℃下以20 000×g离心30 min,上清液即为菌株C62的粗酶液。
1.5 菌株C62亚砷酸盐氧化酶(Aro)活力的测定及活性染色
菌株C62亚砷酸盐氧化酶(Aro)活力的测定参考DCIP法[13],采用MES缓冲体系。以2,6-二氯酚靛酚钠(DCIP)作为电子受体,As(III)作为电子供体,PMS作为Aro和DCIP之间传递电子的载体;反应体系含有50 mmol/L MES、100 μmol/L DCIP、30 μmol/L PMS、2 mmol/L As(III),pH值为6.0,检测波长为600 nm;菌株C62粗酶活力的测定从加入As(III) 时开始,每隔30 s记录一次分光光度计的读数,总共监测时间为2 min。以不添加As(III)的测量作为试验的对照组。Aro的活力定义为:25℃时,每分钟还原1 μmol DCIP为一个酶活力单位。Aro的比活力定义为:每毫克蛋白每分钟还原DCIP的量,单位为μmol reduced DCIP/(min·mg),简写为μmol DCIP/(min·mg)。蛋白质的定量采用Bradford法[22],以牛血清蛋白作为标准蛋白。为了减小测量误差,所有数据测量3次。
Aro的活性还可以用活性染色的方法来检测;活性染色采用Native-PAGE凝胶[15],在冰浴条件下进行电泳。活性染色步骤如下:首先将凝胶在50 mmol/L MES缓冲液(pH=6.0)中活化15 min,并在含500 μmol/L DCIP的MES缓冲液中避光染色1 h(4℃);然后用MES缓冲液短暂漂洗凝胶;最后用含2 mmol/L As(III)和30 μmol/L PMS的MES缓冲液浸润几分钟,直到白色条带开始出现在蓝色背景上[14-15]。
2 结果与讨论
2. 1 菌株C62的分类鉴定
2.1.1 菌株C62的生理生化特征
本研究采用新鲜菌株C62进行生理生化特征试验,其试验结果见表1。

表1 菌株C62的生理生化特征试验结果
注:“+”表示阳性反应;“-”表示阴性反应。
由表1可知,菌株C62的接触酶试验和甲基红试验呈阳性,V-P测定呈阴性,菌株C62可以利用D-葡萄糖和D-甘露醇产酸,可以水解明胶和淀粉,也可以利用硝酸盐和柠檬酸盐,但在有溶菌酶的条件下不能生长。
2.1.2 菌株C62的16S rRNA基因序列同源性分析
菌株C62的16S rRNA基因序列的扩增产物约为1 500 bp(见图1),测序后先将序列(1 442 bp)提交到GenBank (accession No.MF537214),然后利用Blast程序与NCBI数据库中的已知序列进行比对分析,再利用软件MEGA7,采用Neighbour-Joining法(Bootstrap值设为1 000)构建菌株C62的系统发育树,见图2。
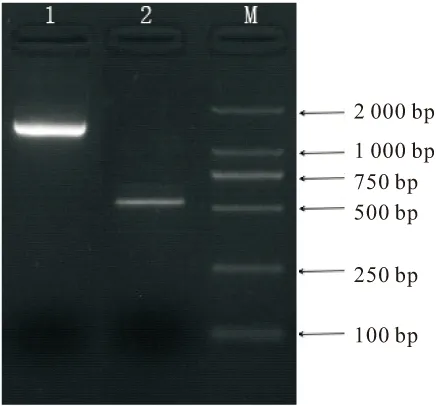
图1 菌株C62相关基因的PCR扩增Fig.1 PCR amplification of 16S rRNA gene and aoxB gene of strain C62 1-16S rRNA基因;2-aoxB基因;M-DNA marker
由图2可见,菌株C62与Bacillusoceanisediminisstrain H2(GQ292772)处于进化树的同一分支上,同源性达到99%,结合其生理生化特征,初步确定菌株C62属于芽孢杆菌属,命名为Bacillussp.C62。

图2 基于16S rRNA 基因序列构建的菌株C62系统发育树Fig.2 Phylogenetic tree of strain C62 based on 16S rRNA gene sequences
2. 2 Bacillus sp. C62的砷氧化功能
2.2.1Bacillussp.C62的生长曲线和砷氧化曲线
Bacillussp.C62的生长曲线和砷氧化曲线见图3。

图3 Bacillus sp.C62 的生长曲线和砷氧化曲线Fig.3 Growth curve and arsenite oxidation curves of Bacillus.sp.C62
由图3可见,Bacillussp.C62在30 °C下培养时,经过8 h的延滞期后进入对数生长期,在培养30 h左右生物量达到最大值,之后进入平衡期和衰亡期[见图3 (a)];原子荧光光谱的测量结果显示,Bacillussp.C62在含有0.04%酵母提取物的CDM培养基中培养28 h后,可将初始浓度为5 mmol/L的As(III)几乎完全氧化为As(V),而灭菌对照组中的As(III)含量则没有明显的变化[见图3 (b)]。
2.2.2Bacillussp.C62aoxB基因的序列分析及系统发育树构建
aoxB基因编码亚砷酸盐氧化酶的大亚基,是一个有意义的分子标记,用于研究砷氧化细菌在环境中的砷氧化潜力[21]。以提取的Bacillussp.C62基因组DNA为模板,aoxBM1-2F和aoxBM3-2R为引物进行PCR扩增,在大约500 bp处有一条明亮的主带(见图1),测序后先将序列提交到GenBank (accession No.MG545913),再通过BlastX检索分析,从数据库中选取相关蛋白序列,运用软件 MEGA7,采用Neighbour-Joining法(BootStrap值设为1 000)构建Bacillussp.C62的系统发育树,见图4。Bacillussp.C62aoxB基因序列的长度只有

图4 基于亚砷酸盐氧化酶基因序列构建的Bacillus sp.C62的系统发育树Fig.4 Phylogenetic tree of Bacillus sp.C62 based on protein sequence deduced from arsenite oxidase gene
Quéméneur等[21]所报道的一半,与其他菌株亚砷酸盐氧化酶的同源性最高为36%,这可能是因为Bacillussp.C62亚砷酸盐氧化酶的基因比较特殊,也可能是因为aoxB基因在不同的门中保守性不一致[21],Bacillussp.C62属于厚壁菌门,而其他菌株大多属于变形菌门,详细的分子机制还需要进一步研究。
2.2.3Bacillussp.C62亚砷酸盐氧化酶(Aro)的活性染色
Bacillussp. C62菌体总蛋白(每个胶孔约50 μg)组分的Native-PAGE凝胶电泳和活性染色结果见图5。

图5 Bacillus sp.C62菌体总蛋白组分的Native-PAGE凝胶电泳和活性染色Fig.5 Native-PAGE and activity staining of total protein fractions of Bacillus sp.C61、2-培养基中不含As(III);3、4-培养基中含有5 mmol/L As(III)
由图5可见,当Bacillussp.C62在不含As(III)的条件下培养时,没有表现出亚砷酸盐氧化酶活性(胶孔1、2),而当Bacillussp.C62在含As(III)的条件下培养时,就会表现出亚砷酸盐氧化酶活性(胶孔3、4),说明Bacillussp.C62亚砷酸盐氧化酶基因的表达需要As(III)的诱导。这个结果与Alcaligenesfaecalis[11]和Ralstoniasp.22[12]的类似。然而,研究报道中还有一些菌种可以不需要As(III)的诱导也能表达亚砷酸盐氧化酶活性,但是与在有As(III)条件下生长的细胞相比,其氧化活力较低[15,23]。
2.3 Bacillus sp.C62亚砷酸盐氧化酶(Aro)活力的测定
2.3.1 亚砷酸盐氧化酶活力测定条件的优化
由于菌种来源不同,Aro活力的测定条件也有所差异[11-16],因此本试验优化了一系列的试验参数,以满足Aro活力测定的准确度和精确度要求。
本试验使用UV-3200PC分光光度计扫描DCIP的吸收光谱(400~800 nm),得到不同pH值和缓冲容量下DCIP的紫外吸收光谱,见图6。
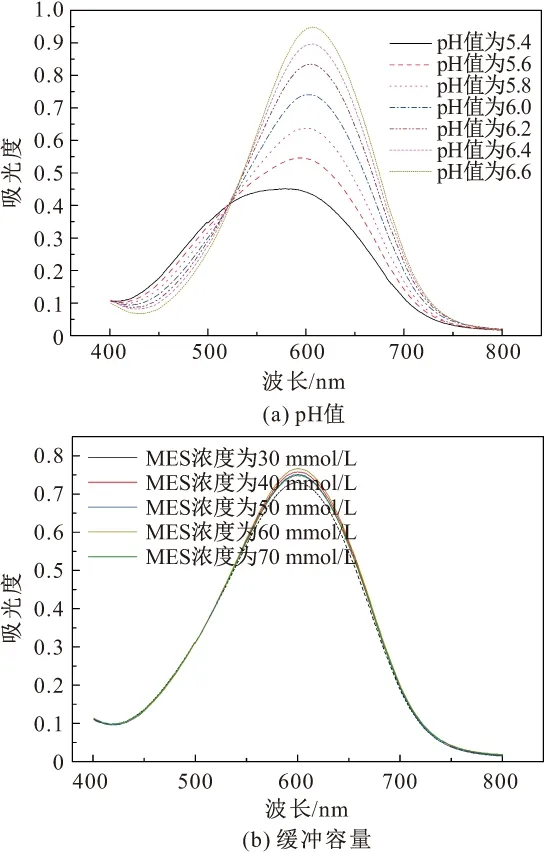
图6 不同pH值和缓冲容量下DCIP的紫外吸收光谱Fig.6 UV absorption spectra of DCIP at different pH and different concentrations of MES
由图6可见,DCIP (100 μmol/L)的最大吸收峰在600 nm处[见图6 (a)、(b)];MES缓冲液的pH值会显著影响DCIP的吸光度[见图6 (a),MES浓度为50 mmol/L];而在给定的pH值下,MES缓冲液的缓冲容量(MES浓度为30~70 mmol/L) 对DCIP的吸光度几乎没有影响[见图6 (b),MES缓冲液的pH值为6.0]。
pH值对于Aro活力的测定是一个敏感的因素,它不但影响DCIP的吸光度,还会影响Aro的活力。pH值和缓冲容量对Aro活力的影响见图7。
由图7可见,在MES缓冲液的缓冲容量范围内(pH值为5.4~6.6),当pH值为5.8~6.0 时,Aro的活力达到最大值[见图7 (a),MES浓度为50 mmol/L],考虑到DCIP在pH值为6.0时的吸收峰更窄[见图6(a)],灵敏度更高,最适合的pH值最终设定为6.0。此结果与先前的部分报道是一致的[13-16]。MES缓冲液的缓冲容量虽然不会影响DCIP的吸光度,但是仍会影响Aro的活力[见图7(b)],MES缓冲液的最佳浓度为50 mmol/L(pH值为6.0)。

图7 pH值和缓冲容量对Aro活力的影响Fig.7 Effects of pH and concentration of MES on the activity of Aro
DCIP摩尔吸光系数的测定以及DCIP浓度、温度和As(III)浓度对Aro活力的影响见图8。

图8 DCIP摩尔吸光系数的测定以及DCIP浓度、温度和As(III)浓度对Aro 活力的影响Fig.8 Determination of the molar absorbance coefficient of DCIP and effects of DCIP concentration, and As(III) temperature on the activity of Aro
由图8可见,DCIP在600 nm处的吸光度与DCIP的浓度存在线性关系[R2= 0.991 1,见图8(a)],其线性方程的斜率即为DCIP的摩尔吸光系数[6 503.5 L/(mol·cm)];同时DCIP的浓度也会影响Aro的活力,在本试验中,当DCIP的浓度为100 μmol/L时,Aro的活力开始接近最大值[见图8(b)];Bacillussp.C62酶活力测定的最适温度为30℃,而在25℃时其活力已可达最大值的80%[见图8(c)],这表明可以在没有温度控制器的室温条件下检测Aro活力;As(III)是反应的底物,当其浓度达到2 mmol/L时,粗酶活力趋近于最大值[见图8(d)]。
连续监测法测定的是酶促反应的初速率,随着反应的进行,反应速率会逐渐降低,本试验采用的监测时间为2 min。在Aro和DCIP之间作为电子载体的PMS,在PMS浓度较低(10~30 μmol/L)时只是起到电子传递的作用,不会增强反应[13];但当PMS浓度超过80 μmol/L 时,会对Aro的活力测定造成严重的干扰(数据未显示)。因此,本试验中所使用的PMS浓度为30 μmol/L。
综上所述,对于Bacillussp.C62,优化后的Aro活力测定条件如下:反应在室温下进行,反应体系中含有50 mmol/L MES、100 μmol/L DCIP、2 mmol/L As(III)和30 μmol/L PMS。
2.3.2 亚砷酸盐氧化酶(Aro)活力测定条件和粗酶活力的比较
不同菌种亚砷酸盐氧化酶(Aro)活力的测定条件和粗酶活力(V)的比较见表2。

表2 不同菌种亚砷酸盐氧化酶(Aro)活力测定条件和粗酶活力的比较
注:MES、As(III)的浓度单位为mmol/L;DCIP、PMS的浓度单位为μmol/L;pH值无单位;粗酶活力V的单位为μmol DCIP/(min·mg)
由表2可见,Aro活力的测定条件因菌种而各异,不同菌种的Aro在反应中对底物As(III)表现出不同的亲和力;采用优化后的条件,测得Bacillussp.C62粗酶的活力为0.015 μmol DCIP/(min·mg),与其他几种Aro的活力接近,但显著低于HydrogenophagaNT-14和Polaromonassp.str.GM1,而GM1是已报道的砷氧化细菌中Aro活力最强的。
3 结 论
根据菌株C62的生理生化特征和16S rRNA序列基因分析,初步确定其为一株芽孢杆菌,命名为Bacillussp.C62;砷形态分析和aoxB基因的分子检测表明,Bacillussp.C62具有砷氧化功能,是一株砷氧化细菌,可在28 h内将培养基中的5 mmol/L As(III)几乎全部氧化成As(V)。采用优化后的测定条件,测得Bacillussp.C62的粗酶活力为0.015 μmol DCIP/(min·mg),可为后续的分离纯化、酶学性质表征以及微生物对砷污染环境的修复奠定理论基础。
