超高效液相色谱-串联质谱法检测鸡肉中6种大环内酯类药物残留量
2018-10-09罗燕
罗 燕
(深圳市农产品质量安全检验检测中心,广东 深圳 518005)
大环内酯类(MALs)属中谱抗生素,是一类具有12~22个碳内酯环的抗生素类群,以1个大环内酯为母核,通过糖苷键与1~3分子糖相连接,对革兰氏阳性菌和支原体具有较强的抗菌活性,临床上主要用于治疗敏感菌引起的呼吸道、消化道和泌尿生殖系统感染,在低剂量下具有良好的促生长作用[1-2]。MALs产生治疗作用的同时也存在毒副作用,如果残留超标,这些动物源性食品流入餐桌后会对人体健康造成损害,具有肝、肾毒性[3]。我国2002年农业部公告第235号及2005年农业部公告第560号规定了红霉素、替米考星等部分大环内酯类药物在动物组织中的最大残留限量值,其中红霉素在动物组织中的最大残留限量(MRL)为 200 μg·kg-1;林可霉素在动物组织中MRL为100 μg·kg-1;替米考星在动物组织中MRL为100 μg·kg-1。
近年来国内外对大环内酯类抗生素的研究都有明显上升趋势,但我国对于大环内酯的残留检测研究较少,因此需要进一步加大对食品中大环内酯类药物的残留检测以保证食品安全[4-5]。目前,MALs残留检测方法主要有微生物法、免疫法(ELISA)、薄层色谱法、液相色谱法、气相色谱法、液相色谱串联质谱法等[6]。
本试验采用超高效液相色谱-串联质谱法(UPLC-MS/MS),建立了鸡肉中大环内酯类抗生素红霉素、替米考星、泰乐菌素、林可霉素、吉他霉素和螺旋霉素简便、快速、高效的检测方法。
1 材料与方法
1.1 试验材料
取新鲜鸡胸及鸡腿鸡肉,充分绞碎,匀质,-20℃避光保存。
1.2 仪器设备
AB Sciex Triple QuadTM 4500质谱仪、NEVAP-24型全自动氮吹仪、IKA旋涡混合器、梅特勒PL602E型天平、Sigma 3-30KS离心机、Milli-Q Integral 3型超纯水仪、奥特赛斯AS系列超声波清洗机、Oasis PRiME HLB(6cc,200 mg)固相萃取柱。
1.3 主要试剂与标准物质
乙腈(色谱纯)、甲醇(色谱纯)、甲酸(色谱纯);乙腈水溶液:80%乙腈水+0.2%甲酸。标准物质:红霉素、替米考星、泰乐菌素、林可霉素、螺旋霉素和罗红霉素均来自德国Dr.Ehrenstorfer;吉他霉素来自中国食品药品检定研究院。
1.4 标准溶液的配置
准确称取红霉素、替米考星、泰乐菌素、林可霉素、吉他霉素和螺旋霉素、罗红霉素的标准品,用甲醇分别配成约1.00 mg·mL-1的标准储备液,-18℃保存。
1.5 试验方法
称取试样2.5 g,精确到0.01 g,加入适量内标工作液(罗红霉素),置于50 mL离心管中,加乙腈水溶液(80%乙腈水+0.2%甲酸)10 mL,漩涡混匀1 min,超声5 min,高速冷冻离心机9 000 r·min-1离心5 min。
移取3.5 mL上清液,直接过6 cc规格PRIME HLB固相萃取柱(6 cc,200 mg),保持1 s·滴-1的速度,收集滤液。准确移出2.5 mL滤液至15 mL带刻度小管内,在40℃水浴下氮气吹至<0.5 mL。残留液用甲醇+水+甲酸(10∶90∶0.09)溶液定容至1.00 mL,过0.22 μm滤膜后,供液相色谱-串联质谱测定。
1.6 仪器条件
1.6.1 高效液相色谱条件
色谱柱:ACQUITYUPLC BEH C18(1.7 μm,2.1 mm×100 mm);流动相A相为0.1%甲酸水溶液;流动相B相为甲醇溶液;柱温位40℃;进样量5.0 μL。梯度洗脱条件见表1。
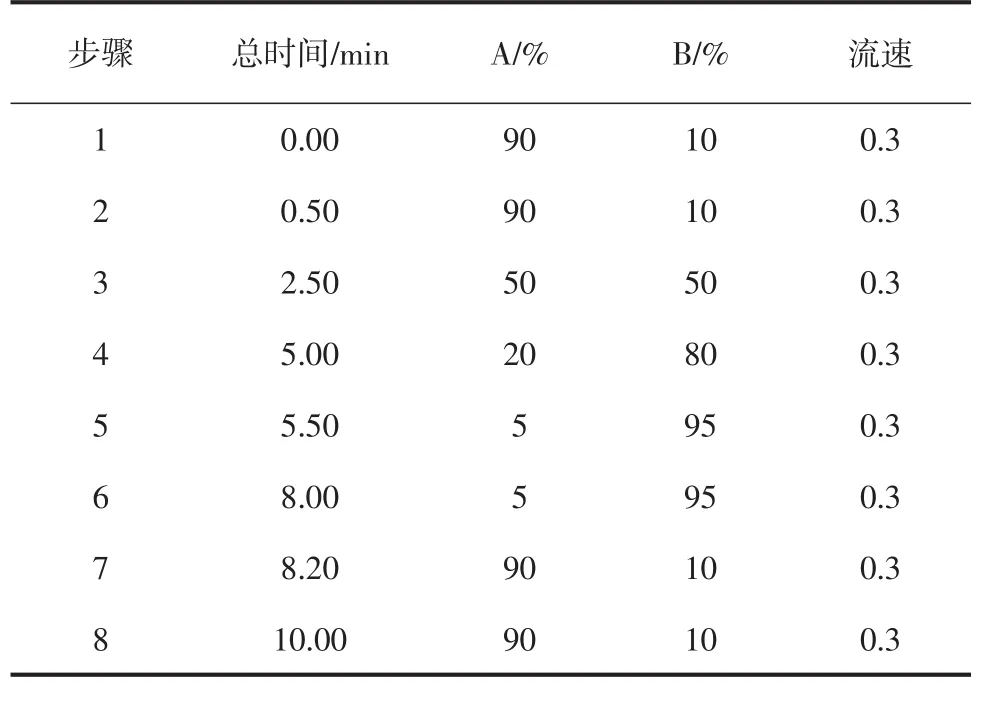
表1 梯度洗脱条件
1.6.2 质谱条件
离子源:电喷雾离子源;扫描方式:正离子扫描;检测方式:多反应监测(MRM);电离电压:3.2 kV;源温:110℃;雾化温度:350℃;锥孔气流速:50 L·h-1;雾化气流速:650 L·h-1。
MALs抗生素质谱参数见表2。
空白基质及添加药物样本。红霉素、替米考星、泰乐菌素、林可霉素、吉他霉素和螺旋霉素色谱图见图1~6。

表2 MALs抗生素质谱参数

图1 空白基质添加15.0 μg·kg-1红霉素

图2 空白基质添加15.0 μg·kg-1替米考星
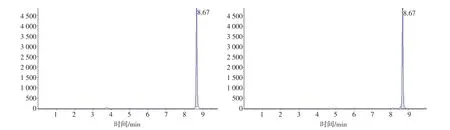
图3 空白基质添加15.0 μg·kg-1泰乐菌素

图4 空白基质添加15.0 μg·kg-1林可霉素

图5 空白基质添加15.0 μg·kg-1吉他霉素

图6 空白基质添加15.0 μg·kg-1螺旋霉素
2 结果与讨论
2.1 标准曲线
称取5个阴性样品经过上述试验方法处理获得样品空白提取液。用样品空白提取液配制混合外标浓度为1.00、2.00、5.00、10.0、50.0 μg·L-1系列标准曲线,供液相色谱串联质谱测定。
红霉素、替米考星、泰乐菌素、林可霉素、吉他霉素和螺旋霉素基质试验的线性范围在1.00~50.0 μg·L-1内,峰面积与相应回收浓度呈现良好的线性关系,其相关系数分别为r=0.999 05、r=0.999 67、r=0.999 85、r=0.999 91、r=0.999 02、r=0.999 85。
2.2 方法检出限确定
以空白鸡肉样本为基质,添加浓度为3.00μg·kg-1,按照上述方法全过程进行预处理和测定,平行样本n=6,根据各样本检测值计算出平均值X及标准偏差 Sb,再根据公式检出限(MDL)=(k×Sb×C)/X(其中:k为置信因子,一般取3),计算出红霉素、替米考星、泰乐菌素、林可霉素、吉他霉素和螺旋霉素检出限分别为0.19、0.90、0.83、0.69、0.84、0.56 μg·kg-1,均低于标准方法检出限1.0 μg·kg-1,能满足实验要求。
2.3 回收率测定
用空白基质样品进行 3.00、6.00、30.0 μg·kg-13个水平的添加回收实验,每个水平取6个平行样,按上述试验方法进行处理,供液相色谱串联质谱测定。其平均回收率和相对标准偏差结果见表3。

表3 加标样品回收率及相对标准偏差
由表3可知,本试验对鸡肉中红霉素、替米考星、泰乐菌素、林可霉素、吉他霉素和螺旋霉素的提取稳定,受到基质的干扰较小。
3 讨论与结论
本试验采用内标法对检测物质进行定量,通过测量内标物(即校正因子)及预测组分的峰面积的相对值来进行计算,在一定程度上消除了前处理操作及环境、仪器条件等的变化所引起的误差,具有较好的精密度和准确度。本试验建立的鸡肉中红霉素、替米考星、泰乐菌素、林可霉素、吉他霉素和螺旋霉素超高效液相色谱-串联质谱的测定方法通过回收率和多种食品样本的实测试验证明:上述方法样本前处理方法简便、快捷、易操作,液相色谱串联质谱的条件设置合理,相关参数优化较佳,灵敏度较高,可准确进行定性、定量检测,适用于可食动物肌肉红霉素、替米考星、泰乐菌素、林可霉素、吉他霉素和螺旋霉素残留的检测。
