康柏西普对比雷珠单抗治疗老年黄斑变性的药物经济学评价
2018-10-09
1 研究背景
1.1 流行病学特征 年龄相关性黄斑变性(AMD)是视网膜色素上皮细胞和神经视网膜退行性变造成的一种不可逆性视力下降或丧失的疾病[1]。AMD通常分为干性AMD(萎缩性)和湿性AMD(渗出性),而其中湿性AMD又分为典型性、低度典型性和隐匿性三种亚型。年龄是AMD最主要发病因素,其次为玻璃膜疣,此外种族、吸烟史、心血管疾病等因素均在一定程度上会增加患病风险。关于AMD的发生机制,目前主要有氧化刺激学说、老龄化学说、炎症免疫学说、新生血管化学说等不同的假说,其中脉络膜新生血管是引起湿性 AMD病变的重要病理过程。湿性AMD发病率虽低,但会让病患丧失更多的视力,AMD是50岁以上人群最常见的致盲眼病。在西方国家,AMD已成为第一位的致盲性眼病,在亚洲其发病率亦呈逐渐增多的趋势[2]。在我国,据吴乐正和陈又昭[3]报告AMD的发病率为10.6%;而相关文献表明,52~64岁的发病率为1.6%,75~85岁的发病率则可以达到27.9%,发病率随年龄的增长而增加[1]。由于AMD目前仍未找到彻底有效的治疗方案,因此需要注意早期诊断、早期治疗、早期康复和早期预防再发[4]。
1.2 疾病负担 AMD会引起高达 80%到 85%的致盲率。亚洲国家AMD的发病率低于西方国家,亚裔人口AMD早晚期患病率分别为6.80%和0.56%,而白种人的早晚期患病率分别为8.80%和0.59%[5]。亚洲国家中,泰国的 AMD患病率相对较低,据泰国2006—2007年的一项调查表明,0岁以上人群早晚期AMD患病率分别为2.7%和0.3%,低于其他亚洲国家。美国医疗保险系统数据表明,AMD年均总成本为57.5亿美元~73.3亿美元[6],在西欧,AMD在2002年的总预算为51.1亿欧元~1.011亿欧元[7]。在中国,湿性AMD的单眼治疗年均总费用为29 640元,以国家统计局人均 72岁的期望寿命来计算,湿性AMD的单眼治疗总费用为207 450元,每年为国家带来的总经济负担高达533.9亿元,其中直接医疗费用为168.1亿元,占总费用的31.49%,为病患和社会带来了巨大的经济负担[8]。
1.3 干预措施 2000年之前,激光治疗是AMD的主要方法,激光治疗虽然可以稳定病情,但不能改善视力且复发率高;2000年,美国食品药品监督管理局(FDA)批准维替泊芬用于光动力疗法治疗湿性AMD,但与激光疗法相同,皆不能改善视力;2004年之后,批准抗血管内皮生长因子(VEGF)的药物用于湿性AMD的治疗,包括哌加他尼、贝伐单抗、雷珠单抗、阿柏西普,这些药物疗效更好,可用于湿性AMD的各种亚型,并能显著提高视力,近些年来成为研究热点[9]。在我国,已批准用于湿性AMD治疗的 VEGF抑制剂只有雷珠单抗和康柏西普,由于使用VEGF抑制剂治疗湿性AMD会给病患带来很大的经济负担,而目前关于 VEGF抑制剂的经济性研究大都是国外对贝伐单抗、雷珠单抗、阿柏西普三种药物的经济性比较,国内相关研究很少。本文从全社会的角度,通过成本-效用分析来评价雷珠单抗和康柏西普治疗湿性老年AMD的经济性。
2 研究方法
2.1 Markov模型参数的基本假设 在 Microsoft Excel工作表中构建Markov模型来模拟AMD疾病的转归过程,通过蒙特卡罗(Monte Carlo, MC)模拟计算各周期的成本和产出,并得到累计成本和产出,通过成本-效用分析方法来评价两种治疗方案的经济性,并对结果进行敏感性分析。
研究假设模拟人群都是初诊为湿性AMD患者,年龄在 70~76岁之间,基线特征与临床试验AURORA和ANCHOR中患者的基线特征相符[10-11]。目前,我国关于湿性老年AMD的相关研究数量非常有限,无法找到各视力水平下AMD患者所占比例的流行病学数据,因此本文假定进入模型人群的视力均为20/200<VA<20/80[12]。研究时限为20年,模型周期为1年[2]。由于模拟时间超过1年,因此要对成本和产出进行贴现,本研究对成本和产出以3%的贴现率进行贴现,后续进行敏感性分析[2]。
2.2 模型构建

图1 Markov模型构建
按照最佳矫正视力得分(BCVA)划分模型涉及的 5种状态包括>20/40、20/40≥20/80、20/80≥20/200、20/200≥20/400、<20/400以及死亡状态[12],见图1。由于AMD本身不会造成死亡,所以死亡率取自 2015年不同年龄段的自然死亡率。治疗前后视力可以不变,相邻视力状态之间可以相互转换,由于随机对照试验(RCT)表明药物治疗后所看到的字母与原来相比不会低于3行,所以视力下降幅度不会超过两个状态。因为目前还没有关于雷珠单抗和康柏西普两种治疗方案的头对头试验,所以两种治疗方案疾病的转移概率分别来源于AURORA[13]和 ANCHOR[12]两个临床试验,见表 1和表2。

表1 康柏西普组的疾病状态转换概率

表2 雷珠单抗组的疾病状态转换概率
3 数据来源
3.1 成本来源 由于治疗湿性老年 AMD的成本主要来源于直接医疗成本,因此不考虑直接非医疗成本和间接成本。直接医疗成本包括检查费用、药物成本、并发症和不良反应的治疗成本。根据临床试验,两种治疗方案不良反应发生率很低且为轻度不良反应,因此其不良反应成本可忽略不计。其中,药物成本来源于药智网,其他成本来源于文献[2,14]。本研究中,成本计算以2017年物价水平为价值标准。对于非2017年的数据,采用居民消费价格指数(CPI)进行调整以消除通货膨胀的影响。根据用药频次折算出两种用药方案的单循环周期(1年)的治疗成本,概率敏感性分析假设成本服从标准差为单循环周期成本×20%的伽马分布[2,10-12],见表3。
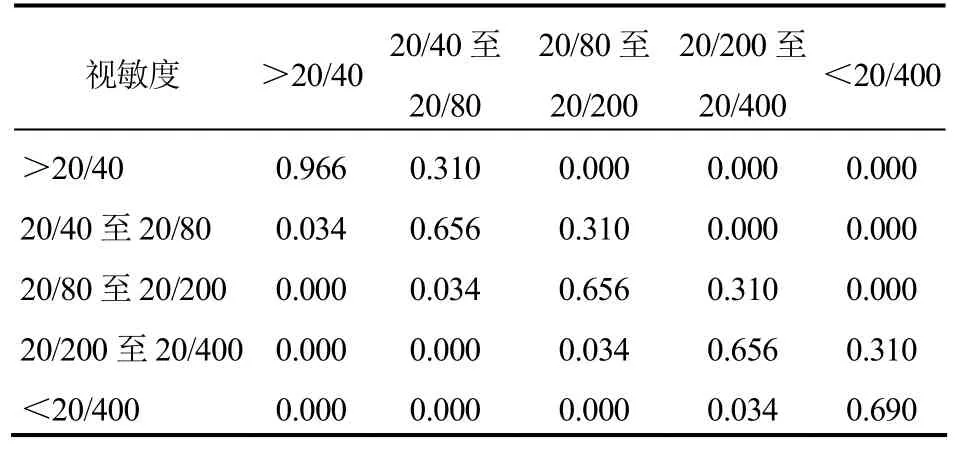
表3 单循环周期治疗成本期望值
3.2 效用值来源 由于国内还没有湿性 AMD不同视力状态效用值的研究,因此各状态效用值来源于之前文献的报告,并假设这些值可以代表我国病患不同视力状态下的效用,具体数值及分布[11],见表4。

表4 各视力状态下的效用值
4 基础分析结果
建立Markov模型进行20年的模拟,对治疗成本和QALMs按3%进行贴现后计算其成本-效用比值。结果得出,雷珠单抗组的治疗总成本为1691 608.9元,可使患者获得 10.46个 QALY,成本-效用比为161 721.69元/QALY;康柏西普组的治疗总成本为1201 730.9元,可使患者获得7.85个QALY,成本-效用比为153 086.73元/QALY。雷珠单抗相比康柏西普,每增加一个QALY需要多消耗187 692.72元,以2016年我国三倍人均国内生产总值(GDP),将意愿支付阈值(willingnesstopay, WTP)设为150 753元,由于187 692.72大于阈值,所以康柏西普更经济,见表5。

表5 两种治疗方案的成本-效用分析结果
5 敏感性分析
5.1 单因素敏感性分析 为了证明基础分析结果的稳健性,对贴现率、药物的给药频次、雷珠单抗价格以及研究时限进行了单因素敏感性分析。结果表明,雷珠单抗的给药频次会对两种药物的经济性产生较大影响,当1年内给药次数为6次时,ICER值为-100 453元/QALY,此时雷珠单抗具有绝对优势,但随着给药次数的增加,康柏西普逐渐具有经济性,这主要是因为给药次数会影响雷珠单抗的治疗成本,从而导致药物的经济性出现差异,而其他因素的变化对康柏西普为优势药物的结论并未产生明显影响,证明了基础分析的稳健性,单因素敏感性分析结果见表6。
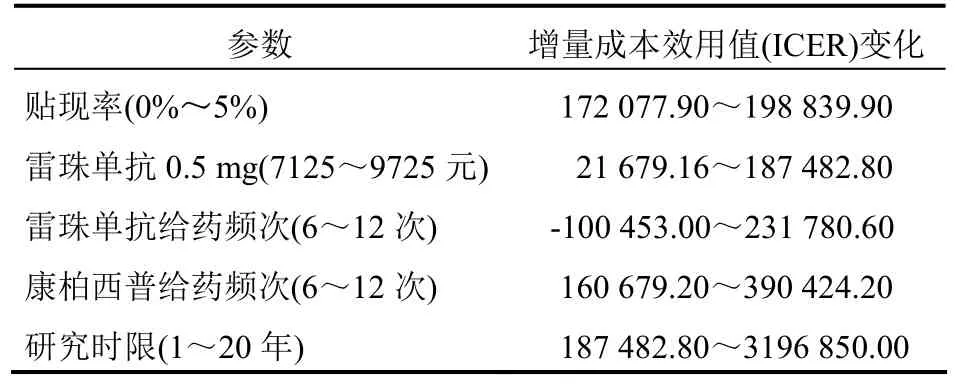
表6 单因素敏感性分析ICER变化范围
5.2 概率敏感性分析 通过 Monte Carlo模拟进行概率敏感性分析,对两种用药方案的经济性进行比较,并进行1000次模拟的散点图和成本-效果可接受曲线(cost-effectivenessacceptabilitycurves, CEACs)。结果显示,在阈值范围内康柏西普具有经济性优势的可能性约为70%,见图1和图2。
6 讨论
康柏西普和雷珠单抗为我国治疗湿性 AMD主要眼用注射剂,也是目前治疗湿性AMD最为有效的方法,但成本高昂。相关研究表明,雷珠单抗与康柏西普的安全性和有效性并无显著性差异,但后者成本更低[15]。本研究结果显示,在给药频次相当的情况下,康柏西普治疗湿性AMD更具有经济性。本研究的模型参数来源于大型随机对照试验,因此可靠性较高,但仍存在一些局限性:①由于缺少两种药物直接比较的头对头试验,参数取自两个临床试验,而试验设计、患者基线特征(人种、年龄、疾病亚型等)的差异会引起参数误差,进而使得研究结果存在较大不确定性,因此还需根据头对头试验进行进一步研究;②由于国内关于AMD的经济性研究较少,在成本数据的获得上存在困难,因此本研究只纳入了部分相关的成本数据,与实际治疗成本有所偏差;③目前我国关于AMD的相关研究数量较少,无法找到各视力状态下AMD患者所占比例的流行病学数据,因此在进行Markov模拟时,假设人群视力的初始状态为20/200<VA<20/80,这可能会潜在低估实际中视力较好患者的视力水平,从而使结果产生偏倚。

图1 增量成本效果散点图

图2 成本-效果可接受曲线
