泸型酒发酵过程中酵母菌演替规律及其对部分风味分子形成的影响
2018-10-08杨建刚郭家秀张宿义敖宗华沈才洪
杨建刚,苏 畅,窦 晓,郭家秀,张 琦,张宿义,敖宗华,沈才洪
(1.四川理工学院生物工程学院,四川 自贡 643000;2.泸州老窖股份有限公司,四川 泸州 646000)
不同国家有不同种类的著名酒精饮料,如蒸馏酒中的威士忌酒、白兰地、杜松子酒、朗姆酒、伏特加和中国白酒及酿造酒中的德国啤酒、法国葡萄酒和日本清酒[1]。与其他蒸馏酒相比,中国白酒的乙醇体积分数通常为40%~55%[2],基于风味特征,中国白酒可分为清香型、浓香型、酱香型、米香型、药香型等12 种风味。泸型酒为浓香型白酒,而泸州老窖大曲酒是浓香型白酒的典型代表,其独特的原窖工艺分层堆糟法(图1)造就了泸型大曲独特的风味与口感。泸型酒的生产以高粱为主要原料,以大曲为糖化发酵剂,采用泥窖进行多菌种混合循环固态发酵。通过分离培养和分子生物学手段,发现窖池中存在的微生物主要包括酵母、霉菌、细菌、古菌,并呈现出极高的多样性[3-4]。酵母菌作为白酒发酵过程中必不可少的微生物之一,对白酒的形成有着不可或缺的作用。传统的酵母菌株鉴定方法建立在菌株的形态、生理特性和生物化学特性质差异之上。然而这些特征会受培养条件的影响,在某种程度上具有不确定性,为确保鉴定结果的可靠性,鉴定1株菌经常需要完成50~100 项实验[5],费时费力且重复性不高。近年来,以核酸为研究对象的分子生物学技术以其简便、准确等优点逐渐被应用到酵母菌的分类鉴定中。

图1 原窖法泸型酒的发酵工艺Fig. 1 Fermentation process of Luzhou-flavor liquor
浓香型白酒窖池中化学物质的生化代谢和窖池中存在的微生物彼此联系、互相促进、互相制约、协调发展共同构成了窖池特定的微生物生态系统。发酵酒醅在窖池环境中充当着物质循环、能量流动和信息传递的“三流运转”规律的载体。环境信息通过酒醅发酵过程的传递,调控着窖池微生物种类的变化和代谢产物的生成和积累,决定着窖池物质代谢和能量代谢的走向。窖池在连续投入生产的过程中,每一个轮次,就是窖池环境中微生物区系和环境的一次动态发展和平衡的过程。在这个动态发展和平衡生态体系中任何一个因素的异常变化,都必将引起窖池中其他因素不同程度的异常变化及反馈作用,最终导致窖池中代谢产物成分和比例的变化,从而影响浓香型白酒的品质和风格[6-8]。
本研究通过对不同时期酒醅中分离酵母菌的26S rRNA D1/D2区序列进行分析,应用局部序列比对基本检索工具BLAST,在基因序列数据(GenBank)中进行同源序列搜索,比较供试菌株与已知酵母菌相应序列的同源性。对分离的130余株酵母菌的26S rRNA D1/D2区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,对扩增产物进行单链构象多态性(single strand conformation polymorphism,SSCP)分析和序列测定分析,并对酒醅不同发酵时期的风味物质进行测定,探究酒醅发酵过程酵母的演替规律及风味物质的形成规律。对两者之间的内在因果关系进行归纳与总结。
1 材料与方法
1.1 材料与试剂
对泸州老窖龙泉窖发酵0、4、8、12、20、30、44 d的酒醅进行采集。样品的采集时间点是参照Yan Shoubao等[9]的研究确定的。
Taq PCR Master Mix、引物NL1和NL4 北京博迈德生物技术有限公司;氢氧化钠、酚酞、无水乙醇(均为分析纯) 重庆川东化工(集团)有限公司;氯化钠(分析纯,纯度>99.5%)、乙醚(色谱纯)、无水乙醇(分析纯,纯度>99.9%) 成都市科龙化工试剂厂;4-辛醇(CAS编号589-62-8,纯度>97%) 梯希爱(上海)化成工业发展有限公司;干燥器(变色硅胶作干燥剂) 苏州龙辉干燥剂有限公司;实验用水均为超纯水由本实验室自制;4-辛醇溶液(3.09 g/L):准确称取0.030 9 g 4-辛醇与盛有少量色谱级甲醇的10 mL容量瓶中,用色谱级甲醇定容,混匀放置4 ℃冰箱避光保存。
1.2 仪器与设备
GT9612基因扩增仪 杭州柏恒科技有限公司;CF15R离心机 日立集团;JK600C电泳仪 北京君意东方电泳设备有限公司;Innotech凝胶成像系统 美国Alpha公司;6890 GC-5975 MS气相色谱-质谱联用仪、色谱柱DB-WAX(60 m×250 μm,0.25 μm)、1 μL进样针、HP-1色谱柱(50 m×0.2 mm,0.5 μm) 美国Agilent公司;SPME手动进样手柄 上海安谱科学仪器有限公司;萃取头50/30UM DVB/CAR on PDMS 美国Supelco公司;DHG-9123A电热干燥箱 上海一恒科学仪器有限公司;DT1002A 0.1 mg电子天平 常熟市桂衡天平仪器有限公司;DL-1电子万用炉 北京市永光明医疗仪器有限公司;蒸馏装置、25 mL或50 mL碱式滴定管 天长市旭立玻璃仪器有限公司;OP TOP电子天平(精确度0.01 g) 舜宇恒平仪器厂;EDI touch-S10超纯水机 上海和泰仪器有限公司。
1.3 方法
1.3.1 酵母菌分离
在泸州老窖龙泉窖中采取第0、4、8、12、20、30、44天的酒醅,每个时期的酒醅振荡混匀后取50 g加入450 mL无菌水里面充分混匀后,吸取1 mL混合液到装有9 mL无菌水的试管中,依次做成10-2、10-3、10-4、10-5、10-6五个梯度,然后再用YPD培养基(酵母粉10 g,葡萄糖20 g/L,蛋白胨20 g/L,琼脂20 g/L,自然pH值)和PDA培养基(马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,自然pH值)进行平板分离。
1.3.2 PCR扩增和测序
1.3.2.1 总DNA提取
在涂布的平板上挑取单菌落再划线纯化,分离纯的酵母菌株。用Makimura等[10]方法提取菌体总DNA 。
1.3.2.2 PCR扩增26S rRNA D1/D2区
PCR扩增反应正向引物NL1:5’-GCATATCGGTAAGCGGAGGAAAAG-3’,反向引物NL4:5’-GGTCCGTGTTTCAAGACGG-3’,PCR采用25 μL体系,扩增反应条件:95 ℃ 5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 45 s,循环36 次;72 ℃ 8 min[11]。
1.3.2.3 PCR产物的琼脂糖电泳检测
取2 μL PCR扩增原液点样于1%的琼脂糖凝胶电泳,溴化已锭染色后在紫外灯照射下确定是否扩出所要片段。26S D1/D2区扩增出单一明亮条带,片段大小约为500~600 bp。
1.3.3 DNA序列分析方法
1.3.3.1 DNA序列分析
用DNA Star软件并结合DNA正反向序列图谱对DNA序列进行拼接和校正。将校正后的序列在国际核酸数据库(http://www.ncbi.nlm.nih.gov/blast)中进行同源序列搜索,初步确定受试菌株的分类地位。在D1/D2区可以按如下经验值判断:1)与最近缘种的模式菌株相似率为100%,可确定为同一种;2)与最近缘种的模式菌株的相似率小于98%,可初步确定为新种;3)与最近缘种的模式菌株的相似率在99%~100%之间,它们的关系要视不同的情况而定,除考虑序列差异外,还应考虑生理生化性状差异[11]。
1.3.3.2 SSCP分析
用DCodeTM突变检测电泳仪进行SSCP检测。根据使用说明配制丙稀酰胺-甲叉双丙稀酰胺(质量比37.5∶1)的8%凝胶。采用李娟等[11]的方法,即把PCR产物稀释2~5 倍,取5 μL(大约150~300 ng)与等量的上样缓冲液(0.05%溴酚兰,0.05%二甲苯青,95%甲酰胺,4% 0.5 mol/L EDTA溶液,pH 8.0)混匀,在95 ℃变性10 min,迅速放在冰上,放置15 min。把变性后的样品依次加入到点样孔中,200 V电压10 ℃电泳16 h。电泳结束后将凝胶按照Wallace[12]的方法进行硝酸银染色,用相机拍照保存。
1.3.4 酒醅主要风味物质测定
1.3.4.1 待测样品前处理
称取25 g糟醅混合,加入体积分数73%的乙醇溶液50 mL,常压蒸馏,取馏出液25 mL,将样品送到中国泸型酒质量控制研究中心检测。
1.3.4.2 色谱条件
进样口温度:250 ℃;氢火焰离子化检测器温度:250 ℃;进样体积:1 μL;程序升温:35 ℃保持5 min,然后以5 ℃/min速率升温到95 ℃,再以10 ℃/min速率升到200 ℃,保持15 min,总运行时间42.5 min[13]。
1.3.5 酒醅乙醇含量测定
称取25 g糟醅,加入饱和氯化钠溶液50 mL,常压蒸馏,接取馏出液25 mL,取5 mL馏出液,加入2 mL乙醚进行萃取,取有机相加入10 μL 3.09 g/L的4-辛醇,进行气相色谱-质谱半定量分析。
色谱条件:DB-Wax毛细管柱,柱长30 m,内径0.32 mm,液膜厚度0.25 μm;载气He,流速2 mL/min,不分流;柱温:进样口温度保持在250 ℃,起始气相色谱柱温在40 ℃维持4 min,之后3.5 ℃/min升温到50 ℃,再以6 ℃/min升温到80 ℃,然后以8 ℃/min升到220 ℃,最后以10 ℃/min升到230 ℃,维持9 min,共计38.667 min。质谱条件:离子源温度200 ℃;接口温度250 ℃;电离方式:电子电离正离子模式;电子能量70 eV;扫描质量范围m/z 33~450;溶剂延迟时间2.3 min。定性与半定量分析:在NIST11谱库中检索出匹配度大于800的化合物,采用内标进行定量,根据4-辛醇与风味物质峰面积之比计算出挥发性风味物质含量,再乘以稀释倍数得出样品中挥发性风味物质的含量,每个样品测定3 次取平均值[14]。
2 结果与分析
2.1 26S rRNA D1/D2区序列的扩增

图2 部分26S rRNA D1/D2区序列PCR扩增产物电泳图Fig. 2 Electrophoresis of PCR amplified products of partial sequence of the D1/D2 region of the 26S rRNA D1/D2 gene
对分离的130 株菌的26S rRNA D1/D2区序列进行PCR扩增,图2为PCR扩增产物电泳图,显示产物的长度都在500~750 bp之间,这与酵母菌的D1/D2区域序列长度为500~600 bp左右相符合,说明扩增正常。
2.2 对不同种菌株的26S rRNA D1/D2 SSCP图谱比较
为降低测序成本,对分离出的130 株酵母菌首先进行26S rRNA D1/D2 SSCP图谱比较,通过比较可以找出不属于同一种类的酵母菌。由图3可以看出,不同株菌的条带差异很明显。
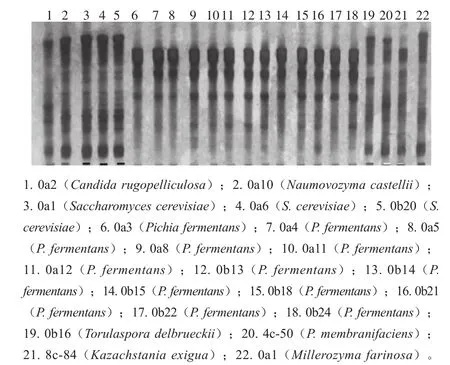
图3 菌株间的26S rRNA D1/D2 SSCP图谱比较Fig. 3 Comparison of 26S rRNA D1/D2 SSCP patterns between strains
2.3 26S rRNA D1/D2区序列的比对

表1 不同种菌株26S rRNA D1/D2区与模式菌株比对结果Table 1 Comparison of 26S rRNA D1/D2 region of different strains with model strains
通过在GenBank数据库中,对分离的130 株菌的26S rRNA D1/D2区序列进行同源序列搜索(BLAST)后,将相似度大于99%鉴定为同一种,98%~99%的鉴定为同一属,小于98%的初步鉴定为新种,结果如表1所示。有126 株鉴定到15 种,它们分属于P. fermentans、N. castellii、T. delbrueckii、S. cerevisiae、P. membranifaciens、C. humilis、K.exigua、Saccharomycopsis fibuligera、M. farinosa、C.cabralensis、P. kudriavzevii、C. ethanolica、P. occidentalis和Zygosaccharomyces bailii。另外4 株相似度小于98%,初步认为可能是新种,需进一步确定。
2.4 基于26S rRNA D1/D2 区序列构建M-L系统树
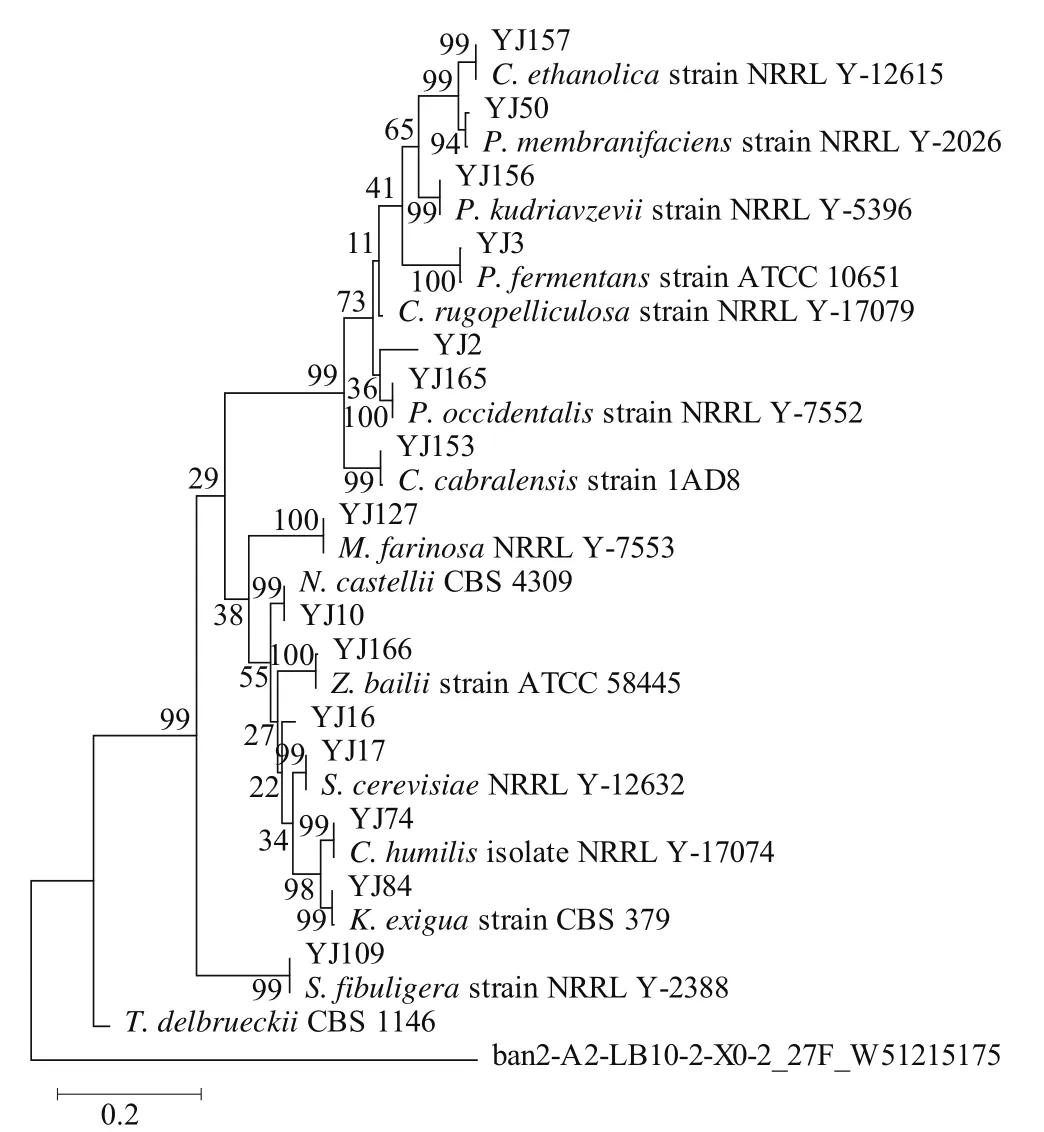
图4 基于26S rRNA D1/D2区序列构建的M-L系统树Fig. 4 M-L system tree based on 26S rRNA D1/D2 region sequence
用软件MEGA 6.06对所有序列进行比对后,删除两端未对齐的碱基生成进化树,并进行1 000 次的Bootstraps检验。采用“Maximum Likelihood Tree”方法显示进化树,其中ban2-A2-LB10-2-X0-2菌株为外群,如图4所示,对酒醅中分离出的15 种类型的酵母菌的种间亲缘关系进行了界定,可以发现分离出的菌株中的优势菌株为:C. rugopelliculosa、P. fermentans、S. cerevisiae、P. membranifaciens、C. humilis、S. fibuligera、C. cabralensis、P. kudriavzevii、C. ethanolica、P. occidentalis。
2.5 酒醅不同发酵时期各类型酵母菌数量的聚类分析
对不同发酵时期分离的酵母菌的26S rRNA D1/D2区序列比对鉴定后,结合前期平板计数的统计结果分析,从图5可以直观看出,在酒醅发酵的各时期占优势地位的酵母菌。第0天占主体地位的酵母菌为C. rugopelliculosa、P. fermentans、N. castellii、T. delbrueckii和S. cerevisiae;第4天酵母数量很丰富、其中占优势的酵母菌为N. castellii、T. delbrueckii、S. cerevisiae和P. membranifaciens;第8天酵母菌数量仍然很多,但种类有所减少,主要以S. cerevisiae、C. humilis和K. exigua为主;第12天随着窖内环境的变化,酵母菌的数量和种类都有所下降,这时期窖内的酵母菌以N. castellii和S. cerevisiae为主体;到20~30 d,随着窖内酸度和乙醇含量的上升,使得酿酒酵母成为窖池内的主体菌株,第44天,这时期发酵结束,可以看出窖内的酵母菌数量很少,种类趋于多样化,其中C. ethanolica的出现很有可能与窖内乙醇含量的升高有关。
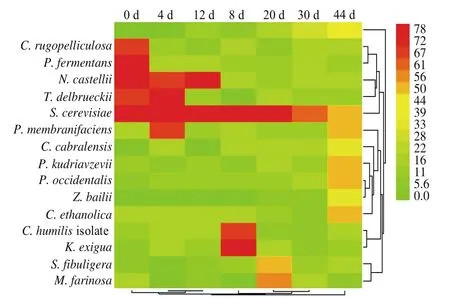
图5 酒醅不同发酵时期各类型酵母菌的数量聚类热图Fig. 5 Quantitative clustering chart of various species of yeasts in fermented grains at different fermentation times
2.6 酒醅不同发酵时期风味物质分析
对不同时期浓香型白酒酒醅中主要的四大酯演变规律进行定量分析,结果如图6所示,四大酯含量变化趋势基本保持一致。在0~12 d,窖池内酵母的种类较为丰富,C. rugopelliculosa、P. fermentans、N. castellii、T. delbrueckii、S. cerevisiae和P. membranifaciens在酒醅酵母占据主导地位,刚开始发酵期间由于窖池中环境较为优越,四大酯类呈迅速上升趋势(图6)。而在0~12 d,如图7所示,酒醅中乙醇含量也呈上升趋势,推测酯类上升跟乙醇上升有着一定的关联,产酯酵母对乙醇亲和力很强,以乙醇作碳源能发育很好,而且又有较强的氧化特性。乙醇能增进产酯酵母的呼吸作用,与酯发酵之间存在特殊关联,产酯酵母具有一定的乙醇发酵力又具备醋酸发酵的能力。酯发酵组成中的羰基来自乙醇的氧化生成物,即产酯酵母必须具有氧化乙醇的能力[15]。在12~20 d,大多数酯类呈下降趋势,乙醇含量也呈下降趋势,这可能与窖池的温度相关,在酒醅发酵第12天,由于酒醅细菌数量迅速增加,导致窖池环境达到一个顶温[16],有很多学者对产酯酵母产酯条件进行过研究,其研究结果大致相同:产酯酵母通常在19~30 ℃的温度范围内均能产酯,但最适产酯温度为25~30 ℃;培养温度升至37 ℃以上时,产酯量则急剧下降,甚至不产酯;而对于少数酵母,如球拟酵母在35 ℃培养时,能保持最高的产酯量,但产酯能力也相对较弱[17]。图5也能反映在12~20 d酵母数量呈下降趋势,不论是酵母数量还是产酯条件,都不利于酒醅中酯类物质的生成。在20~30 d己酸乙酯、乳酸乙酯呈上升趋势,其中乳酸乙酯呈明显上升这可能是由于窖池中乳酸菌一直是在细菌里面占据主导地位[18-19]。其次,到了发酵后期,营养物质的消耗可能导致乳酸菌产生大量的乳酸,乳酸作为底物被酵母利用而生成更多的乳酸乙酯,而己酸乙酯在20~30 d内呈明显上升,这可能由于窖池中氧气被消耗,其他菌的数量呈下降趋势,己酸菌作为厌氧菌,可以与酒曲发酵产生的乙醇发生酯化反应,生成浓香型白酒的所特有的主体香成分己酸乙酯[20],这一过程也能从乙醇含量的减少反映。在第44天以后乳酸乙酯、乙酸乙酯呈上升趋势,酵母菌中种群丰度较大,但相对数量较少,造成乳酸乙酯、乙酸乙酯含量上升可能是多种酵母与乳酸菌之间多微共酵,不少报道证实了乳酸菌、醋酸菌与酵母协同发酵会产生比单菌发酵更多的风味相关物质[21-24]。而其余两大酯含量均呈下降趋势,这是窖池环境中营养物质的消耗导致相关微生物数量下降导致。
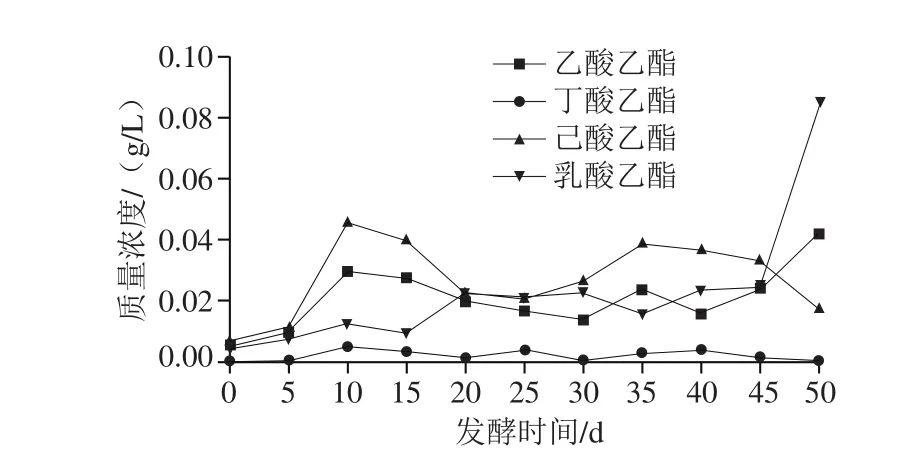
图6 酒醅不同发酵时期主要酯类变化曲线Fig. 6 Change in major ester contents in fermented grains during fermentation

图7 酒醅不同发酵时期乙醇含量变化曲线Fig. 7 Change in ethanol content in fermented grains during fermentation
3 讨 论
本研究首先通过传统分离方法,对泸型酒发酵过程不同时期酒醅中的酵母菌进行了分离,得到了130 株酵母菌,进一步应用26S rRNA D1/D2区序列分析法,对将其中126 株鉴定为15 个不同种的酵母。其次,对影响泸型酒酒质的四大酯类进行跟踪探究,发现在0~12 d发酵期间主要呈上升趋势,推测可能刚开始发酵阶段,窖池环境相对其他时间段优越,酵母的数量和种类都比较丰富,有利于产酯酵母如C. rugopelliculosa、P. fermentans、N. castellii、T. delbrueckii、S. cerevisiae和P. membranifaciens产酯。而在12~20 d四大主体相关风味物质基本呈下降趋势,这可能是顶温区后,除了部分耐热细菌还能存活,大多数酵母因不能耐受高温而导致数量减少,影响了风味物质的生成。在20~30 d乳酸乙酯、己酸乙酯呈上升趋势,这可能与微生物在发酵过程前期,己酸菌及其他细菌分解、利用葡萄糖和淀粉等糖类物质产生大量己酸和乳酸,导致己酸乙酯和乳酸乙酯呈上升趋势。44 d后丁酸乙酯和己酸乙酯下降可能与恶劣的环境导致与其相关微生物数量下降有直接关系。
目前对于白酒相关微生物的研究方法已有很多,例如DGGE和高通量等方法。Zhang Liqiang等[25]运用PCR-DGGE技术解析了不同类型大曲中微生物的组成差异;Zheng Qi等[26]运用高通量测序技术对30 a窖龄和300 a窖龄的泸州老窖窖泥微生物的多样性进行了系统分析。这些技术与传统的分离鉴定方法存在着很大的优势,可以简单直观地反映出某一时期某种物质中可培养以及不可培养微生物的组成,但传统分离也存在着自身独有的优势,相比较现代分子生物学技术它可以得到活的菌株,为微生物的进一步研究提供基础。本实验虽然对不同时期酒醅中分离的酵母菌的26S rRNA D1/D2区序列进行分析,取得了一定的效果,但是自然界中微生物的多样性非常复杂[27],绝大多数微生物不能通过传统纯培养的方法在培养皿上进行培养和分离,研究显示,只有1%~5%的微生物可以在实验室实现纯培养[28]。再者,基于rRNA基因片段或ITS区域高通量测序的微生物多样性分析一方面只能依赖于基因库中已知基因序列做出推断,另一方面由于核糖体RNA基因片段的保守性较高,许多未知微生物往往只能鉴定到所在属,因而只能在门、纲、目、科、属这些级别进行微生物群落进化和种属亲缘关系分析;同时由于缺乏功能基因的具体信息,使进一步深入研究面临瓶颈[29]。
近年来,随着分子生物学50余年突飞猛进式的发展,“组学时代”的序幕已经拉开,在食品行业,宏基因组、宏转录组也开始发挥它们的作用[30-32],用于探索各种微生物在发酵过程中的代谢途径、揭示它们特定的功能和对风味的贡献。因此要明确目标风味成分的消长规律与酵母演替规律及其代谢特性之间的内在因果关系,需要借助宏基因组与宏转录组技术,为进一步研究传统中国白酒发酵机理提供一定理论依据。
