极端嗜热酸性α-淀粉酶PFA在枯草芽孢杆菌中的高效分泌表达
2018-10-08郭建军
袁 林,曾 静*,郭建军,郭 浩,杨 罡,陈 俊
(江西省科学院微生物研究所,江西 南昌 330096)
来源于极端嗜热微生物的极端嗜热酶具有优良的热稳定性和高温催化活性,对有机溶剂、去污剂、变性剂等具有很强的耐受性[1-3]。极端嗜热酶作为生物催化剂参与高温反应具有提高反应速率和产率、防止常温微生物的污染、减少能耗等优点,因此极端嗜热酶广泛应用于工业领域和生物技术领域[4-5]。极端嗜热酸性α-淀粉酶具有反应温度高、热稳定性好、酸性条件下酶活力高等优点,能够克服淀粉液化工艺的主要缺点,如pH值的反复调节、高温条件下淀粉酶活力的丧失以及随之而产生的温度调节等工艺,从而简化淀粉液化工艺流程、避免pH值的反复调节、降低能耗[6-12]。因此极端嗜热酸性α-淀粉酶在淀粉液化工艺中具有巨大的应用潜力。
极端嗜热微生物是极端嗜热酸性α-淀粉酶的直接来源。但是极端嗜热微生物的培养条件严格,如其最适生长温度在80 ℃以上,大多数极端嗜热微生物是严格厌氧的,并且极端嗜热微生物的产酶量低,因此直接从极端嗜热微生物中分离获得大量极端嗜热酸性α-淀粉酶是较为困难的[3-4]。这限制了极端嗜热酸性α-淀粉酶在淀粉液化工艺中的应用。因此采用基因工程和蛋白质工程方法将极端嗜热酸性α-淀粉酶的基因进行克隆并将其在常温宿主中进行表达,从而获得适用于淀粉液化工艺的极端嗜热酸性α-淀粉酶具有重要的应用价值。枯草芽孢杆菌(Bacillus subtilis)作为传统的工业生产菌株,具有分泌能力强、培养条件和基因操作简单、发酵工艺成熟等优点,被认为是理想的外源蛋白质的分泌表达宿主菌[13-14]。外源蛋白质在枯草芽孢杆菌表达系统中的分泌表达依赖于枯草芽孢杆菌信号肽的引导,并且信号肽与外源蛋白质之间存在适配性[15]。因此针对特定的蛋白质需要选择合适的信号肽来实现有效的分泌表达。
来源于极端嗜热古生菌(Pyrococcus furiosus)的极端嗜热酸性α-淀粉酶PFA是目前已知的热稳定性最好的α-淀粉酶。PFA的最适反应温度高达100 ℃,最适反应pH值为5.0,在未补加Ca2+的条件下于98 ℃的半衰期长达13 h,并且其热稳定性和高温活性均不依赖于Ca2+[16-17]。鉴于PFA的优良酶学性质,其在淀粉液化工艺中具有巨大的应用潜力,大量获得PFA是其应用于淀粉液化工艺的前提条件。为探索极端嗜热酸性α-淀粉酶PFA在枯草芽孢杆菌WB600中的高效分泌表达条件,本研究根据来源于枯草芽孢杆菌的9 种结构特征不同的Sec分泌途径信号肽进行筛选,以获得引导PFA高效分泌表达的信号肽。在此基础上,为进一步优化PFA的分泌表达,对筛选得到的信号肽进行突变,通过比较不同信号肽突变体的引导分泌效率,获得引导分泌效率最优的信号肽突变体,从而实现PFA在枯草芽孢杆菌中高效分泌表达的目的。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
大肠杆菌JM109、枯草芽孢杆菌WB600、枯草芽孢杆菌表达载体pSTOP1622均由本实验室保存。
1.1.2 培养基
大肠杆菌JM109和枯草芽孢杆菌WB600的培养均采用LB培养基。
1.1.3 试剂
KOD DNA聚合酶及KOD-Plus-neo DNA聚合酶日本Toyobo公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、低分子质量蛋白质Marker 美国Fermentase公司;DNA胶回收试剂盒、质粒抽提试剂盒E.Z.N.A. 美国Omega Bio-Tek公司;Chelating SepharoseTMFast Flow 美国GE Healthcare公司;Gibson Assembly Master Mix 美国NEB公司;Bradford法蛋白浓度测定试剂盒 上海生工生物工程股份有限公司;其他化学试剂均为国产或进口分析纯;基因合成由上海博益生物科技有限公司完成;聚合酶链式反应(polymerase chain reaction)引物合成和测序由上海生工生物工程股份有限公司完成。
1.2 仪器与设备
Mastercycler gradient PCR仪 美国Eppendorf公司;TY04S-3C凝胶成像系统 北京君意东方电泳设备有限公司;SP-752PC紫外-可见分光光度计 上海光谱仪器有限公司;SCIENTZ-IID超声波细胞破碎仪 宁波新芝生物科技股份有限公司;MicroPulser电穿孔仪 美国Bio-Rad公司。
1.3 方法
1.3.1 分子克隆技术和表达产物的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphatepolyacrylamide gel electrophoresis,SDS-PAGE)分析
分子克隆技术和表达产物的SDS-PAGE分析参照文献[18]进行。
1.3.2 重组质粒pSTOP1622-pfa的构建及鉴定
α-淀粉酶PFA基因pfa由上海博益生物科技有限公司合成。设计引物P1和P2对基因pfa进行PCR扩增(表1)。PCR扩增条件为:98 ℃ 5 min;98 ℃ 20 s,60 ℃ 20 s,74 ℃ 2 min,30 个循环;74 ℃ 10 min。扩增产物经BglII和KpnI双酶切,连接至载体pSTOP1622,构建重组质粒pSTOP1622-pfa。采用BglII和KpnI双酶切质粒鉴定是否有外源基因的插入。

表1 构建重组质粒所用引物Table 1 Primer sequences for the construction of recombinant plasmids
1.3.3 信号肽筛选载体的构建与鉴定
根据PFA的基因序列设计PCR引物P3(表1),以合成基因pfa为模板,以P3、P2为引物,进行PCR扩增,获得不含信号肽的结构基因pfads。扩增产物经BglII和KpnI双酶切,连接至载体pSTOP1622,构建重组质粒pSTOP1622-pfads。并采用BglII和KpnI双酶切质粒鉴定是否有外源基因的插入。
采用NEB公司的Gibson Assembly Master Mix构建包含枯草芽孢杆菌信号肽(表2)和重组载体pSTOP1622-pfads的信号肽筛选载体。所需引物(表1中P4和P5)按照该产品说明书的要求进行设计,PCR等相关操作按照该产品说明书进行。具体操作如下:以pSTOP1622-pfads为模板,采用引物P4、P5(表1),进行PCR扩增得到载体片段;PCR扩增条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 20 s,68 ℃ 4 min,35 个循环;68 ℃ 10 min。在NCBI网站(https://www.ncbi.nlm.nih.gov/)查询表2中信号肽的核苷酸序列,采用化学全合成方法分别合成包含同源臂和信号肽核苷酸序列的DNA片段(5’-CAAACTAGTTCGAAGATCT-信号肽核苷酸序列-AAGCTCCAAGTATTTTGC-3’)。PCR扩增得到的载体片段分别与不同的DNA片段混合,采用Gibson Assembly Master Mix进行无缝克隆,获得包含不同信号肽的信号肽筛选载体。以信号肽筛选载体为模板,采用引物P6、P7(表1)进行PCR扩增,获得包含信号肽核苷酸序列的约500 bp的DNA片段。将DNA片段送至上海生工生物工程股份有限公司进行测序,并与对应信号肽基因序列进行比对确认。

表2 筛选信号肽的特征说明Table 2 Characteristics of different signal peptides
1.3.4 信号肽YfkN的突变
根据点突变试剂盒的说明,结合信号肽YfkN的核苷酸序列和拟突变的氨基酸位点设计引物,如表3所示。以信号肽筛选载体pSTOP1622-YfkN-pfads为模板,采用表3中引物进行PCR扩增,得到包含载体序列和基因序列的线性片段。PCR扩增条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 20 s,68 ℃ 5 min,35 个循环;68 ℃ 10 min。扩增产物经DpnI酶处理后,转化大肠杆菌JM109,氨苄青霉素抗性平板筛选转化子,测序鉴定是否为突变基因。

表3 信号肽YfkN突变所用引物Table 3 Primer sequences used for the mutagenesis of signal peptide YfkN

续表3
1.3.5 枯草芽孢杆菌WB600感受态细胞的制备和转化
枯草芽孢杆菌WB600感受态细胞的制备和转化采用改进的Spizizen法[19]进行。
1.3.6 重组α-淀粉酶的诱导表达和纯化
接种重组枯草芽孢杆菌单克隆到LB液体培养基中,用250 mL三角瓶进行培养,其中培养基的装液量为20 mL,培养温度为37 ℃,转速为200 r/min,培养时间为10 h。然后转接该培养物于新鲜LB液体培养基中,用250 mL三角瓶进行培养,其中培养基的装液量为25 mL,接种量为3%,培养温度为37 ℃,转速为200 r/min。当培养至菌体OD600nm达到1时,添加终质量浓度为0.5 g/100 mL的木糖,诱导细胞表达重组蛋白质,诱导时间为30 h。待发酵结束后,测定发酵上清液和重组枯草芽孢杆菌胞内的α-淀粉酶活力,分析表达情况。
采用Ni2+亲和层析柱对发酵上清液中目的蛋白质进行纯化,用200 mmol/L咪唑洗脱缓冲液洗脱,即得到纯化后的重组α-淀粉酶。利用SDS-PAGE检测重组α-淀粉酶的纯度,并采用Bradford法[20]测定重组α-淀粉酶含量。
1.3.7 α-淀粉酶活力测定
将10 μL酶液与490 μL含1 g/100 mL可溶性淀粉的50 mmol/L MES,pH 5.0缓冲液混合,于95 ℃反应30 min后,迅速放入冰水浴中终止反应,然后采用3,5-二硝基水杨酸法[21]测定反应体系中还原糖量。酶活力单位定义:在一定反应条件下,每分钟催化产生1 μmol还原糖的酶量为一个酶活力单位(U)。
1.3.8 α-淀粉酶的酶学性质分析
按照上述反应体系混合酶液和底物,分别于40~130 ℃反应30 min,测定不同温度下绝对酶活力,并以绝对酶活力对时间作图,确定其最适反应温度。
将酶液与不同pH值的1 g/100 mL可溶性淀粉溶液混合,于95 ℃进行酶活力测定。采用不同缓冲液配制不同pH值的1 g/100 mL可溶性淀粉溶液:50 mmol/L MES(pH 4.0~7.0)、50 mmol/L MOPS(pH 7.0~9.0)。
将酶液于100 ℃保温,分时间梯度取出部分样品,根据如上反应体系测定酶活力。将未处理酶液的酶活力定义为100%,并以相对酶活力对时间作图,评价酶的热稳定性。
以上α-淀粉酶的酶学性质研究中均设置α-淀粉酶和补加5 mmol/L Ca2+的α-淀粉酶作为实验组。
1.4 数据统计分析
α-淀粉酶的酶学性质研究实验中,每个实验做3 个平行。运用软件SigmaPlot 11.0对数据进行统计分析并作图,数据均以±s表示。
2 结果与分析
2.1 重组质粒的酶切鉴定
采用化学合成法合成了极端嗜热α-淀粉酶PFA的基因pfa,将基因pfa连接至载体pSTOP1622,构建重组质粒pSTOP1622-pfa。以基因pfa为模板,采用PCR方法扩增基因pfa中除去编码信号肽的基因序列的基因片段pfads,并连接至载体pSTOP1622,构建质粒pSTOP1622-pfads。采用限制性内切酶BglII和KpnI酶切质粒pSTOP1622-pfads和pSTOP1622-pfa,得到大小分别约为6 000 bp和1 300 bp的两个片段(图1)。

图1 重组质粒的酶切鉴定Fig. 1 Identification of recombinant vectors by restriction enzyme digestion
2.2 信号肽筛选载体的PCR鉴定
采用Gibson Assembly Master Mix进行无缝克隆,构建包含不同枯草芽孢杆菌信号肽和重组载体pSTOP1622-pfads的信号肽筛选载体。以不同的信号肽筛选载体和阴性对照pSTOP1622为模板,采用表1中引物P6、P7进行PCR扩增,拟获得包含信号肽核苷酸序列和PFA部分编码序列的约500 bp的DNA片段。如图2所示,以阴性对照pSTOP1622为模板的反应无扩增产物出现,以信号肽筛选载体(pSTOP1622-pfa、pSTOP1622-BglC-pfads、pSTOP1622-YhfM-pfads、pSTOP1622-OppA-pfads、pSTOP1622-AprE-pfads、pSTOP1622-AmyE-pfads、pSTOP1622-Mpr-pfads、pSTOP1622-YfkN-pfads、pSTOP1622-Bpr-pfads、pSTOP1622-AbnA-pfads)为模板的反应均有约500 bp的扩增产物出现。将扩增得到的DNA片段送至上海生工生物工程股份有限公司进行测序,并将测序结果与对应信号肽基因序列进行了比对确认(结果未显示),证实各信号肽筛选载体均构建成功。
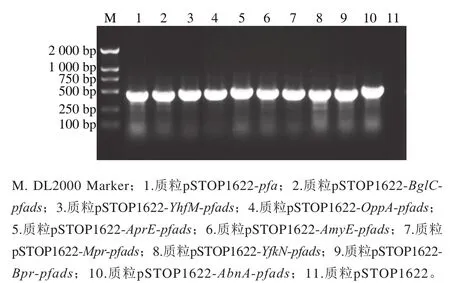
图2 信号肽筛选载体的PCR鉴定Fig. 2 PCR identification of signal peptide screening vectors
2.3 重组α-淀粉酶的诱导表达
将阴性对照pSTOP1622以及不同的信号肽筛选载体分别转化枯草芽孢杆菌WB600,获得重组枯草芽孢杆菌并进行诱导表达。待表达完成后,分别收集发酵上清液和发酵菌体,测定发酵上清液和发酵菌体中α-淀粉酶活力,同时采用SDS-PAGE分析发酵上清液和发酵菌体中重组α-淀粉酶的表达情况。酶活力测定结果如图3所示,α-淀粉酶PFA的信号肽PFA以及来源于枯草芽孢杆菌的信号肽BglC、YhfM、OppA、AprE、AmyE、Mpr、YfkN、Bpr、AbnA均能引导α-淀粉酶PFA分泌到发酵上清液中,其中信号肽YfkN优于其他信号肽。相对于α-淀粉酶PFA的自身信号肽,使用信号肽YfkN后分泌表达量提高了约10 倍。此外,SDS-PAGE检测结果(图4)显示,转化了不同信号肽筛选载体的重组枯草芽孢杆菌的发酵上清液中有一条约45 kDa的蛋白质条带,且使用信号肽YfkN后发酵上清液中重组α-淀粉酶的表达量显著提高;以上重组枯草芽孢杆菌的发酵菌体中能观察到约48 kDa的蛋白质条带,这可能是未经信号肽引导分泌至胞外而滞留在胞内的蛋白质前体物质。转化了阴性对照pSTOP1622的重组枯草芽孢杆菌的发酵上清液和发酵菌体中均未能检测到对应大小的蛋白质条带。SDS-PAGE检测结果与酶活力检测结果是相对应的。

图3 不同信号肽对酶活力的影响Fig. 3 Signal peptide dependence of α-amylase activity
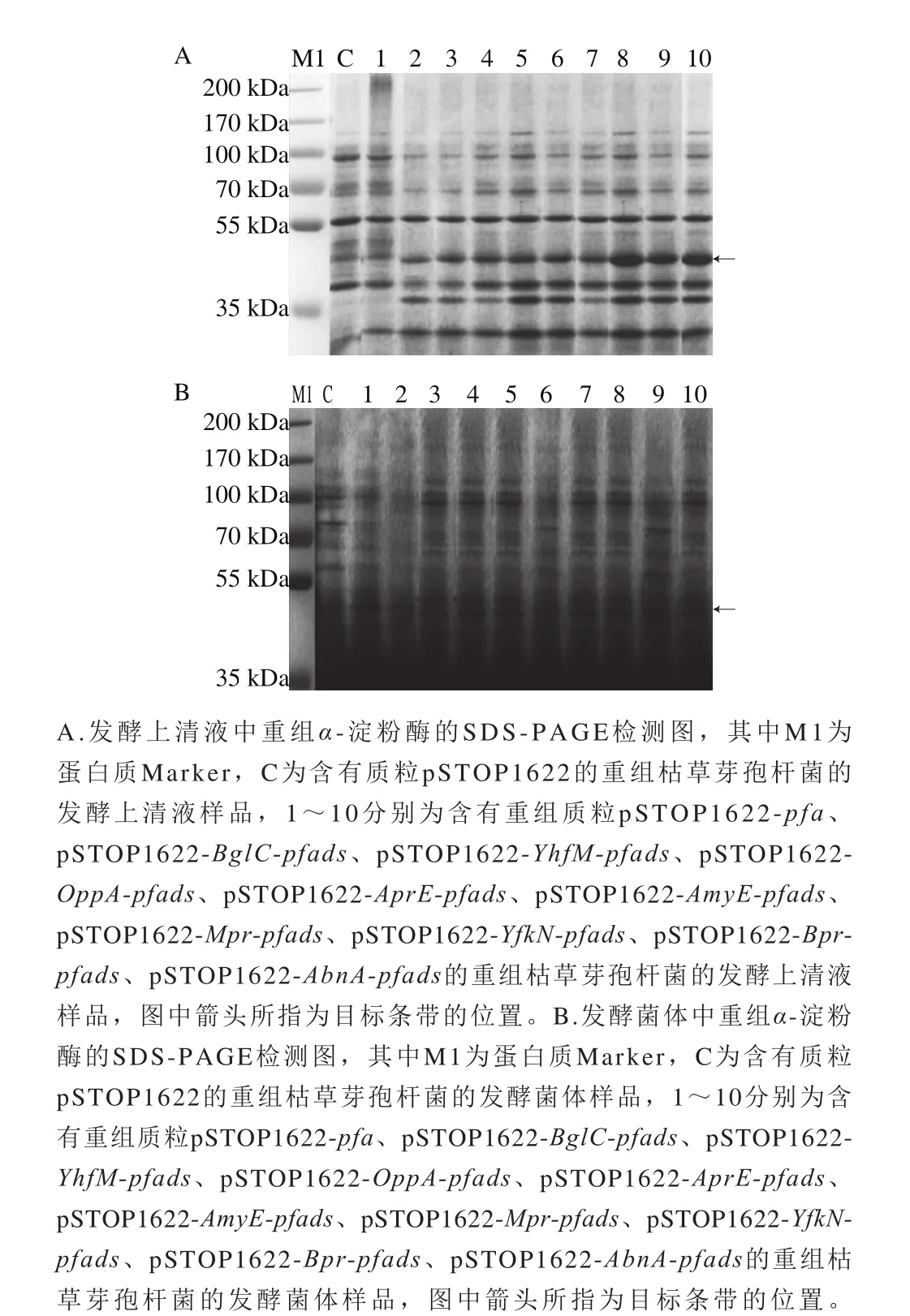
图4 重组α-淀粉酶的SDS-PAGE检测图Fig. 4 SDS-PAGE analysis of recombinant α-amylases
2.4 YfkN信号肽优化对α-淀粉酶PFA分泌表达的影响
研究表明,枯草芽孢杆菌信号肽的组成结构会影响其对蛋白质的引导分泌效率,其中增加信号肽N端带正电荷氨基酸数量可能提高蛋白质的分泌效率[15]。本研究通过对信号肽YfkN的N端中不带电荷氨基酸残基Ile3和Gln4进行饱和突变,并比较信号肽YfkN与其突变体对α-淀粉酶PFA的引导分泌效率确定YfkN信号肽优化对α-淀粉酶PFA分泌表达的影响。
2.4.1 YfkN信号肽中Ile3的饱和突变对PFA分泌表达的影响
对信号肽YfkN的Ile3进行饱和突变,获得包含不同信号肽突变体的表达载体。将阴性对照pSTOP1622以及不同的表达载体分别转化枯草芽孢杆菌WB600,获得重组枯草芽孢杆菌并进行诱导表达。待表达完成后,分别收集发酵上清液和发酵菌体,测定发酵上清液和发酵菌体中α-淀粉酶活力。酶活力测定结果如图5所示,信号肽YfkN以及其Ile3的饱和突变体均能引导α-淀粉酶PFA分泌到发酵上清液中,并且信号肽突变体I3G优于其他信号肽。使用信号肽突变体I3G后重组枯草芽孢杆菌的胞外α-淀粉酶活力由539.5 U/mL提高至578.5 U/mL。此外,酶活力测定结果也显示信号肽突变体I3P、I3F、I3W、I3D、I3E、I3T、I3N、I3S、I3Q、I3Y、I3C、I3M的引导分泌效率明显低于信号肽YfkN,这说明以上氨基酸残基的替换不利于信号肽引导α-淀粉酶PFA分泌至胞外。
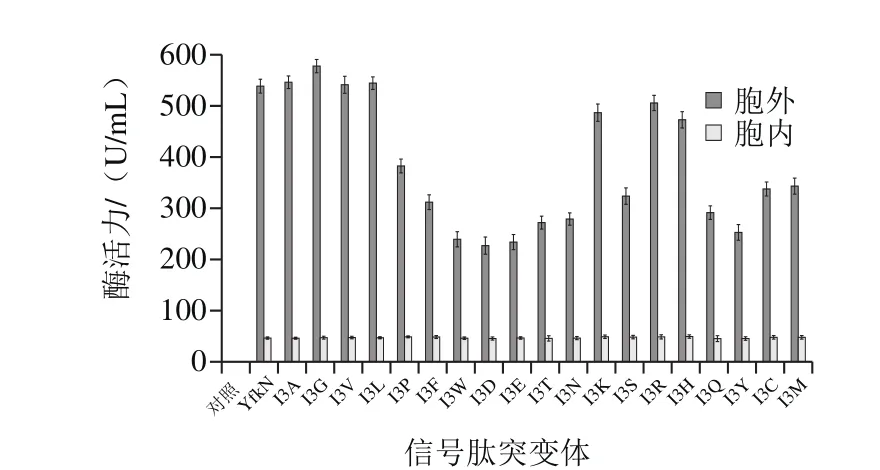
图5 不同信号肽对酶活力的影响Fig. 5 Signal peptide dependence of α-amylase activity
2.4.2 YfkN信号肽中Gln4的饱和突变对PFA分泌表达的影响
对信号肽YfkN的Gln4进行饱和突变,获得包含不同信号肽突变体的表达载体。将阴性对照pSTOP1622以及不同的表达载体分别转化枯草芽孢杆菌WB600,获得重组枯草芽孢杆菌并进行诱导表达。待表达完成后,分别收集发酵上清液和发酵菌体,测定发酵上清液和发酵菌体中α-淀粉酶的活力。如图6所示,信号肽YfkN以及其Gln4的饱和突变体均能引导α-淀粉酶PFA分泌到发酵上清液中,并且信号肽突变体Q4R优于其他信号肽。使用信号肽突变体Q4R后重组枯草芽孢杆菌的胞外α-淀粉酶活力由539.5 U/mL提高至617.5 U/mL。此外,酶活力测定结果也显示对于Gln4位点,采用氨基酸残基Pro、Phe、Trp、Asp、Glu、Thr、Asn、Ser、Tyr进行替换不利于信号肽引导α-淀粉酶PFA分泌至胞外。

图6 不同信号肽对酶活力的影响Fig. 6 Signal peptide dependence of α-amylase activity
2.4.3 YfkN信号肽突变体对PFA分泌表达的影响
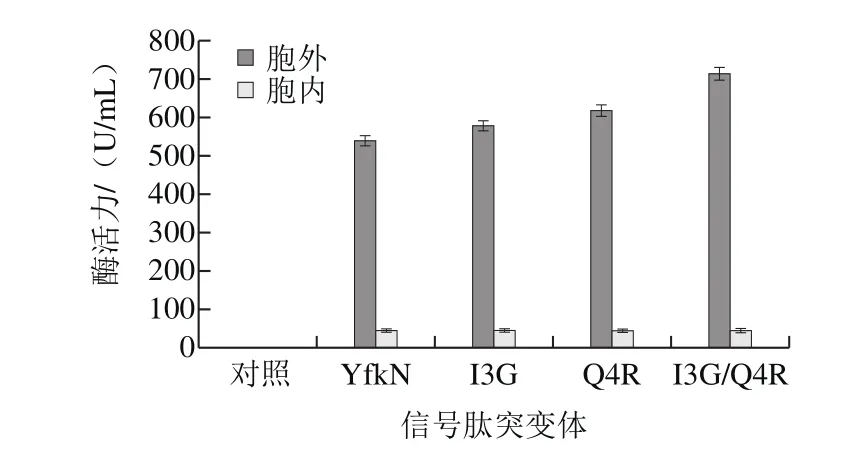
图7 不同信号肽对酶活力的影响Fig. 7 Signal peptide dependence of α-amylase activity

图8 重组α-淀粉酶的SDS-PAGE图Fig. 8 SDS-PAGE analysis of recombinant α-amylases
将阴性对照pSTOP1622、质粒pSTOP1622-YfkN-pfads、pSTOP1622-I3G-pfads、pSTOP1622-Q4R-pfads、pSTOP1622-I3G/Q4R-pfads分别转化枯草芽孢杆菌WB600,获得重组枯草芽孢杆菌并进行诱导表达。待表达完成后,分别收集发酵上清液和发酵菌体,测定发酵上清液和发酵菌体中α-淀粉酶活力,同时采用SDSPAGE分析发酵上清液和发酵菌体中重组α-淀粉酶的表达情况。酶活力测定结果(图7)表明,与信号肽YfkN相比,信号肽突变体I3G、Q4R和I3G/Q4R对α-淀粉酶PFA的引导分泌效率逐步提高。其中使用信号肽突变体I3G/Q4R后,重组枯草芽孢杆菌的胞外α-淀粉酶活力由539.5 U/mL提高至715 U/mL。此外,SDS-PAGE检测结果(图8)与酶活力检测结果相一致,使用信号肽突变体I3G/Q4R后,α-淀粉酶PFA的胞外表达量更高。以上结果表明,采用氨基酸残基Gly替换第3位Ile,并采用氨基酸残基Arg替换第4位Gln,有利于信号肽引导α-淀粉酶PFA分泌到发酵上清液中。
2.5 重组α-淀粉酶的酶学性质
2.5.1 pH值对重组α-淀粉酶活力的影响
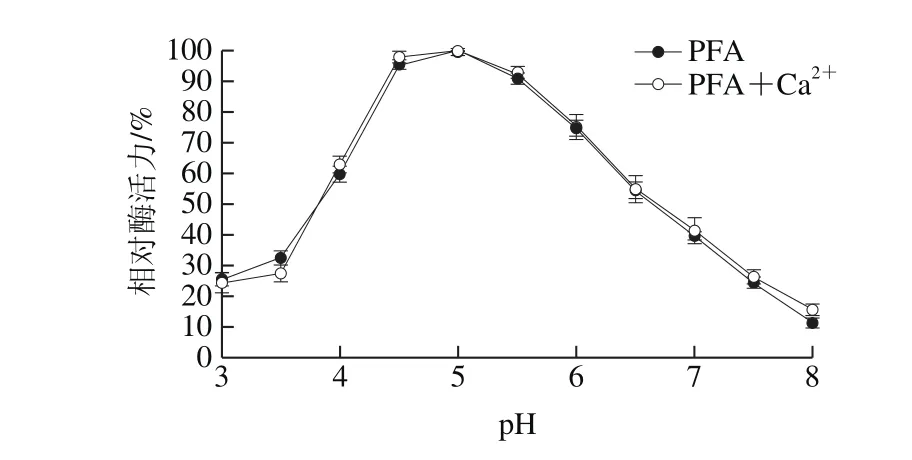
图9 pH值对酶活力的影响Fig. 9 pH dependence of α-amylase activity
如图9所示,对于不含Ca2+和含有5 mmol/L Ca2+的重组α-淀粉酶PFA,最适反应pH值均约为5.0,于pH 4.0~6.0之间可保持60%以上的相对酶活力。即额外添加的Ca2+不影响重组α-淀粉酶PFA的最适反应pH值。
2.5.2 温度对重组α-淀粉酶活力的影响

图10 温度对酶活力的影响Fig. 10 Temperature dependence of α-amylase activity
如图10所示,PFA的最适反应温度为100 ℃,在此温度下的绝对酶活力为3 820.64 U/mg;在额外补加5 mmol/L Ca2+的情况下,PFA的最适反应温度为100 ℃,在此温度下的绝对酶活力为3 860.18 U/mg。此外,在40~130 ℃之间,额外补加的Ca2+几乎不影响PFA的绝对酶活力。
2.5.3 重组α-淀粉酶的热稳定性
如图11所示,在100 ℃条件下,重组α-淀粉酶PFA和含有5 mmol/L Ca2+的重组α-淀粉酶PFA均具有较好的热稳定性,并且两者于100 ℃的热稳定性基本一致。PFA和含有5 mmol/L Ca2+的PFA于100 ℃的半衰期均约为13 h。

图11 100 ℃重组α-淀粉酶的热稳定性Fig. 11 Thermal stability of α-amylases at 100 ℃
3 讨 论
枯草芽孢杆菌是传统的工业生产菌株,具有极强的蛋白质表达和分泌能力[13-14]。将枯草芽孢杆菌表达系统的优点如培养条件和基因操作简单、发酵工艺成熟等与其自身信号肽相结合,构建外源蛋白质的分泌表达系统,可以实现外源蛋白质的分泌表达,从而提高外源蛋白质的可溶性,避免因形成包涵体以及随之而来的复性和产物纯化等困难[13-14]。现有的研究表明来源于枯草芽孢杆菌的信号肽与外源蛋白质之间存在适配性问题[15]。对于同一种外源蛋白质,不同信号肽的引导分泌效率相差较大。因此针对特定的外源蛋白质需要选择合适的信号肽来实现其有效的分泌表达。目前尚无法预测哪种信号肽能够高效引导目的蛋白质分泌到胞外,只能通过实验手段从大量信号肽中筛选得到高效引导目的蛋白质分泌到胞外的信号肽[15]。Guan Chengran等[22]为提高氨基肽酶在枯草芽孢杆菌中的分泌效率,从含有19 种Sec分泌途径的信号肽库中筛选得到信号肽YncM。相对于氨基肽酶自身信号肽,信号肽YncM对氨基肽酶的引导分泌效率提高了1.2 倍。Zhang Weiwei等[23]通过筛选114 种来源于枯草芽孢杆菌的Sec途径信号肽,获得高效引导木聚糖酶分泌至胞外的信号肽PhoB。本研究为探索极端嗜热酸性α-淀粉酶PFA在枯草芽孢杆菌WB600中的高效分泌表达条件,对来源于枯草芽孢杆菌的9 种结构特征不同的Sec分泌途径信号肽进行筛选,并获得引导PFA高效分泌表达的信号肽YfkN。与α-淀粉酶PFA的自身信号肽相比,使用信号肽YfkN后PFA的分泌表达量提高了约10 倍。
信号肽的结构由N端、H段、C端构成,其中N端由1~5 个带正电荷的氨基酸组成、H段由7~15 个疏水性氨基酸组成、C端由3~7 个能被信号肽酶识别并切割的亲水性氨基酸组成[24-25]。研究表明,信号肽的结构如N端带正电荷氨基酸数量、H段疏水性强弱、C端的氨基酸序列均影响信号肽的分泌效率,但并不能完全决定信号肽的分泌效率[24-25]。此外,外源蛋白质的分泌表达效率与多种因素相关,例如连接有不同信号肽的mRNA的稳定性差异、蛋白质前体与细胞膜的结合、蛋白质跨膜过程中所涉及的分子伴侣以及异位复合物的有效性等[24-25]。Caspers等[26]通过研究枯草芽孢杆菌信号肽对来源于Fusarium solanipisi的角质酶在枯草芽孢杆菌中分泌表达的影响发现,信号肽AmyE的N端带正电荷氨基酸数量与其分泌表达效率并无正相关性,角质酶在胞内的合成效率与其分泌至胞外的分泌效率之间的动态平衡是其高效分泌表达的关键。本研究通过对信号肽YfkN的N端中非正电荷氨基酸Ile3和Gln4进行饱和突变,获得了引导分泌效率更优的突变体I3G/Q4R。本研究结果也表明信号肽YfkN的N端带正电荷数量与其引导PFA的分泌效率并无正相关性。
本研究对信号肽YfkN进行突变优化,获得了引导分泌效率更优的信号肽突变体I3G/Q4R。使用了信号肽I3G/Q4R后,重组枯草芽孢杆菌的胞外α-淀粉酶活力高达715 U/mL。相对于α-淀粉酶PFA的自身信号肽,其分泌效率提高了约13 倍。根据前人研究结果,α-淀粉酶PFA已在不同的中温原核表达系统中成功表达。其中,PFA在大肠杆菌表达系统中进行胞内表达,胞内α-淀粉酶活力约为195 U/mL[27-28];PFA在枯草芽孢杆菌表达系统中使用其自身的表达元件进行胞外表达,胞外α-淀粉酶活力约为0.7 U/mL[17];PFA在酵母表达系统中进行胞外表达,胞外α-淀粉酶活力约为220 U/mL[29];PFA在经遗传修饰的解淀粉芽孢杆菌Bacillus amyloliquefaciens中进行胞外表达,胞外α-淀粉酶活力约为2 000 U/mL[30]。本研究在传统工业生产菌株枯草芽孢杆菌中,通过信号肽的筛选和信号肽优化,实现极端嗜热酸性α-淀粉酶PFA的高效分泌表达。本研究所获得的重组枯草芽孢杆菌的胞外α-淀粉酶活力与前人研究结果尚存在一定的差距,接下来工作可以通过优化本研究所获得的重组枯草芽孢杆菌的发酵条件进一步提高胞外α-淀粉酶活力。此外,本研究于枯草芽孢杆菌表达系统中所获得的重组α-淀粉酶PFA的酶学性质与原始菌Pyrococcus furiosus中获得的α-淀粉酶PFA的酶学性质基本一致:最适反应pH值为5.0,最适反应温度为100 ℃,于100 ℃的半衰期长达13 h,并且不依赖于Ca2+。α-淀粉酶PFA的高温活性、热稳定性以及酸性条件下酶活等酶学性质能够满足淀粉液化工艺对α-淀粉酶的要求,在淀粉液化工艺中具有巨大的应用潜力,本研究所获得研究成果为其在淀粉液化工艺中的应用提供了理论支持。
