黄酒酵母HO基因的敲除及其对黄酒发酵的影响
2018-10-08刘双平周志磊邹慧君王宗敏姬中伟许正宏
白 梅,刘双平,3,4,毛 健,4,韩 笑,3,4,周志磊,4,邹慧君,王宗敏,4,姬中伟,4,许正宏*
(1.江南大学生物工程学院,粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.国家黄酒工程技术研究中心,浙江 绍兴 312000;3.江苏省产业技术研究院食品生物技术研究所,如皋江大食品生物技术研究所有限公司,江苏 如皋 226500;4.江南大学食品学院,江苏 无锡 214122)
酿酒酵母作为一种模式真核生物,便于培养和进行遗传操作,产醇高,工业条件耐受性强,为食品安全性微生物[1]。酿酒酵母菌株一般为单倍体或者二倍体,在自然界还存在三倍体。黄酒是中国的特产[2],其命名主要取决于其大多呈黄色。黄酒作为中国的国酒,是以糯米、小麦、小米等为原料,外加麦曲及酒母作为糖化发酵剂,经过蒸煮、糖化发酵、过滤澄清、杀菌等一系列工序制备的一种酿造酒。黄酒属于低度酒,酒度一般在15°左右;其历史悠久、营养丰富、口感醇厚、饮法多样,是酒类中为数不多的保健酒之一;其用途广泛,可用于烹饪、饮料等市场。
我国各地区黄酒在酿造工艺上区别并不是非常明显,但黄酒在中国的地域性很强,其风味随着每个生产地区的不同也表现出相当大的差异,这主要是由于黄酒所特有的口感风味不仅与酿造原料有关系,也与各个生产地区参与黄酒酿造中的微生物群落有关。传统黄酒的魅力在于产区特有的微生物。要酿造出口感醇厚、风味独特、品质稳定的黄酒,就要利用好黄酒酿造过程起作用的微生物,酿酒酵母的乙醇发酵功能被广泛应用于包括黄酒在内的酒饮料行业,其酿造性能的优劣直接影响到黄酒的生产与品质[3-6]。本实验室从工业黄酒发酵醪中筛选出一株黄酒酵母11-1并保藏,用其制作酒母,制作黄酒后,监测其各项生长和发酵指标,发现其发酵能力较优。
对于实验室用标准二倍体酿酒酵母的孢子产生条件,国内外均有报道。孢子的产生获得必须要提供适当的产孢条件,酿酒酵母的营养体在营养缺乏处于饥饿的条件下,进过减数分裂由二倍体变为单倍体,形成子囊[7-11]。已有研究表明,酿酒酵母在麦氏(Mcclary)琼脂培养基上的产孢量最大,产孢效果最好,马铃薯培养基次之,且在培养温度25 ℃时其产孢效率最高[12-13]。因此,本实验决定利用最佳产孢培养基Mcclary培养基,在25 ℃对黄酒酵母11-1进行产孢培养,以期得到黄酒酵母11-1单倍体菌株,Huxley等[14]发现,基于酿酒酵母交配座的差异,可以采用聚合酶链式反应(polymerase chain reaction,PCR)的方法筛选酿酒酵母配型。用可视方法检测酿酒酵母交配型已有报道[15],根据酿酒酵母交配型的稳定性可以将菌株分为两种,即同宗配合型和异宗配合型。异宗配合型菌株的交配型是稳定的,而同宗配合型单倍体菌株的交配型不稳定,能够发生交配型的改变。同宗配合的菌株中带有活性的HO基因,可以使菌株的交配型发生变化[16-17]。本实验室保藏的野生黄酒酵母11-1为二倍体,且HO基因具有活性,其编码的核酸内切酶在MAT基因座能够进行特异性的双链切割,使得孢子接合型发生转变,进而与周围的异型孢子进行结合,重新变为二倍体。杨华军等[1]采用过表达HO基因的方法成功获得了酿酒酵母多倍体,说明HO基因的存在会使酵母的配型发生转变。丁文涛[18]也成功改变了酿酒酵母配型,得到了高乙醇产量的酿酒酵母。
李华等[12]在测定菌株的发酵力实验中,发现单倍体菌株的乙醇发酵力差异较大,推测原因是黄酒酵母的发酵能力由多个基因控制。影响乙醇发酵性能的因素很多,单倍体的细胞生长速度比亲本二倍体的生长速度稍慢,其发酵周期也较长。工业上酿酒酵母大多数为二倍体,但为了更加方便快速地研究酿酒酵母,实验中多采用单倍体菌株。本研究通过基因敲除技术敲除HO基因获得配型稳定的单倍体酵母菌株,并通过群体杂交获得二倍体HO基因缺失型酿酒酵母,并对其发酵能力进行测定[19-21]。研究HO基因的缺失对黄酒酵母发酵生产能力的影响,为下一步更方便、简洁地采用基因手段研究黄酒酵母独有的代谢特性打下了基础,且诱导酵母产孢进而获得单倍体是进行酵母遗传学和育种工作极为重要的一步,它既是黄酒酵母性状遗传所必须的,又可为后续进行杂交作好亲本的准备。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与质粒
黄酒酵母(菌株编号:11-1),由本实验室从黄酒酒厂发酵醪液出筛出并保藏(实验室资源平台号:RWBL Y1502);pSH47-HyBR质粒、pYX212质粒均为实验室保藏。
1.1.2 培养基与试剂
Mcclary培养基:葡萄糖0.1%,KCl 0.18%,NaAc 0.82%,酵母膏0.25%,琼脂2%;pH 7.0。115 ℃灭菌20 min。
YPD培养基:酵母膏1%,蛋白胨2%,葡萄糖2%,琼脂2%;pH 7.0。115 ℃灭菌20 min。
潮霉素、G418、LiAc、PEG3350 上海生物工程有限公司;鲑鱼精DNA 美国Sigma-Aldrich公司;其他试剂均为国产分析纯。
1.2 仪器与设备
DYY-6C型电泳仪 北京六一仪器厂;超净工作台苏州富泰洁净系统有限公司;凝胶成像系统 南京润亚生物科技发展有限公司;可见分光光度计 杭州汇尔仪器设备有限公司;三头梯度PCR仪 江苏舜天国际集团机械进口股份有限公司;移液器 德国Eppendorf公司;SHP-80型生化培养箱、GRP-9080型隔水式恒温培养箱 上海森信实验仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;MICRL17小型离心机 赛默飞世尔科技公司;电子天平 梅特勒-托利多仪器有限公司;恒温摇床 上海合恒仪器设备有限公司。
1.3 方法
1.3.1 HO基因敲除盒的构建

表1 HO基因敲除所用引物[22]Table 1 Primes used in HO gene knockout
HO基因敲除所用引物见表1,HO基因敲除盒构建步骤如下:1)以质粒pYX212为模板,利用引物KAN-1-FW和KAN-2-RV进行PCR扩增,获得的PCR产物为loxpKANloxp,以其扩增产物为模板,利用引物KAN-3-FW和KAN-4-RV进行第2轮扩增,得到带有HO基因互补序列的KANMX。2)以酵母染色体为模板,利用引物HO-1-FW和HO1-1-RV进行PCR扩增,获得的PCR产物为HOL。3)以酵母染色体为模板,利用引物HO-2-RV和HO2-1-FW进行PCR扩增,获得的PCR产物为HOR。4)利用重叠PCR技术将上述3 种PCR产物连接起来,得到HOL-KANMX-HOR,即为HO基因敲除盒。
1.3.2 黄酒酵母11-1醋酸锂转化
利用LiAc转化法[23-24]将得到的HO敲除盒转化进黄酒酵母11-1中,涂布含有G418质量浓度为400 μg/mL的YPD培养基,30 ℃培养2~5 d。将长出的菌落转接至含有G418质量浓度为500 μg/mL的YPD培养基,30 ℃培养2 d后排除没有生长的假阳性菌落,再转接至含有G418质量浓度为500 μg/mL的YPD培养基,30 ℃培养2 d后进行PCR验证。
1.3.3 G418抗性的删除
本实验室保藏的pSH47-HyBR质粒是带有Cre重组酶基因以及潮霉素B抗性的质粒,将其转化进重组菌(HO::loxpG418)并表达,即可实现对抗性的删除,得到HOΔ。
将重组质粒pSH47-HyBR通过醋酸锂转化法转化进入重组菌(HO::loxpG418)感受态细胞中,转化后的酵母涂布在含潮霉素B 600 μg/mL的YPD筛选平板上,30 ℃培养2~3 d,挑取转化子。将转化子划线在含潮霉素B 800 μg/mL的YPD平板上培养48 h,挑选转化子进行菌落PCR验证[25]。
1.3.4 黄酒酵母单倍体的分离
HO基因敲除后需要对黄酒酵母11-1进行产孢分离,以得到a型和α型单倍体用于后续基因操作。挑取黄酒酵母11-1 HOΔ单菌落接种于YPD液体培养基中,30 ℃、200 r/min过夜培养。用无菌超纯水将菌体洗净,涂布产孢培养基Mcclary,26 ℃培养5~7 d。待酵母菌落长出后刮取至含有蜗牛酶的1.5 mL EP管中,30 ℃水浴60 min。将菌液移至含有少许玻璃珠和10 mL 0.9% NaCl溶液的100 mL三角瓶中,60 ℃水浴10 min后放入30 ℃培养箱200 r/min培养1 h[9-12]。活化结束后将菌体洗涤干净,稀释涂布YPD固体培养基,30 ℃培养48 h,挑取形态较小的单菌落进行PCR验证。
1.3.5 二倍体黄酒酵母11-1-HOΔ工程菌的获得
将两种接合型(a型和α型)的单倍体菌株分别接种于5 mL的YPD液体培养基中,30 ℃、200 r/min摇床培养24 h,然后各取0.5 mL的上述菌液接种于装有20 mL YPD液体培养基的250 mL三角瓶中,30 ℃、200 r/min摇床培养48 h。去除上清液获得菌体沉淀,用无菌水洗涤2 次后,最终悬浮于10 mL的无菌水中,将悬浮液适当稀释,取100 μL菌液涂布于YPD平板,30 ℃培养2~5 d待菌落长出。使用引物MAT/MAT-a/MAT-α进行PCR鉴定[26]。
1.3.6 发酵特性分析[27-30]
采用以下黄酒酿制工艺流程制作黄酒:

关键控制点:1)蒸米:置于电磁炉上蒸熟至米里外一致、无白心为止;2)冷却落缸:将蒸好的米冷却至室温,分别按照要求拌入一定量的麦曲、酒母,落料品温要求在26~28 ℃;3)糖化发酵:于28~30 ℃前酵5 d,再于14~16 ℃后酵15 d左右;4)压榨:将发酵好的糙米酒醪通过真空抽滤器使酒液与酒糟分离;5)煎酒:于92~93 ℃煎酒20~30 min后趁热灌装、封坛,即为成品。
分别使用野生黄酒酵母11-1和黄酒酵母11-1-HOΔ作为酒母用于黄酒发酵。分别取发酵第24、48、96、360、480小时的样品,测量黄酒基本理化指标。黄酒发酵过程中各项指标按照GB/T 13662—2008《黄酒》执行。所有实验数据进行3 次测定,运用Origin 9.0软件进行计算。
2 结果与分析
2.1 黄酒酵母11-1单倍体的获得
2.1.1 HO基因的敲除
利用HO-1-FW和HO-2-RV引物对,以黄酒酵母11-1染色体作为模板进行PCR扩增,野生型菌株经扩增后将得到1 953 bp大小的产物,而HO敲除盒的扩增产物大小为2 632 bp。由图1可以看到,1号泳道PCR产物在2 000~3 000 bp之间,经过多轮扩增,成功得到了HO敲除盒。

图1 HO敲除盒验证Fig. 1 Agarose gel electrophoresis of PCR products was used to test the modified HO gene
如方法1.3.2节描述,采用醋酸锂转化法敲除HO基因。PCR鉴定结果如图2所示。
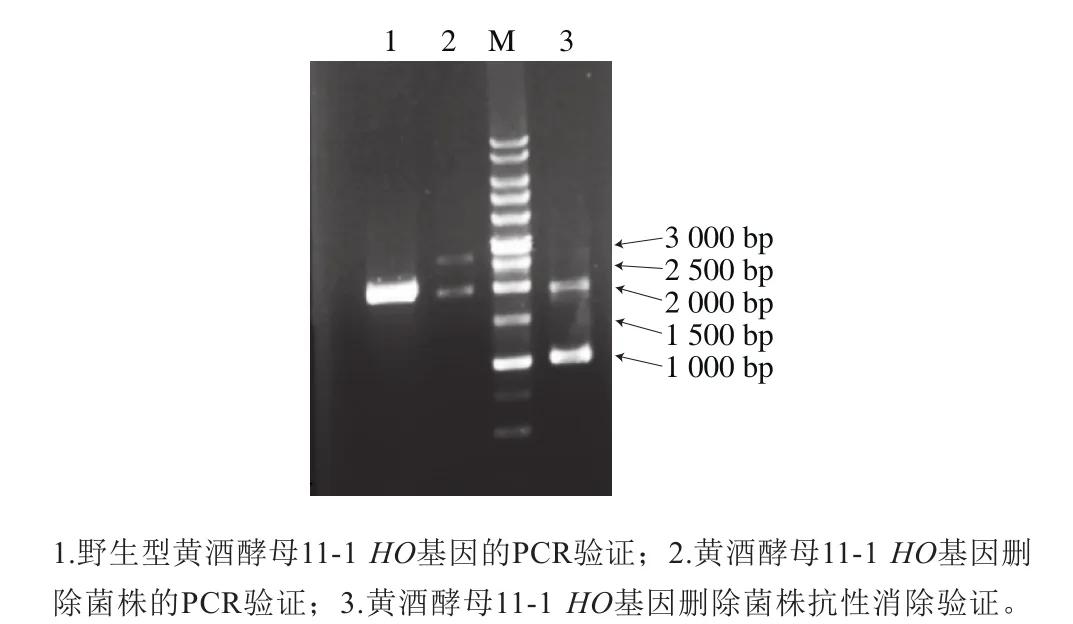
图2 黄酒酵母11-1酵母HO基因敲除验证Fig. 2 Agarose gel electrophoresis of PCR product was used to test the deletion of HO
2.1.2 G418抗性的删除
由于在构建重组菌黄酒酵母11-1(HO::loxpG418)时引入了G418抗性基因,使得以后在对重组菌黄酒酵母11-1进行基因改造时无法再使用此抗性作为筛选标记,虽然没有明显证据表明该基因的表达会给酿酒酵母的代谢带来负担,但抗性基因在酵母中表达的产物并没有实用价值,造成了抗生素的浪费。因此,在构建敲除盒时即在G418抗性标记的两端加入了Cre重组酶识别位点loxp,通过表达Cre重组酶可以将敲除盒中的loxpG418删除。本实验室保藏的pSH47-HyBR质粒是带有Cre重组酶基因以及潮霉素B抗性的质粒,将其转化进重组菌(HO::loxpG418)并表达,即可实现对抗性的删除,得到HOΔ。
如图2所示,利用HO-1-FW和HO-2-RV引物对,以黄酒酵母11-1染色体作为模板进行PCR扩增,野生型菌株经扩增后得到1 953 bp大小的产物(泳道1),HO敲除盒同源整合到酵母染色体上的扩增产物大小为2 632 bp左右(泳道2),而Cre重组酶将敲除盒上的loxpG418删除后可以扩增到1 028 bp左右的条带(泳道3),证明抗性标记基因G418已被成功删除。
2.1.3 黄酒酵母单倍体的分离及接合型鉴定
以酵母染色体基因组为模板,利用F-FW和A-RV、F-FW和α-RV两对引物对同时进行PCR扩增。若所扩增酵母为a型单倍体则仅可得到F-FW和A-RV扩增出的544 bp片段,无法得到F-FW和α-RV扩增片段;若所扩增酵母为α型单倍体,则仅可得到F-FW和α-RV扩增出的404 bp片段,无法得到F-FW和A-RV扩增片段;若所扩增酵母为二倍体,则两对引物对的扩增片段均可获得。如图3A所示,泳道2、3验证的酵母菌为α型单倍体,如图3B所示,泳道2、3验证的酵母菌为a型单倍体,由此成功得到了黄酒酵母11-1的a型HOΔ和α型HOΔ单倍体,可用于酵母遗传学以及其他代谢途径上的操作。
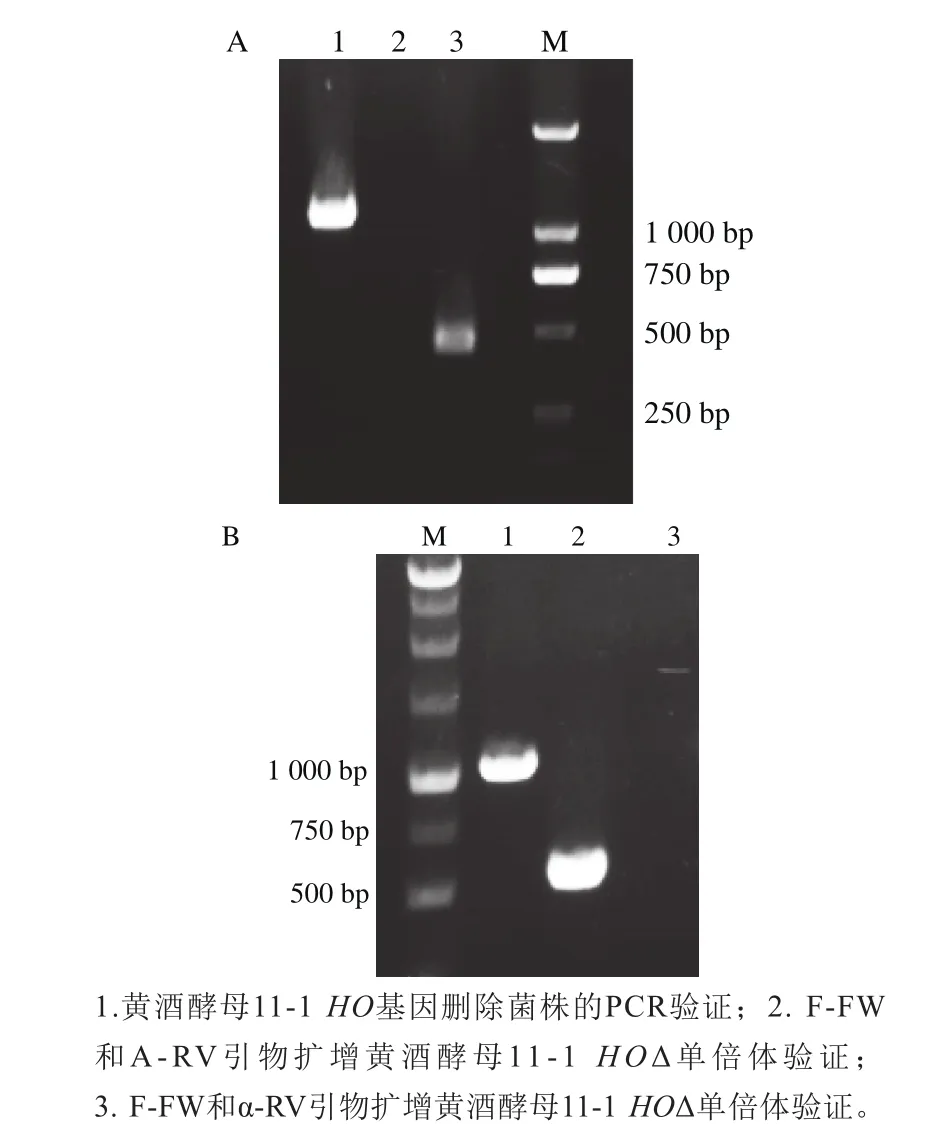
图3 黄酒酵母11-1的α型(A)和a型(B)单倍体的PCR验证Fig. 3 Agarose gel electrophoresis of PCR product was used to test the mating type of haploid S. cereviase strains
2.2 二倍体黄酒酵母11-1-HOΔ工程菌的获得
2.2.1 二倍体黄酒酵母11-1-HOΔ工程菌的验证
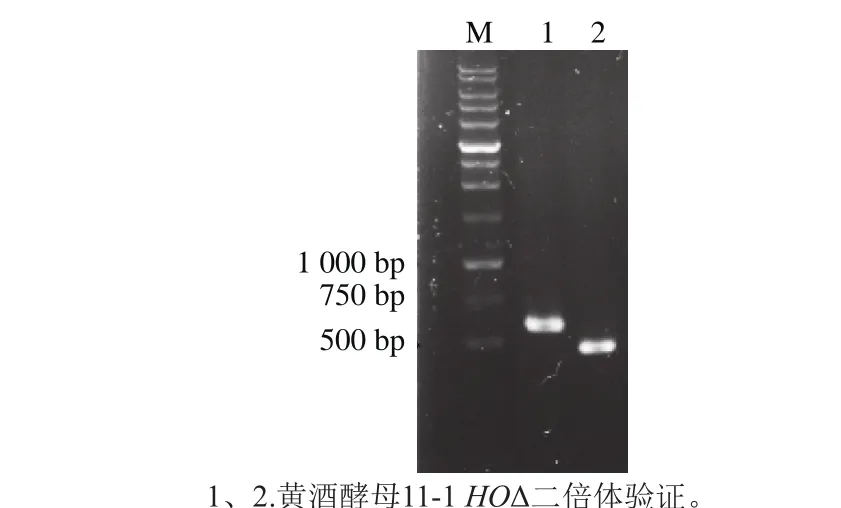
图4 二倍体黄酒酵母11-1-HOΔ的PCR验证Fig. 4 Agarose gel electrophoresis of PCR product was used to test the mating type of diploid S. cereviase strains
采用1.3.5节方法,将两种接合型(a型和α型)的单倍体菌株进行群体杂交获得二倍体黄酒酵母11-1-HOΔ工程菌,长出菌落使用引物MAT/MAT-a/MAT-α进行PCR鉴定,结果见图4。
2.2.2 二倍体黄酒酵母11-1-HOΔ工程菌的产孢镜检结果

图5 野生型黄酒酵母11-1(A)和 黄酒酵母11-1-HOΔ(B)的生孢镜检(10×40)Fig. 5 Microscopic observation of spores of wild (A) and HO disrupted (B) yeasts grown on Mcclaryc plates (10 × 40)
如图5所示,将黄酒酵母11-1-HOΔ在Mcclary培养基上进行培养,显微镜观察子囊孢子野生型与黄酒酵母11-1-HOΔ并无异常,说明HO基因的缺失对酿酒酵母的生孢能力是没有影响的。
2.3 黄酒发酵液特性分析
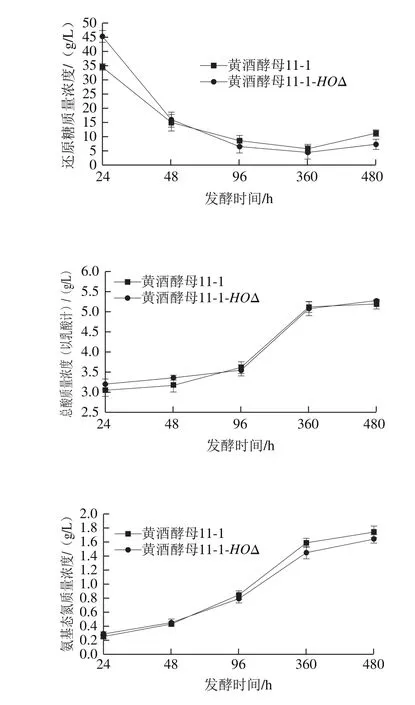
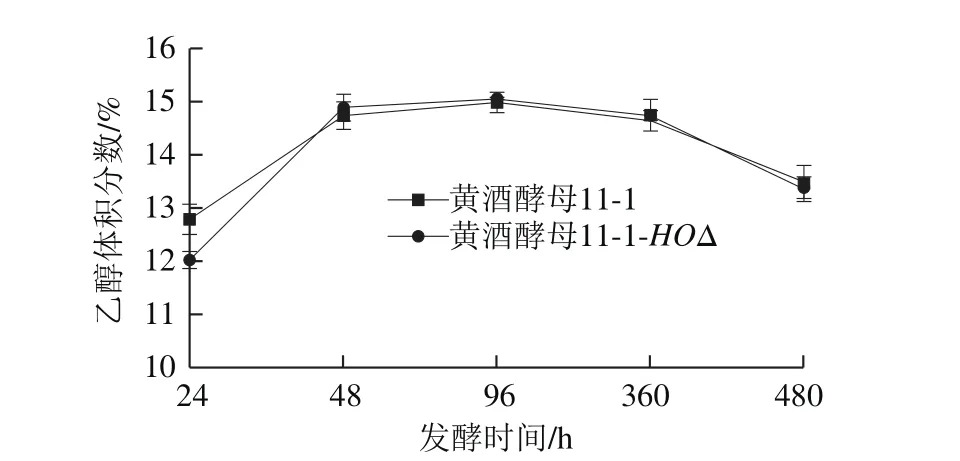
图6 黄酒发酵液理化指标的测定Fig. 6 Physicochemical properties of Chinese rice wine samples fermented by different strains
将野生型黄酒酵母11-1和改造后的黄酒酵母11-1-HOΔ制作酒母,采用黄酒工艺制作黄酒,分别取发酵第24、48、96、360、480小时的酒样,对其还原糖、总酸、氨基酸态氮、乙醇体积分数进行检测。如图6所示,因为黄酒为好氧发酵,在发酵前期的时候由于发酵体系不稳定,数值稍有波动,但到前酵结束黄酒发酵后期,发现野生型黄酒酵母11-1和黄酒酵母11-1-HOΔ之间黄酒发酵液常规理化指标差异并不大。
3 结 论
本实验通过用醋酸锂转化法敲除黄酒酵母11-1的HO基因,利用Cre/loxp系统除去引进HO敲除基因框所带进的抗性基因KanMX,获得不含外源抗性基因且不能发生接合型转变的黄酒酵母11-1单倍体菌株(a型和α型),然后通过群体杂交最终得到了二倍体黄酒酵母11-1-HOΔ,根据实验结果可知,黄酒酵母11-1野生型酵母菌和黄酒酵母11-1-HOΔ两者之间的发酵能力并无差异,HO基因的缺失不会对黄酒发酵生产过程产生影响。获得的配型稳定的黄酒酵母单倍体菌株可用于后续的基因改造,研究黄酒酵母的遗传和代谢特性;同时单倍体菌株具有接合能力,也可进一步杂交育种,获得性能优良的酿酒酵母用于工业生产中,对维护和提升生产企业的经济效益具有十分重要的意义。
