非小细胞肺癌患者血清骨膜蛋白水平对化疗效果的评估价值
2018-10-08张建勇敬秀清孙铭强袁瑛
张建勇 敬秀清 孙铭强 袁瑛
非小细胞性肺癌(non-small cell lung cancer,NSCLC)由于缺乏典型的临床表现和特异的诊断手段,难以早期发现,病死率极高[1]。随着研究的不断深入,近年来NSCLC的治疗手段不断改进,尤其是出现了针对表皮生长因子受体及间变性淋巴瘤激酶等敏感位点基因突变的相关治疗[2]。铂类双重化疗方案是目前临床上治疗NSCLC的基础方案,但是采用该方案后NSCLC患者的生存率依然<15%[3]。目前临床上主要采用影像学检查结果评价NSCLC的化疗效果,但是影像学诊断对微小病灶或早期转移肿瘤的灵敏度极低。而通过分析NSCLC患者组织中的特异性肿瘤标志物来评价化疗效果和预测临床预后更加可行。骨膜蛋白属于细胞外基质糖蛋白,在结肠癌、卵巢癌、乳腺癌和前列腺癌等多种癌组织中可检测到骨膜蛋白的蛋白和mRNA水平明显升高[4-6]。已有研究发现NSCLC患者血清骨膜蛋白水平明显升高,且与不良预后密切相关[7]。目前对于NSCLC患者化疗前后骨膜蛋白水平变化及与临床预后关系的研究报道极少,故本研究探讨了110例NSCLC患者化疗前后血清骨膜蛋白水平变化及与临床预后的关系。
1 对象和方法
1.1 对象 连续性纳入2011年1月至2012年3月本院收治的110例NSCLC患者(NSCLC组)、64例肺部良性病变患者(良性组)和60例健康体检志愿者(对照组)。NSCLC组男74例,女36例;年龄<65岁69例,≥65岁41例;肿瘤类型:腺癌66例,鳞癌35例,大细胞癌6例,其他3例;TNM分期:Ⅲa~Ⅲb期22例,Ⅳ期88例;发生骨转移38例;初始化疗方案:顺铂+紫杉醇92例,顺铂+吉西他滨18例;化疗效果:有效44例,无效66例。纳入标准:(1)年龄 18~80 岁;(2)NSCLC 患者临床分期为Ⅲ~Ⅳ期,有细胞学或组织学诊断依据;(3)NSCLC患者入组前未接受过相关化疗,入组后需要接收至少2个疗程的化疗;(4)均签署知情同意书。排除标准:(1)合并其他肿瘤;(2)合并严重心、肝、肾功能不全;(3)孕产妇。本研究经医学伦理委员会审查通过。
1.2 NSCLC化疗方案及疗效判断标准 所有NSCLC患者均予至少2个疗程的基础铂类化疗方案,其中92例为顺铂+紫杉醇,18例为顺铂+吉西他滨。依据实体肿瘤反应评估标准评价化疗效果:所有靶病灶消失、无新病灶出现,且肿瘤标志物正常,至少维持4周为“完全缓解”;靶病灶最大径之和减少≥30%,至少维持4周为“部分缓解”;靶病灶最大径之和减少但未达到部分缓解,或增加但未达到疾病进展为“疾病稳定”;靶病灶最大径之和增加≥20%,或出现新病灶为“疾病进展”。完全缓解、部分缓解为有效,病情稳定、病情进展为无效。
1.3 血清骨膜蛋白检测 在所有患者入院时、NSCLC患者化疗结束后1d抽取清晨空腹肘静脉血约15ml,4℃、3 000r/min离心30min,取上清液置于-80℃冰箱中储存待检。使用ELISA试剂盒(默沙克,KT99471)检测血清骨膜蛋白水平。
1.4 统计学处理 应用SPSS 22.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;两组间比较采用独立样本t检验,治疗前后比较采用配对样本t检验。利用ROC曲线分析入院时、化疗结束后1d血清骨膜蛋白水平及两者差值(△血清骨膜蛋白水平)诊断NSCLC及评估化疗有效的效能。入院时、化疗结束后1d血清骨膜蛋白水平与NSCLC化疗有效性的关系分析采用Pearson相关,△血清骨膜蛋白水平与NSCLC化疗有效性的关系分析采用Spearman相关。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者化疗前血清骨膜蛋白水平比较 入院时NSCLC组、良性组、对照组患者血清骨膜蛋白水平分别为(515.6±76.9)、(385.6±34.5)、(247.5±45.3)ng/ml,差异有统计学意义(F=4.04,P<0.05),NSCLC组分别高于良性组、对照组(均P<0.05)。
2.2 NSCLC患者化疗前后血清骨膜蛋白水平比较NSCLC患者化疗结束后1d血清骨膜蛋白水平为(453.2±72.8)ng/ml,明显低于入院时的(515.6±76.9)ng/ml,差异有统计学意义(t=6.18,P<0.05)。其中有效组与无效组入院时血清骨膜蛋白水平比较,差异无统计学意义(P>0.05),化疗结束后1d两组患者血清骨膜蛋白水平均有所降低,有效组明显低于无效组(P<0.05),见表1。
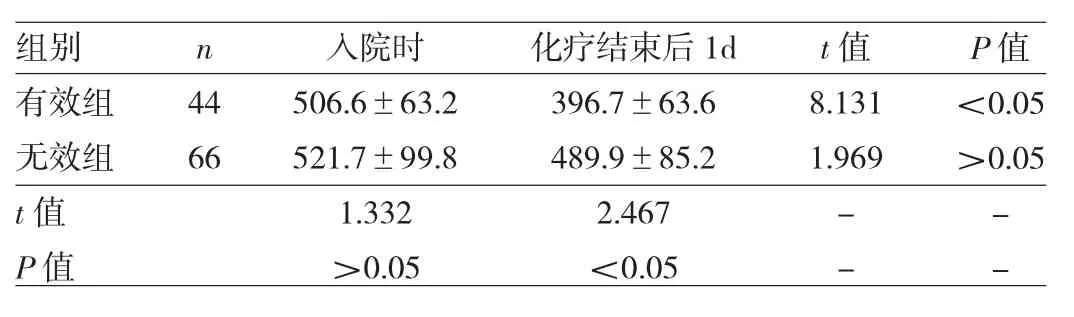
表1 NSCLC患者化疗有效组与无效组血清骨膜蛋白水平比较(ng/ml)
2.3 血清骨膜蛋白水平诊断NSCLC及评估化疗有效的效能分析 110例NSCLC患者入院时血清骨膜蛋白水平诊断NSCLC的截断点为535.2ng/ml,灵敏度为0.82,特异度为0.80,ROC曲线见图1;其AUC及95%CI为0.821(0.784~0.867)。入院时血清骨膜蛋白水平评估化疗有效的截断点为573.9ng/ml,灵敏度为0.68,特异度为0.73,其 AUC 及 95%CI为 0.648(0.603~0.692);化疗结束后1d时血清骨膜蛋白水平评估化疗有效的截断点为332.9ng/ml,灵敏度为0.76,特异度为0.71,其AUC及95%CI为 0.723(0.656~0.785);△血清骨膜蛋白水平评估化疗有效的截断点为109.8ng/ml,灵敏度为0.85,特异度为0.81,其AUC及 95%CI为 0.846(0.801~0.896),ROC曲线见图2。
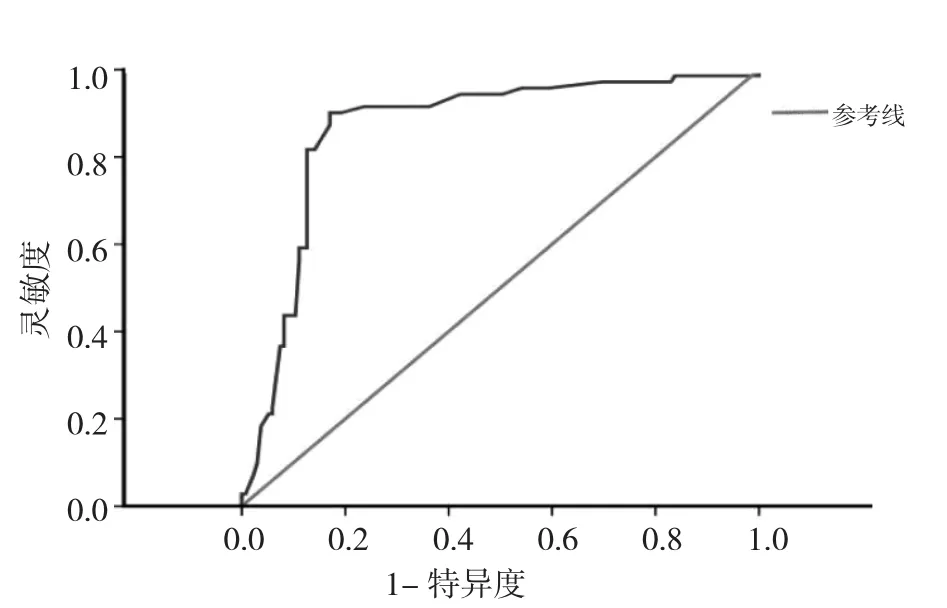
图1 NSCLC患者血清骨膜蛋白水平诊断的ROC曲线
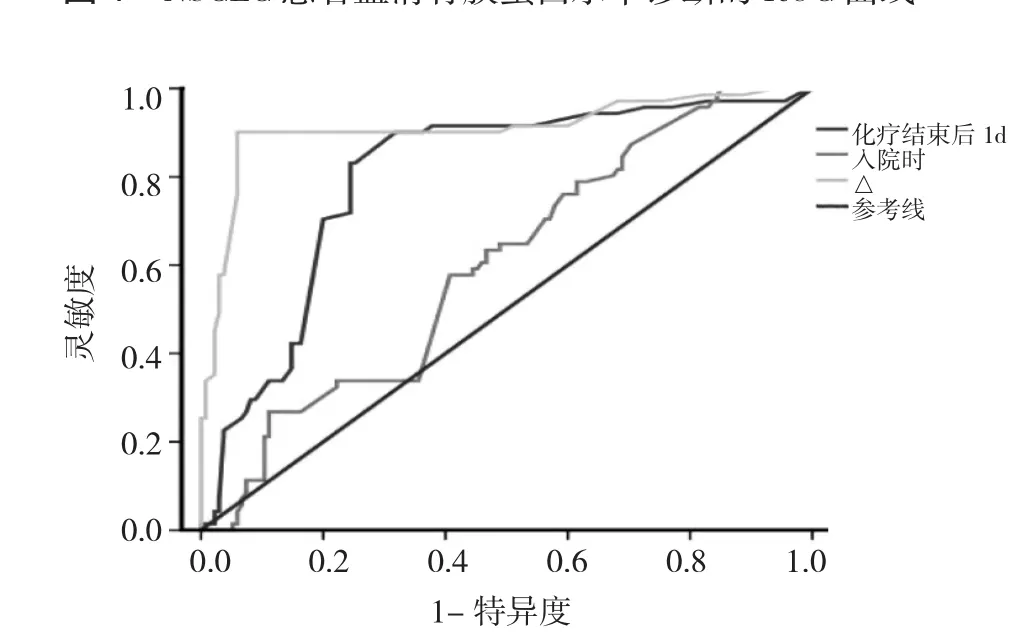
图2 NSCLC患者血清骨膜蛋白水平评估化疗有效的ROC曲线
2.4 血清骨膜蛋白水平与NSCLC和化疗效果的相关性 入院时血清骨膜蛋白水平与NSCLC诊断呈正相关(r=0.633,P<0.05)。入院时血清骨膜蛋白水平与NSCLC化疗有效呈负相关(r=-0.544,P<0.05),化疗结束后1d血清骨膜蛋白水平与NSCLC化疗有效呈正相关(r=0.594,P<0.05),△血清骨膜蛋白水平与NSCLC化疗有效呈正相关(r=0.699,P<0.05)。
3 讨论
肿瘤相关微环境改变在肿瘤细胞的发生、发展过程中十分重要。肿瘤细胞与细胞外基质之间相互作用,从而形成有利于肿瘤生长的微环境[8]。本研究以血清骨膜蛋白水平为切入点,发现其可作为NSCLC特异性标志物,同时帮助评估化疗效果。
骨膜蛋白最早发现于小鼠的成骨细胞中。它作为细胞外基质蛋白,可以调节细胞黏附及成骨细胞的增殖、分化[9]。骨膜蛋白还可以联合Ⅰ型胶原蛋白、纤维连接蛋白、粘合素等其他细胞外基质蛋白来参与细胞间的黏附作用[10]。相关文献证实骨膜蛋白参与多种恶性肿瘤的病理、生理学发展过程;相关动物及细胞实验证实骨膜蛋白通过稳定肿瘤干细胞来促进肿瘤细胞的存活,避免被巨噬细胞吞噬、上皮细胞-间充质转化等,从而促进肿瘤的生长[11-13]。本文纳入110例NSCLC患者、64例肺部良性病变患者和60例健康体检志愿者,并比较3组患者入院时血清骨膜蛋白水平,发现NSCLC患者明显高于肺部良性病变者、健康体检志愿者。邵吉宝等[14]对102例NSCLC患者、40例肺部良性疾病患者和35例健康对照者进行比较,发现NSCLC患者血清骨膜蛋白水平明显高于健康对照者和良性肺部疾病者,NSCLCⅢ/Ⅳ期患者血清骨膜蛋白水平明显高于Ⅰ/Ⅱ期患者,有转移、术后1年内复发的患者血清骨膜蛋白水平分别高于无转移、无复发的患者,提示NSCLC患者血清骨膜蛋白水平可能成为预测肿瘤转移和术后复发的一项指标。Che等[15]也报道过类似内容。本研究结果与上述研究基本相符,但未发现骨转移患者血清骨膜蛋白水平明显增加,可能与本研究纳入对象均为Ⅲ/Ⅳ期NSCLC患者有关。目前关于NSCLC患者血清骨膜蛋白水平与发生骨转移的关系尚存争议,有研究证实骨膜蛋白能促进肿瘤细胞黏附骨组织表面,但乳腺癌骨转移患者血清骨膜蛋白水平变化较NSCLC骨转移患者更为明显[16];提示在NSCLC患者中,这种关系似乎没有那么明显。骨膜蛋白是一种独特且高度保守的细胞外基质蛋白,与昆虫轴突导向蛋白成束蛋白1具有高度同源性,与骨膜素样因子等蛋白分子同属于成束蛋白家族,在细胞黏附和转移过程中具有重要作用[17]。研究发现,NSCLC患者手术切除肿瘤后血清骨膜蛋白水平明显下降[18],这说明有效的治疗干预有助于降低循环中骨膜蛋白水平。而本研究从化疗效果方面,比较了NSCLC患者化疗有效与无效患者之间血清骨膜蛋白水平,结果发现NSCLC化疗有效组化疗结束后1d血清骨膜蛋白水平明显下降,ROC曲线提示△血清骨膜蛋白水平有助于评估化疗效果,相关性分析结果提示△血清骨膜蛋白水平与化疗有效呈正相关。
综上所述,NSCLC患者血清骨膜蛋白水平明显升高;而血清骨膜蛋白水平明显下降可能是NSCLC患者化疗有效的标志之一。
