家族性高胆固醇血症诊治进展
2018-09-28郭凤静张大庆
郭凤静,张大庆
0 引言
家族性高胆固醇血症(Familial hypercholesterolemia,FH)是一种遗传性疾病,多为常染色体显性遗传,是导致早发冠心病的一个重要病因。低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol,LDL-c)显著升高作为FH的主要特征,大幅度增加了动脉粥样硬化性心血管疾病(Atherosclerosis cardiovascular disease,ASCVD)的发生风险。FH分为纯合子型家族性高胆固醇血症(HoFH)和杂合子型家族性高胆固醇血症(HeFH),其发病率、临床表现、心血管风险、对治疗的反应均具有较大异质性[1]。最新数据显示,HoFH发病率为1/300 000~1/160 000,HeFH则较为普遍,其发病率为1/300~1/200[2]。目前,2个大规模人群研究 (83 241例)显示,儿童中FH的发病率高达1.3‰~4.8‰[3]。LDL-c升高的程度在HeFH患者中平均为正常人的2倍,而在HoFH患者则可达4倍以上,过高的LDL-c基线水平,使FH患者LDL-c治疗达标存在困难[4-5]。临床上HoFH患者的临床表现极为严重,其中不能及时发现并加以治疗的HoFH患者在30岁之前即可死于ASCVD,而HeFH患者由于只携带1条致病基因,临床表现通常较HoFH患者轻,但未得到治疗的HeFH患者,其心血管风险仍明显升高[6]。然而,目前国内外对于FH的诊断及治疗认识仍远远不足,多数FH患者在发生首次冠脉事件后才开始获得诊治,导致其预后不佳[7]。因此,对于FH患者,进行早期诊断、早期干预有助于改善预后。
1 FH的发病机制
FH根据遗传方式差异可分为常染色体显性遗传及常染色体隐性遗传。目前研究显示,常染色体显性遗传致病基因突变主要为指导编码低密度脂蛋白受体(Low-density lipoprotein receptor,LDLR)、载脂蛋白B(Apolipoprotein B,apoB)及前蛋白转化酶枯草溶菌素9 (Proprotein convertase subtilisin/kexin type 9,PCSK9);常染色体隐性遗传的主要致病基因为指导编码LDLR衔接蛋白1(LDLRAPl)的基因[8-9]。这些致病基因中,以LDLR基因突变最为常见,运输内源性胆固醇(约占体内总胆固醇的75%)的主要载体是低密度脂蛋白,而其70%主要通过肝细胞膜上的LDLR清除[10],当编码LDLR的基因突变,体内LDL-c浓度升高并在体内蓄积,即为FH,显著增加冠心病的风险。基于希腊人群的研究[11]显示,目前有41个LDLR 缺陷基因被明确,其中c.1 646G>A (p.Gly546Asp),c.858C>A (p.Ser286Arg)、c.81C>G (p.Cys27Trp)、c.1 285G>A (p.Val 429Met)、c.517T>C (p.Cys173Arg)、和c.1 775G>A (p.Gly592Glu)这6个常见突变位点大约占所有突变的80%以上。Chiou等[12]基于我国汉族人群的研究,共发现143个不同的LDLR突变位点,包括134个点突变,9个大的重组。在被研究的46个点突变基因中,最常见的5个突变位点为LDLR 986G>A、1 747C>T、1 879G>A、68G>A和apoB 10 579C>T。
FH患者的LDL-c水平受基因突变、微效基因变异、表观遗传学、饮食习惯等多种因素影响[13],其基因型与表型并非完全一致,因此不能简单地依据LDL-c的水平来确诊FH的类型。部分HeFH患者的LDL-c水平可达到HoFH患者的LDL-c水平(>10~13 mmol/L),有些HoFH患者的LDL-c水平与HeFH相似(5~10 mmol/L)[14-15]。有研究显示,临床上诊断明确的FH患者,基因检测结果为阴性的仍有30%[16],因此,目前基因检测阴性,不能排除FH的诊断;而Huijgen等[17]报道,受修饰基因及非基因因素的影响,某些存在突变基因的患者,其血浆LDL-c水平并不升高。虽然目前基因诊断已被多个FH诊治指南纳为诊断依据,其可提高FH患者诊断的可靠性,有助于早期识别出FH患者,指导治疗药物的选择,为FH诊断与治疗提供线索[18]。但FH患者基因型与表型的不完全平行,一定程度上增加了诊断的复杂性,加之基因检测过程复杂、费用较高等多方面因素,所以,目前FH的临床诊断仍主要依赖于LDL-c水平升高结合临床表现。目前,将遗传学筛查用于FH普查及评估心血管疾病风险尚不合适,确诊FH新病例最具成本效益的方法是对已经确诊的FH患者近亲应用临床或基因诊断技术进行级联筛查[6]。
2 临床表现
FH患者以LDL-c水平显著升高、广泛的皮肤黄色瘤以及早发冠心病为主要临床特征,HoFH患者的临床表现整体较HeFH患者更为严重。而HeFH患者的临床表现差异很大,严重的可表现为早发冠心病,轻者晚年才引起冠状动脉疾病甚至无症状[10]。
2.1 血浆LDL-c水平显著增高 有研究显示,HeFH和HoFH患者的血浆总胆固醇(TC)及LDL-c浓度分别约为血脂正常成人的2倍和4倍[4,19],HeFH患者LDL-c水平通常>4.9 mmol/L,HoFH患者LDL-c水平>10 mmol/L。在儿童和青少年时期,显著增高的LDL-c水平(一般超过4.9 mmol/L),可能是临床识别FH的主要线索[10],目前国际上已有的各项FH诊断标准均将LDL-c水平增高作为主要诊断指标之一。2016年,国人HeFH患者的LDL-c基线水平较2005年明显升高0.9 mmol/L (6.0 mmol/L vs. 5.1 mmol/L,P<0.01)[12],因此,FH 初筛的LDL-c 水平定在6.0 mmol/L 以上,可提高筛查阳性率。
2.2 皮肤肌腱黄色瘤及角膜弓 随着年龄的增长,LDL-c持续升高,胆固醇在组织内沉积逐渐引起临床征象,包括皮肤肌腱黄色瘤及角膜弓,对于FH的临床诊断具有重要意义。胆固醇沉积于膝下或肘部可形成结节状黄色瘤;沉积于眼睑处称为扁平状黄色瘤;沉积在肌腱是FH的特有表现肌腱黄色瘤,多发于手部伸肌腱和跟腱。HoFH患者的临床诊断:一般基于10岁之前即出现皮肤黄色瘤,且多发于拇指与食指之间的指间黄色瘤通常高度提示HoFH(图1)[4]。然而,在FH确诊的患者中未发现黄色瘤的可达20%~30%,因此,无黄色瘤的患者也不能完全除外FH[20]。类脂质在角膜周边部基质内环形沉着形成角膜弓,且虹膜上多可见发白的褪色点(图2)。有研究显示,31~35岁的FH患者中有50%存在角膜弓,而健康人群到41~45岁时出现角膜弓者可达50%[21]。
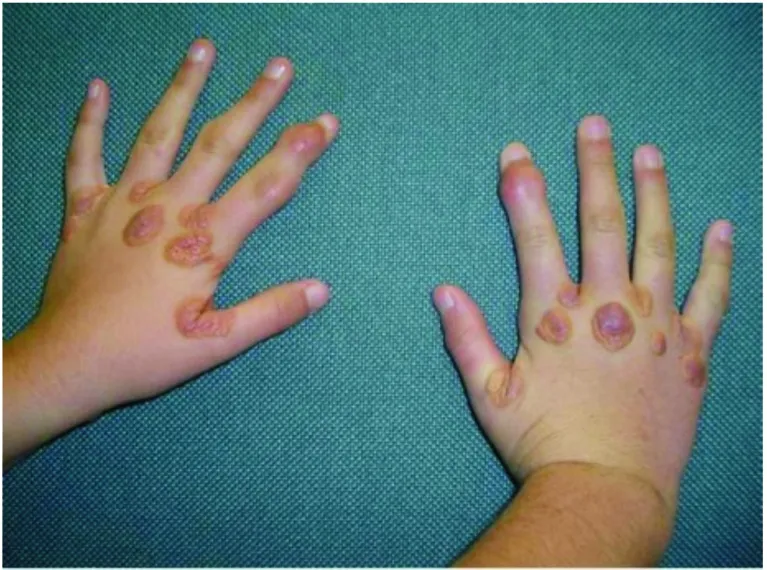
图1 指间黄色瘤[10]
2.3 早发冠心病及瓣膜病 循环中过度升高的胆固醇主要沉积于动脉血管壁及瓣膜组织,从而引起动脉粥样硬化病变及瓣膜狭窄[4]。
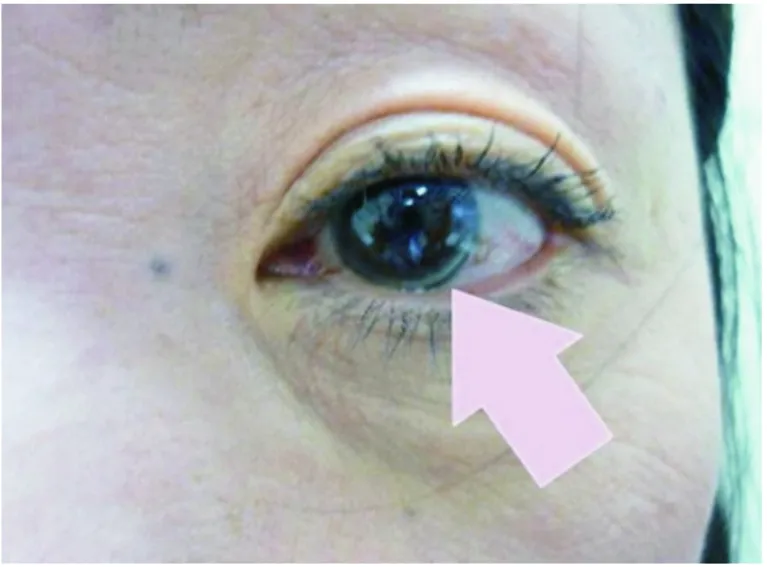
图2 角膜弓[19]
对于HeFH患者, 有研究提出, 其可使早发冠心病风险增加3~13倍[22]。8~10岁年龄段FH儿童颈动脉超声结果显示,颈动脉内膜中层厚度显著增加,磁共振成像可观察到主动脉壁病变,约有25%的青少年可检出冠状动脉硬化[23]。成年HeFH患者心血管事件最早可发生于30岁,主要表现为心绞痛与早发心肌梗死[4]。血浆脂蛋白(α)水平独立于LDLR基因突变类型,当升高超过50 mg/dl (75 nmol/L)时,是影响FH患者未来心血管风险的危险因素[24]。对于HoFH患者,未经治疗的HoFH患者由于LDLR缺失,导致LDL-c水平显著升高,使早发冠心病风险增加100倍,在10~20岁即可出现临床症状[22]。研究显示,LDLR残余活性决定FH患者对药物治疗的反应和患者的预后:当LDLR残余活性低于2%时,一般活不过20岁;残余活性在2%~25%,预后略有改善,30岁时仍会有严重的冠心病和主动脉瓣疾病[10]。FH患者发生早死的原因主要为严重的冠状动脉硬化,但严重的主动脉瓣及瓣上狭窄,同样也威胁FH患者生命,降胆固醇治疗缓解主动脉瓣狭窄的疗效有限,一般年轻HoFH患者通常需要主动脉瓣置换[25]。
3 诊断原则
目前,各国应用的FH诊断标准各有利弊,且尚没有哪一种诊断标准被国际公认,其中英国的Simion Broome(SBR)诊断标准[26]和荷兰的DLCN标准[27]较为常用,见表1、表2。两者各有优缺点,SBR标准简单,记忆方便,应用广泛,且可用于儿童FH的诊断。同时,SBR标准采用传统的指标、血脂分析及病史诊断FH,经济可行,通过SBR诊断为FH或疑似FH的可进一步通过分子检测确诊。但其也存在明显不足,易对那些临床症状较轻和未出现临床表现的儿童人群造成漏诊。DLCN标准采用评分系统,充分考虑家族史,体格检查及基因缺陷等多个方面因素,一定程度上减少漏诊率。但DLCN标准不适用于儿童FH的诊断,且其诊断需要较多的检查,检测分子水平缺陷费用较高,使其在基层医院的应用受到限制。
我国目前尚无规范的FH诊断标准,由于各国人群的血脂特点不同,SBR标准和DLCN标准并不完全适于我国人群。目前我国大多采用如下标准:成人TC>7.8 mmol/L,或者LDL-c>4.9 mmol/L,儿童TC>6.7 mmol/L以及患者或亲属中有黄色瘤可诊断为FH;其中TC>16.0 mmol/L伴有黄色瘤时,诊断为HoFH;未达到纯合子FH标准的诊断为HeFH[28]。
由于各国LDL-c水平基数不一致,亚洲国家较西方国家LDL-c水平低,所以目前诊断标准均存在偏移,儿童患者的诊断需要根据各国特定的LDL-c水平进行调整,还应排除继发性高脂血症。考虑FH诊断中存在以上诸多问题,2015年美国心脏病协会关于家族性高胆固醇血症的科学声明中[10]推荐了一个简便的FH临床分类标准,此分类标准基于临床诊断联合遗传学检测,儿童 LDL-c≥4 mmol/L,成人 LDL-c≥5 mmol/L合并一级亲属受累或者伴有早发冠心病或者伴有明显基因突变患者可临床诊断HeFH。当LDL-c≥10 mmol/L同时伴有父母中的1或2个被临床诊断为FH,基因检测致病基因突变阳性,或者常染色体隐性遗传FH伴LDL-c>14 mmol/L;LDL-c>10 mmol/L 伴有主动脉疾病或20岁前出现黄色瘤可临床诊断为HoFH。

表1 英国Simon Broome(SBR)标准

表2 荷兰临床指南Dutch Lipid Clinic Network(DLCN)标准
注:各项目内分数取最高分合计得分:<3分提示不太可能是FH;3~5分提示可能为FH;6~8分提示极可能是FH;>8分确诊为FH
当完善遗传学检测时,其分类标准需依据其具体结果具体分析,详见表3。此临床分类标准建立正规的FH疾病编码,可增加临床对FH的识别,并提高公众对FH的认知。2016年国际动脉粥样硬化学会(IAS)对于严重家族性高胆固醇血症进行了明确定义[29],见表4,其包括以下几种情况:①未经治疗的患者LDL-c>10 mmol/L或LDL-c>8 mmol/L+1个心血管高危因素或LDL-c>5 mmol/L+2个心血管高危因素;②存在进展性的亚临床动脉粥样硬化的FH患者;③已经存在 ASCVD的FH患者。此定义标准将FH患者中心血管风险高危人群区分开来,治疗上以他汀联合依折麦布为起始治疗,LDL-c未达标者应更为积极地考虑接受新兴药物治疗,其对指导治疗改善预后起至关重要的作用。
4 治疗进展
FH患者的诊治要做到早期诊断、早治疗,饮食控制结合药物降脂治疗,才能有效预防和延缓患者发生ASCVD事件。国际家族性高胆固醇血症基金会患者管理整合指南[6]提出了FH的治疗目标:FH成人患者的初始治疗目标是使LDL-c下降幅度超过50%,而对于没有冠心病、糖尿病等危险因素的FH患者,建议LDL-c目标值应低于2.5 mmol/L (<100 mg/dL)。具有较高危心血管疾病风险的FH患者,包括临床上已明确的ASCVD、糖尿病的患者,应使LDL-c目标值低于1.8 mmol/L (<70 mg/dL)。
既往一项多中心临床随机试验研究[30]显示,高强度他汀在最大允许剂量时可使部分患者LDL-c降低达50%左右,瑞舒伐他汀40 mg可使LDL-c水平下降55%,阿托伐他汀80 mg可使LDL-c水平下降51%,辛伐他汀80 mg可使LDL-c水平下降46%。

表3 家族性高胆固醇血症诊断分类

表4 IAS共识:重症FH的诊断标准
另一包含了27项随机试验的荟萃分析显示,他汀每降低LDL-c 1.0 mmol/L,可使主要心血管事件风险降低21%[31]。他汀类药物不仅拥有明确的降脂作用,而且可在降低主要不良心血管事件和死亡方面获益,因此,高强度他汀类药物仍是目前治疗FH的主流。但HoFH患者对他汀治疗反应性较差,高强度他汀只能使HoFH患者LDL-c水平降低10%~25%[32],而他汀联合依折麦布可额外使LDL-c水平降低10%~15%[33]。因此,对于FH患者,他汀联合依折麦布、胆酸螯合剂以及其他新兴药物的治疗是必须的。如果充分药物治疗仍不能有效降低LDL-c水平,特别是对HoFH和一些严重的HeFH患者,还可选择血浆脂蛋白置换治疗或肝脏移植[33]。2015年,美国心脏协会关于家族性高胆固醇血症的科学声明中,对成人FH患者的治疗流程及方案的选择加以规范[10],见图3,高强度他汀单药初始治疗可以使LDL-c水平下降50%,以3个月为限,仍高于目标值者可联合依折麦布,双药治疗3个月不达标者可采用3种药物联合治疗,他汀加依折麦布基础上联合PCSK9抑制剂、考来维仑或其他胆汁酸螯剂或烟酸类,仍不能使LDL-c达标的严重FH患者,可采用4种药物联合治疗,或采用LDL血浆置换治疗。
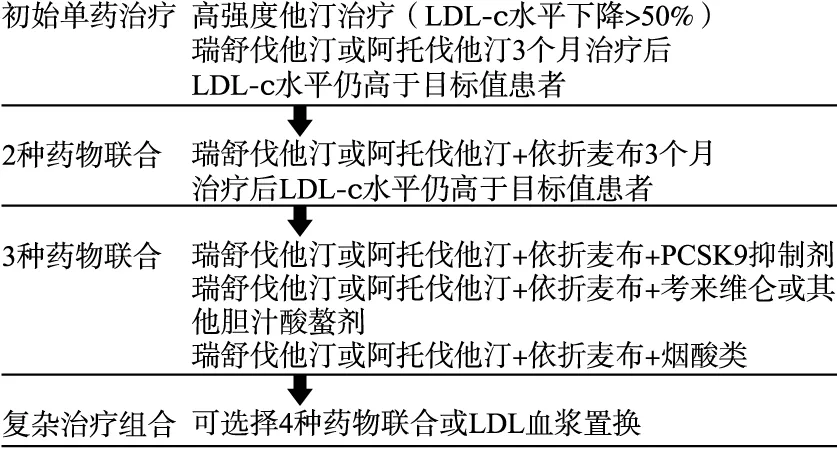
图3 FH的治疗流程图
FH的传统降脂药物应用[10]中需要注意:①在他汀药物中,目前证据表明,仅有普伐他汀可应用于8岁HeFH患者,其他他汀类药物建议在10岁以后使用。对于HoFH患儿,6岁以上可应用阿托伐他汀10~20 mg/d,13岁以上还可选用辛伐他汀40 mg/d。因洛伐他汀疗效受食物影响,需随餐嚼服,且2次/d较1次/d口服效果更佳。阿托伐他汀不受肾功能影响,肾功能不全患者无需调整剂量。②依折麦布在肝肾功不全时无需调整剂量,且和考来维仑均可应用于10岁以上HeFH患儿的治疗,而烟酸缓释片目前尚不可应用于儿童FH治疗。③依折麦布联合辛伐他汀可应用于10~17岁HeFH的患儿,依折麦布联合阿托伐他汀,烟酸缓释片联合洛伐他汀均无应用于FH患的证据。
FH的难治性及高心血管风险,使传统药物不足以满足FH患者治疗需求,近年来针对病理生理缺陷为靶点的新兴药物层出不穷,包括PCSK9抑制剂、米泊美生、洛美他派等,为FH患者带来希望[34]。PCSK9是一种肝源性分泌蛋白,其可通过降解肝脏细胞表面LDLR,从而降低LDLR对LDL-c的代谢,使LDL-c血浆浓度升高。PCSK9抑制剂与 PCSK9 特异性结合,减少PCSK9对LDLR的降解,使机体内足够的LDLR有效降低LDL-c水平[35]。目前,PCSK9抑制剂已被FDA 批准用于FH,但其作用一定程度上需依赖LDLR残余活性。米泊美生是人工合成的第2代单链反义寡核苷酸,通过抑制apoB100 的合成,使含有apoB100的LDL、Lp(a)、VLDL等脂蛋白合成受限,从而降低其血浆浓度。Stein等[36]针对 HeFH患者开展了一项双盲、随机、安慰剂对照的 Ⅲ 期临床研究,将HeFH患者(既往接受最大耐受剂量他汀治疗) 随机分为米泊美生组和安慰剂组,治疗26周后,两组LDL-c水平存在明显差异,米泊美生组LDL-c水平下降28.0%,而安慰剂组LDL-c水平升高5.2%。另一对米泊美生相关的6组临床实验数据进行的荟萃分析显示,米泊美生使LDL-c水平降低约33.13%,此外,非高密度脂蛋白胆固醇(non-HDL-c)水平降低31.7%,apoB和Lp(a)水平分别降低了33.27%和26.34%。洛美他派是微粒体的三酰甘油转运蛋白抑制剂。一项研究中,洛美他派联合基础降脂治疗,可使LDL-c水平较基线明显下降达50%[37]。洛美他派主要临床不良反应是胃肠道症状及肝脏损害,肝损伤以转氨酶升高、肝脂肪变性为主。由于洛美他派和米泊美生主要通过抑制LDL-c的合成达到降脂目的,不依赖LDLR,因此,其可成为LDLR功能缺失的HoFH患者的重要辅助治疗[38]。
目前,在FH治疗中广泛应用的降脂药物效果并不理想,尤其是对于HoFH和严重的HeFH患者,而脂蛋白血浆置换(LA)可为其提供一种治疗选择。LA可使 LDL-c水平下降达50%~80%[39],从而改善内皮功能,延缓动脉粥样硬化病变进程,有效改善冠心病患者预后[40]。其主要用于药物治疗不能使LDL-c下降达50%的患者,禁忌于出血体质、对肝素敏感的患者。将LDL-c水平维持在6.5~2.5 mmol/L为目标来决定LA的频率,一般每周或每2周进行1次,LDL-c水平在置换后下降约70%[41]。LA的不良反应包括过敏反应、低血压、腹痛、恶心、低钙血症和缺铁性贫血等,但这些并不常见[33],相较之下LA安全有效,极少出现因严重不良反应而影响治疗的情况,甚至可在HoFH合并妊娠患者中应用[42]。HoFH儿童和LDL-c水平极度升高的HeFH患者还可选择肝移植,主要适于不能耐受LA或强化药物治疗的患者[43],对于伴严重CAD的患者,还可进行心肝联合移植。供体肝脏具有正常功能的LDLR,在受体机体内发挥脂质代谢功能,甚至可使FH患者LDL-c水平达到正常人水平[44],但需承担肝脏移植相应的手术及长期免疫抑制治疗的风险和费用。
FH是一种较为普遍的遗传性疾病,主要是因 LDLR 基因突变引起的血浆中LDL-c水平显著升高,成为早发冠心病的高危人群,严重危害人类健康。但世界范围内对于FH的诊断及治疗不足,我国与欧美国家尚存在一定差距,且缺乏基于我国人群的FH相关数据和研究,迫切需要在FH人群中进行有关治疗目标、治疗安全性和亚临床动脉粥样硬化影像检查对终点事件影响的研究。FH 患者的治疗应建立在严格的饮食运动等生活方式干预的基础上。同时,药物治疗仍以他汀为主流,大多需与其他传统药物或新兴药物联合治疗,目前,针对FH病理生理机制研发的新药为FH患者提供了希望。为改善我国FH患者的预后,应多开展基于我国人群的FH相关研究,制定出更符合我国人群特点的诊断标准,以做到早发现、早诊断、早治疗。
