干扰素联合核苷(酸)类似物长疗程抗病毒对HBsAg的影响
2018-09-28杨兴祥杨仁国
潘 佳,江 南,杨兴祥,杨仁国
0 引言
慢性乙型肝炎(Chronic hepatitis B,CHB)治疗中,抗病毒治疗可以使患者肝脏炎症得到控制,使肝硬化、肝癌风险降低[1],而抗病毒治疗的理想终点是发生HBsAg清除甚至实现HBsAg转换,即实现临床治愈[2-3]。核苷(酸)类似物[Nucleos(t)ide analogues,NUC]和干扰素(Interferon,IFN)类药物均为非抗乙肝病毒特效药,单用其中一类药物获得的HBsAg清除、转换率均较低[4]。联合两类作用机制不同的药物治疗慢性乙型肝炎已成为目前研究热点,但既往研究两类药物联合使用时间均较短,国内外鲜有联合至96周和156周的研究,本研究就NUC初始联合IFN和NUC经治联合IFN长疗程抗病毒方案进行回顾性分析,比较联合过程中HBsAg清除率和转换率,为慢性乙型肝炎患者实现临床治愈提供依据。
1 对象与方法
1.1 研究对象 按我国2000年《慢性乙型肝炎防治指南》诊断标准[2]纳入四川省人民医院感染内科2008年1月至2016年4月接受IFN联合NUC及单用NUC抗病毒治疗的慢性乙型肝炎患者188例进行回顾性研究。纳入病例:①HBeAg阳性患者PCR HBV-DNA>105拷贝/ml,HBeAg阴性患者PCR HBV-DNA>104拷贝/ml;②丙氨酸氨基转移酶(ALT)为2~10倍正常值上限或(且)有病理学依据;③无抗病毒禁忌证。排除病例:①妊娠期间或有严重精神疾病史;②未戒断的吸毒人员或酗酒者;③未控制的自身免疫系统疾病、合并HIV及其他病毒性肝炎患者;④失代偿期肝硬化。
1.2 方法 将患者分为3组。A组:NUC初始联合IFN(40例),B组:NUC经治(2.8±2.4)年后联合IFN(48例),C组:单用NUC治疗3年(100例)。其中男140例(28∶38∶74),女48例(12∶10∶26);HBeAg阳性患者148例(36∶37∶75),HBeAg阴性患者40例(4∶11∶25);A组平均年龄(34.6±8.2)岁,B组平均年龄(36.3±9.0)岁,C组平均年龄(38.1±11.6)岁。
干扰素:①cIFNα-2b(安徽安科生物集团股份有限公司,商品名:安达芬)500 MU,3次/周,皮下注射;②PEG-IFNα-2a(上海罗氏制药有限公司,商品名:派罗欣)180 μg,1次/周,皮下注射。NUC包括拉米夫定100 mg/d,阿德福韦酯10 mg/d,替比夫定600 mg/d,恩替卡韦0.5 mg/d,替诺福韦300 mg/d。IFN联合NUC治疗疗程为48、96、156周,单药NUC治疗组疗程为3年。
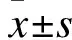
2 结果
2.1 三组患者基线情况比较 三组患者在性别、年龄、使用干扰素种类、HBeAg(+)/(-)患者构成比、HBsAg定量上比较差异无统计学意义(P>0.05),由于B组患者联合INF治疗前有(2.8±2.4)年NUC用药史,B组HBV-DNA、ALT水平低于A组、C组,差异有统计学意义(P<0.05)。见表1。
2.2 三组HBsAg清除率、HBsAg血清学转换率比较 48周时,三组HBsAg清除率比较差异无统计学意义;96周时,三组HBsAg清除率比较差异有统计学意义(χ2=16.062,P<0.001);156周时,三组HBsAg清除率比较差异有统计学意义(χ2=33.453,P<0.001)。进一步组间两两比较,96周时,B组HBsAg清除率高于C组(PBC<0.001),而A组与B组、A组与C组组间比较差异无统计学意义(P>0.017);156周时,组间两两比较,HB-sAg清除率从高到低分别为B>A>C(PAB=0.014,PBC<0.001,PAC=0.013)。
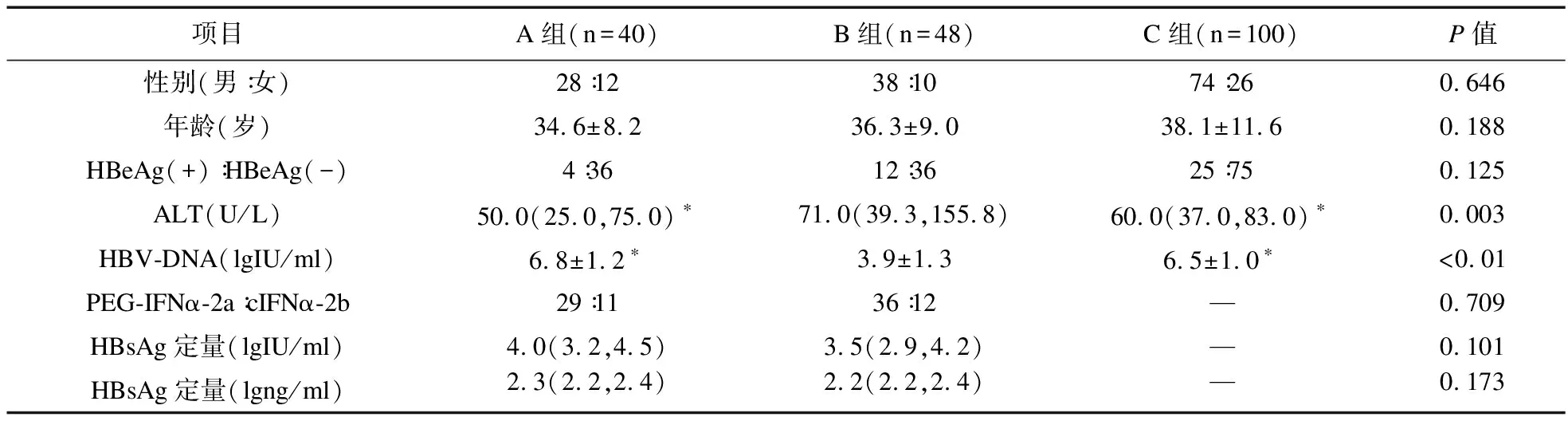
表1 患者基线情况
注:与B组比较,*P<0.05
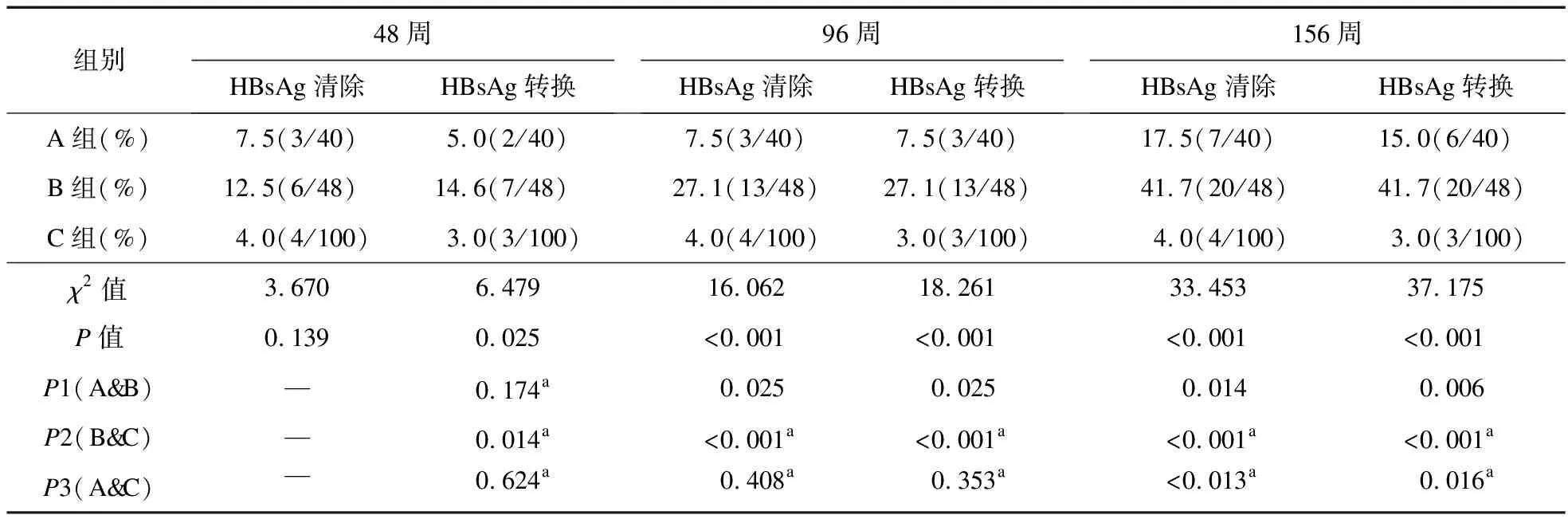
表2 不同疗程3种方案血清学情况比较(%)
注:a.Fisher′s精确概率
48周时,三组HBsAg转换率比较差异有统计学意义(χ2=6.479,P=0.025);96周时,三组HBsAg转换率比较差异有统计学意义(χ2=18.261,P<0.001);156周时,三组HBsAg转换率比较差异有统计学意义(χ2=37.175,P<0.001)。48周时,B组HBsAg转换率高于C组(P=0.014),A组与B组、C组比较差异无统计学意义(PAB=0.174,PAC=0.624);96周时,B组HBsAg转换率高于C组(PBC<0.001),而A组、B组,A组、C组组间比较,差异无统计学意义(P>0.017);156周时,HBsAg转换率由高到低分别为B组>A组>C组(PAB=0.006,PAC=0.016,PBC<0.001)。见表2。
2.3 不同干扰素联合核苷(酸)类似物治疗效果比较 对A组和B组使用cIFNα-2b(商品名:安达芬)+NUC(23例)、PEG-IFNα-2a(商品名:派罗欣)+NUC(65例)的患者进行分析,结果显示,派罗欣联合NUC组HBsAg清除率高于安达芬治疗组,派罗欣联合NUC组HBsAg转换率高于安达芬联合NUC组。见表3。
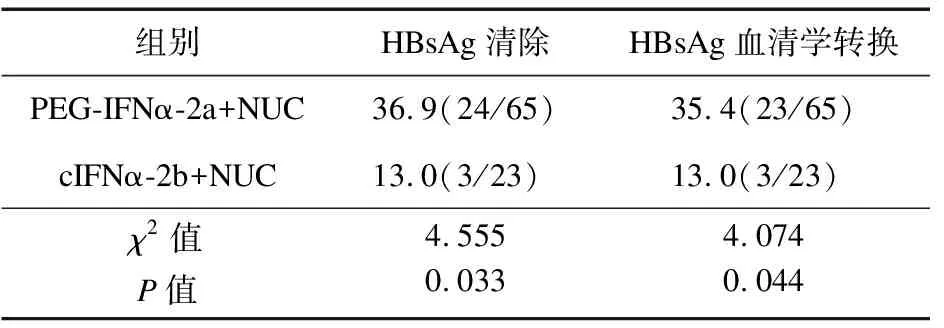
表3 长疗程不同干扰素治疗效果比较(%)
2.4 安全性分析 IFN联合NUC进行抗病毒治疗过程中,5例患者因焦虑、抑郁等精神因素停用IFN(A组3例,B组2例),6例患者因白细胞降低、血小板降低、甲功异常等血液学因素停用IFN(A组2例,B组4例),其他患者在经过调整药物剂量和加用对症治疗药物后,能够完全耐受联合方案,无因不良反应而导致死亡的病例;在单用NUC进行抗病毒治疗的患者中,未出现因严重不良反应而停药的患者。
3 讨论
干扰素是首先被批准用于CHB抗病毒治疗的药物,有普通干扰素(IFN)和聚乙二醇干扰素(PEG-IFN)2种剂型,具有调节机体免疫力和抗病毒双重作用,持久抑制乙型肝炎病毒复制,疗程相对固定。核苷(酸)类似物通过竞争性抑制HBV-DNA聚合酶的活性可直接抑制HBV-DNA的复制,抑制病毒作用强,不良反应少,但HBsAg阴转率较低。联合两类作用机制不同的药物治疗慢性乙型肝炎已经成为目前研究的热点,理论上二者联用可以增强疗效,然而早期的临床研究提示联合治疗并不优于干扰素单药治疗[5],但二者联合时间均较短,且研究多针对生化学、病毒抑制力度及HBeAg转换方面[6]。随着对疾病认识的深入,NUC联合IFN治疗慢性乙型肝炎对血清HBsAg影响的优势得到越来越多学者的肯定[7]。
本研究对我院慢性乙型肝炎患者不同抗病毒方案的疗效进行了回顾性研究,结果显示,IFN初始联合NUC治疗慢性乙型肝炎没有体现出联合治疗的优势,可能与用药疗程短、病例数较少有关。Marcellin等[8]研究显示,IFN联合NUC能提高患者HBsAg应答率,其中对于不同方式的联合方案,部分学者得出的结论与本研究一致[9-11],NUC经治联合IFN组疗效较初始联合组好,可能与联合前低水平HBV-DNA定量从而增加了机体对IFN敏感性相关。既往多数研究IFN联合NUC的时间仅为48周,本研究延长至96、156周,其HBsAg清除率和血清学转换率显著高于48周[12-13],提示IFN与NUC联合治疗的疗效与疗程有正相关关系。另外,IFN-α-2a治疗CHB的疗效优于IFN-α-2b被多数研究认可[14-15],本研究结果也得出一致结果。
本研究由于病例数关系仅对IFN联合NUC方案、单用NUC方案进行了疗效比较,未设置单用IFN组比较疗效,但就IFN联合NUC 48周时HBsAg清除率和HBsAg转换率高于疗程为3年的单用NUC方案而言,提示两类不同作用机制药物联合治疗存在一定优势,临床应用患者可能最大获益。本研究结果显示,NUC经治后联合IFN治疗慢性乙型肝炎的疗效较初始联合组好,是否与低病毒载量为IFN治疗优势条件相关,可能有待更多的循证医学资料证实。本研究属于临床回顾性分析,在治疗过程中充分关注伦理学问题,HBV-DNA低于103copies/ml为调整药物的主要依据之一,故在该研究中的患者联合NUC的种类会根据情况调整,待后期样本量足够大时可进一步进行不同NUC联合不同IFN疗效的比较。
