大蒜素对小肠缺血再灌注损伤保护作用的研究
2018-09-28武向鹏
武向鹏,崔 薇
0 引言
小肠缺血再灌注损伤是外科肠道手术及休克、心肺功能不全等常见并发症,其病理机制复杂,既往研究发现,氧化应激损伤、炎症反应及继发性细胞凋亡是小肠缺血再灌注损伤发生发展的重要病理机制[1-4]。大蒜素是一种天然存在的二烯丙基三硫化物,具有抗氧化、抗炎、抗凋亡等生物学活性[5-7]。以往动物研究已经证实,大蒜素能够通过抑制氧化应激、炎症反应、细胞凋亡等对脑组织、肾脏、心肌、肝脏等组织器官的缺血再灌注损伤起到一定的保护作用,但大蒜素对小肠缺血再灌注损伤是否具有保护作用尚未见文献报道,本实验将对这一问题进行实验研究,并探讨其可能的作用机制。
1 材料与方法
1.1 实验动物 清洁级雄性SD大鼠(8周龄,210~250 g)购自河北省实验动物中心[SCXK(冀)2008-1-003]。饲养环境:恒温23~25 ℃、相对湿度65%~70%、光照周期12 h∶12 h。
1.2 实验药物与试剂 大蒜素注射液(上海禾丰制药有限公司,2 ml∶30 mg,批号:950041);肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6、内毒素酶联免疫检测试剂盒(北京博奥森生物工程有限公司,批号:170416、170125、170409、070411);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒和TUNEL试剂盒(南京建成生物工程研究所,批号:20170403、20170512、20170324、20170321)。
1.3 实验方法
1.3.1 分组与模型制备 将100只试验用SD大鼠按照随机数字表法随机分为假手术组,模型组,大蒜素5、10、20 mg/(kg·d)组,每组20只;各组大鼠均在造模前5 d开始腹腔注射给药(1次/d),假手术组、模型组大鼠同步给予生理盐水。术前禁食12 h(自由饮水)后,参照朱枝祥等[8]报道的实验方法制备小肠缺血再灌注大鼠模型:腹腔注射水合氯醛(2%,5 ml/kg)实施麻醉,开腹并剥离肠系膜上动脉,夹闭60 min后松夹实现再灌注,小肠缺血再灌注模型造模结果的判定:夹闭肠系膜上动脉后肠管颜色变暗而松夹后颜色逐渐变红,即可判定造模成功;假手术组行手术操作但不夹闭肠系膜上动脉。
1.3.2 小肠组织含水量测定 每组随机取5只大鼠,实施麻醉后开腹,取回盲部10 cm以上处相同部位4 cm肠管组织,冲洗干净后称重(W1),置107 ℃烘烤72 h后再次称重(W2),含水量=[(W1-W2)/W1]×100%。
1.3.3 小肠组织病变及Chiu′s氏评分 每组随机取5只大鼠,参照“1.3.2”项方法取肠管组织并冲洗干净后,置4%多聚甲醛溶液中固定72 h,然后依次进行包埋、切片、脱蜡水化等处理后行HE染色,然后通过倒置光学显微镜观察小肠组织病理学改变。参照Chiu等[9]报道的组织损伤评分量表进行小肠组织损伤评分,见表1。

表1 小肠组织损伤Chiu′s氏评分量表
1.3.4 细胞凋亡状况观察及凋亡指数计算 取“1.3.3”项制备的石蜡组织切片,脱蜡水化后,遵照TUNEL试剂盒方法步骤处理,黄褐色着色为阳性细胞(凋亡细胞),通过倒置显微镜观察。凋亡指数=(阳性细胞数/总细胞数)×100%,分别计数5个互不重叠的视野,取平均值。
1.3.5 小肠组织炎症细胞因子、内毒素、抗氧化酶、MDA测定 取每组剩余的10只大鼠,参照“1.3.2”项方法取肠管组织并用冷生理盐水冲洗干净后,研磨匀浆,3 000 r/min离心10 min后取上清液,严格按照各试剂盒操作方法步骤,通过酶标仪测定小肠组织炎症细胞因子(TNF-α、IL-1β、IL-6)和内毒素表达水平;通过紫外分光光度计测定抗氧化酶(SOD、CAT)活性和MDA含量。
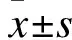
2 结果
2.1 各组大鼠小肠组织含水量比较 与假手术组比较,模型组大鼠小肠组织含水量升高(P<0.01);与模型组比较,大蒜素10、20 mg/(kg·d)组含水量降低(P<0.05或P<0.01)。见表2。

表2 各组大鼠小肠组织含水量比较(n=5)
注:与模型组比较,*P<0.05,**P<0.01
2.2 各组大鼠小肠组织病变及Chiu′s氏评分比较 假手术组小肠组织肠绒毛完整、排列整齐,未见异常;模型组小肠组织可见上皮细胞脱落、绒毛尖端上皮抬高与固有层分离、中性粒细胞浸润等明显的病理学改变;与模型组比较,大蒜素组小肠组织病变明显减轻,其中大蒜素20 mg/(kg·d)组效果最为显著。见图1。与假手术组比较,模型组大鼠小肠组织Chiu′s氏评分升高(P<0.01);与模型组比较,大蒜素10、20 mg/(kg·d)组Chiu′s氏评分降低(P<0.05或P<0.01)。见表3。
2.3 各组大鼠小肠组织细胞凋亡及凋亡指数比较 假手术组未见凋亡细胞,与假手术组比较,模型组小肠组织凋亡细胞数量明显增多、凋亡指数明显升高(P<0.01);与模型组比较,大蒜素10、20 mg/(kg·d)组凋亡细胞数量明显减少、凋亡指数明显降低(P<0.05或P<0.01)。见图2、表3。
2.4 各组大鼠小肠组织炎症细胞因子和内毒素含量比较 与假手术组比较,模型组大鼠小肠组织中炎症细胞因子(TNF-α、IL-1β、IL-6)和内毒素水平明显升高(P<0.01);与模型组比较,大蒜素10、20 mg/(kg·d)组TNF-α、IL-1β、IL-6、内毒素含量明显下降(P<0.05或P<0.01)。见表4。
表3 各组大鼠小肠组织细胞凋亡指数比较(n=5)
注:与模型组比较,*P<0.05,**P<0.01
2.5 各组大鼠小肠组织抗氧化酶活性及MDA含量比较 由表5可知,与假手术组比较,模型组大鼠小肠组织抗氧化酶(SOD、CAT)活性降低,而MDA含量升高(P<0.01);与模型组比较,大蒜素10、20 mg/(kg·d)组SOD、CAT活性升高,而MDA含量降低(P<0.05或P<0.01)。
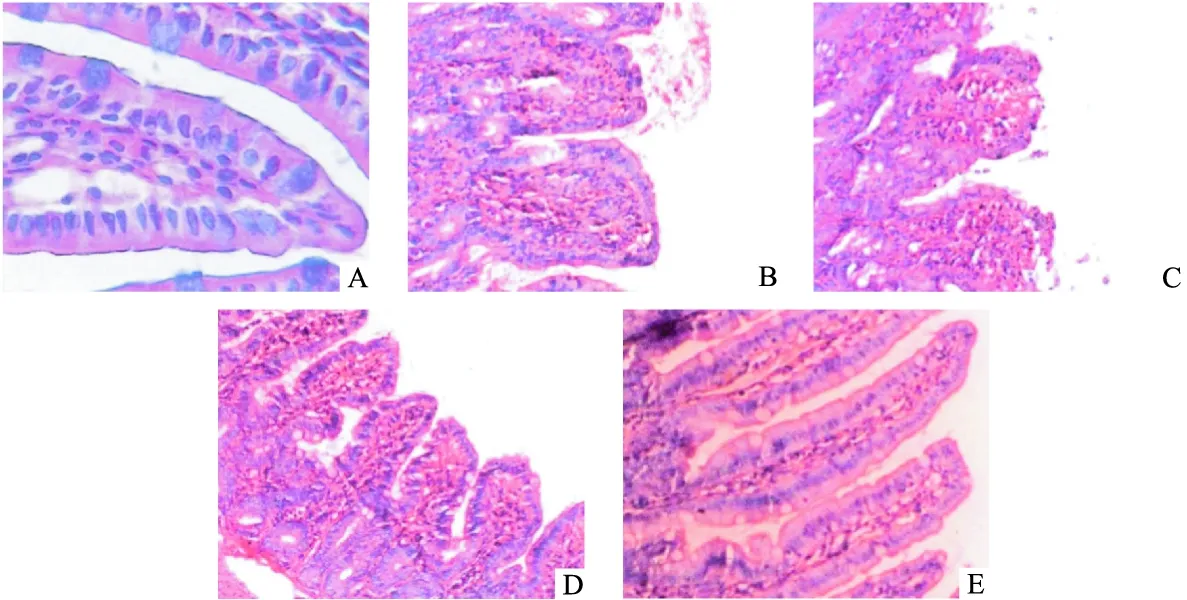
图1 各组大鼠小肠组织病变(HE,400×)
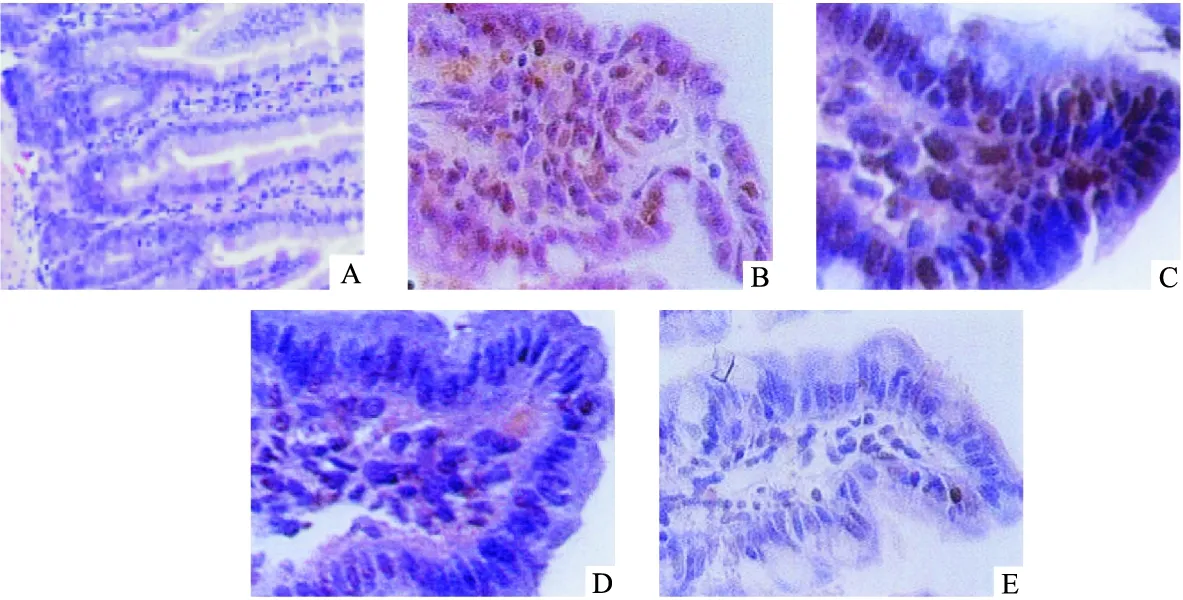
图2 各组大鼠小肠组织细胞凋亡状况(TUNEL,400×)

组别TNF-α(ng/g)IL-1β(ng/g)IL-6(ng/g)内毒素(kEu/g)假手术组9.13±1.27∗∗45.94±5.18∗∗59.25±7.95∗∗0.13±0.03∗∗模型组48.76±8.1090.12±9.65214.36±38.090.97±0.19大蒜素5 mg/(kg·d)组43.22±7.4683.71±10.96185.37±39.120.83±0.22大蒜素10 mg/(kg·d)组32.98±6.23∗∗77.30±9.24∗159.68±35.43∗0.74±0.20∗大蒜素20 mg/(kg·d)组19.14±4.08∗∗69.83±8.15∗∗113.52±30.06∗∗0.62±0.16∗∗
注:与模型组比较,*P<0.05,**P<0.01
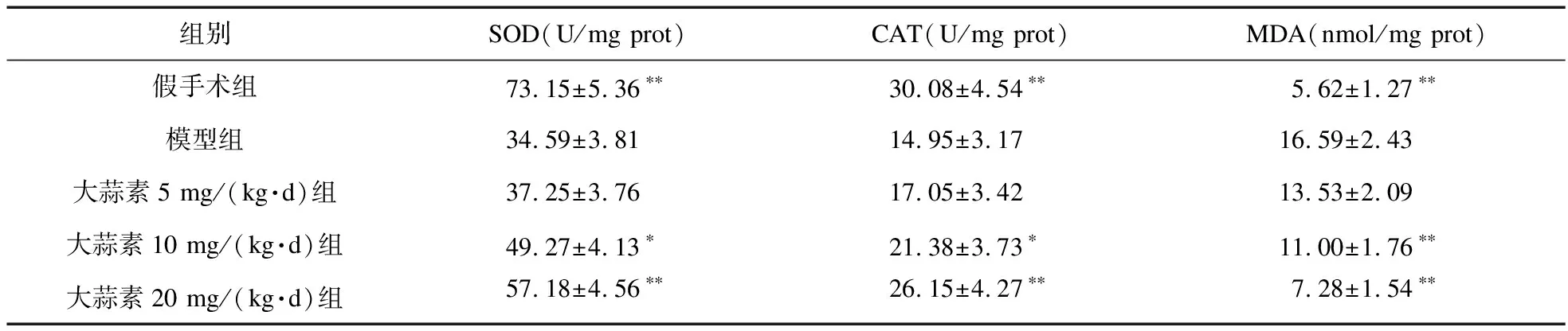
表5 各组大鼠小肠组织抗氧化酶活性及MDA含量比较(n=10)
注:与模型组比较,*P<0.05,**P<0.01
3 讨论
病理生理学研究发现,氧化应激、炎症反应及继发性细胞凋亡是小肠缺血再灌注损伤发生发展的重要病理机制[1-4],而大蒜素具有抗氧化、抗炎、抗凋亡的药理学作用[5-7]。本研究发现,经大蒜素10、20 mg/(kg·d)预处理5 d,能够有效降低小肠缺血再灌注大鼠小肠组织含水量,改善小肠组织病变,降低Chiu′s氏评分,抑制小肠组织细胞凋亡,提示大蒜素对大鼠小肠缺血再灌注损伤具有一定的保护作用。
炎症细胞因子水平是监测体内炎症反应的常用指标;而内毒素是一种具有毒性作用的脂多糖,能够导致机体发热、微循环障碍、内毒素休克等。本研究发现,经大蒜素10、20 mg/(kg·d)预处理5 d,能够有效降低小肠缺血再灌注大鼠小肠组织中TNF-α、IL-1β、IL-6和内毒素含量,提示大蒜素对大鼠小肠缺血再灌注后出现的炎症反应具有一定的抑制作用。
组织缺血再灌注后氧自由基(ROS)过剩是氧化应激损伤发生的病理基础,生理状态下ROS能够在抗氧化酶(SOD、CAT)相继催化作用下最终被还原生成H2O和O2[10];但过剩的ROS将攻击细胞膜,使其主要成分不饱和脂肪酸被氧化破坏,其中MDA为氧化应激损伤终产物之一,因此,SOD、CAT活性和MDA含量水平能直接和间接反映机体氧化应激损伤程度[11]。本实验研究发现,大蒜素10、20 mg/(kg·d)预处理5 d,能够有效提高大鼠小肠缺血再灌注后小肠组织SOD、CAT活性并降低MDA含量,提示大蒜素对大鼠小肠缺血再灌注后氧化应激损伤具有一定的抑制作用。
综上所述,大蒜素对大鼠小肠缺血再灌注损伤具有一定的保护作用,其作用机制可能与大蒜素抑制小肠组织细胞凋亡、氧化应激反应及炎症反应有关。
