大白菜BrCOX11基因的克隆及表达分析
2018-09-28魏小春原玉香赵艳艳王志勇杨双娟郑小兰段俊枝张晓伟
魏小春,原玉香,赵艳艳,王志勇,杨双娟,郑小兰,段俊枝,张晓伟*
(1.河南省农业科学院 园艺研究所,河南 郑州 450002; 2.河南省农业科学院 农业经济与信息研究所,河南 郑州 450002)
细胞色素C氧化酶(Cytochrome C oxidase,COX)也称细胞色素氧化酶,能够以氧化磷酸化的方式为细胞供能。细胞色素C氧化酶作为线粒体呼吸链组成的关键部分,对细胞提供能量至关重要。它是位于线粒体电子传递链上的一种氧化酶、膜蛋白酶,并且是呼吸链中电子受体的最后一个。细胞色素C氧化酶是线粒体电子传递链复合体的多亚基末端氧化酶,在三磷酸腺苷生产调节中起关键作用[1-2]。其活性受张力、膜脂质环境、激素调节以及蛋白质修饰的影响[2-4]。细胞色素C氧化酶一般含有4~13个亚基,亚基数目在不同生物中不等。COX11是核基因编码的线粒体蛋白,在生物体中的主要功能是在组装过程中将Cu插入COX复合物。COX11蛋白家族的几个成员已被证明在向COX亚基Ⅰ递送过程中起关键作用[5-6]。COX10和COX11在球形红菌(Rhodobactersphaeroides)中起到和细胞色素氧化酶亚基Ⅱ、Ⅲ的蛋白质分子伴侣功能[7]。研究发现,COX11具有消除活性氧的功能,是真核生物的一个新的细胞程序性凋亡(PCD)的抑制因子。与野败型细胞质雄性不育基因WA352的互作干扰了COX11的正常功能,导致水稻花药绒毡层线粒体的活性氧暴发和细胞色素C释放到细胞浆(这是PCD的诱导因素),提前启动PCD控制的绒毡层降解,从而产生花粉败育[8]。
大白菜(Brassicarapassp.pekinensis)为芸薹属叶用蔬菜(基因组AA,2n=20)。作为重要的蔬菜作物在中国乃至全球种植,年产值在600亿元以上。在我国种植面积达270万hm2以上,占全国蔬菜总种植面积的15%左右[9-11],然而尚未有关大白菜COX11基因(BrCOX11)的报道,为此开展大白菜COX11基因克隆和表达分析,旨在为COX11基因功能的鉴定提供依据。
1 材料和方法
1.1 试验材料
供试材料大白菜为河南省农业科学院园艺研究所选育的Ogura雄性不育系Tyms、Polima雄性不育系22 m2、保持系Y231-330、抗根肿病DH系Y635-10、感根肿病DH系Y177-47。所有材料于2016年在河南现代农业研究开发基地种植,统一栽培管理。根肿病材料鉴定参考河南省农业科学院园艺研究所生物育种实验室建立的方法进行:在培养间内培育材料,培养条件16 h光照/8 h黑暗、光照强度120 μmol/(m2·s)、温度(22±2)℃。采用灌根接种法鉴定抗性。每个小区定植27株幼苗,制备根悬浮液,每个材料灌根10~35 d,之后对根部进行逐一分级调查[12]。
1.2 大白菜总RNA提取和反转录
RNA提取参照Trizol法,以RNA作为模板反转录成cDNA。
1.3 基因引物设计与合成
根据相关序列设计引物(表1),由深圳华大基因科技服务有限公司合成。

表1 大白菜基因克隆及其表达检测所用引物
1.4 BrCOX11基因3′RACE及cDNA全长克隆
转录组测序Denovo组装结果片段,设计引物进行3′RACE(SMARTer RACE cDNA Amplification Kit,Clontech),按照获得的完整编码区设计引物扩增cDNA全长。PCR反应条件为:95 ℃预变性 5 min;95 ℃ 变性30 s,54 ℃ 退火3 min,72 ℃延伸1 min,35次循环。
采用琼脂糖凝胶电泳检测产物,检测合格后回收片段,连接Infusion克隆载体(In-Fusion HD Cloning Kit,Clontech),转化感受态细胞,检测得到阳性单克隆,之后测序。DNA MarkerⅢ为DL 5000(Takara,Dalian)。
1.5 序列分析
按照目的基因序列,在NCBI的Blastp工具栏对所编码的蛋白质进行同源序列比对,用Clustal X软件进行序列比对分析,用MEGA 7.0软件构建进化树,用ProtParam软件分析BrCOX11基因编码的氨基酸理化性质,用SOPMA(Secondary structure prediction method)预测分析蛋白质二级结构,用软件BaCelLo(Balanced subcellular localization predictor)进行亚细胞定位预测,用软件ProtScale分析氨基酸序列的亲水性/疏水性。
1.6 基因表达分析
提取大白菜叶片、根部及花蕾总RNA,反转录成cDNA。定量PCR反应体系为20.0 μL[10 μL 2×SYBR®Premix ExTaqTM(Tli RNaseH Plus),2 μL cDNA,上、下游引物(qCOX11F及qCOX11R)各1 μL(引物浓度10 μmol/L),6 μL ddH2O]。PCR反应条件为:95 ℃预变性30 s;95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸60 s,40次循环。每个样品重复3次。内参基因为Actin。采用罗氏公司LightCycler®480Ⅱ实时荧光定量PCR仪,对目的基因进行实时荧光定量PCR扩增。用2-△△CT法计算基因相对表达量[13]。
大白菜组织特异性及根肿病数据来自 SRR643621、SRR643622、SRR643623、SRR643624、SRR643625、SRR643626、SRR643627、SRR643628、SRR3571023、SRR3571024。相对表达量为FPKM[14]。
2 结果与分析
2.1 大白菜BrCOX11基因克隆
根据3′RACE结果(图1A),组装成完整编码区,设计引物,进行PCR扩增,凝胶电泳,观察条带可以看出目的片段大小为1 300 bp左右(图1B),将所需的片段回收,然后连接、转化,进行单克隆测序。该基因与数据库中目的片段相同,具有完整的ORF,为861 bp,编码286个氨基酸,命名为BrCOX11。
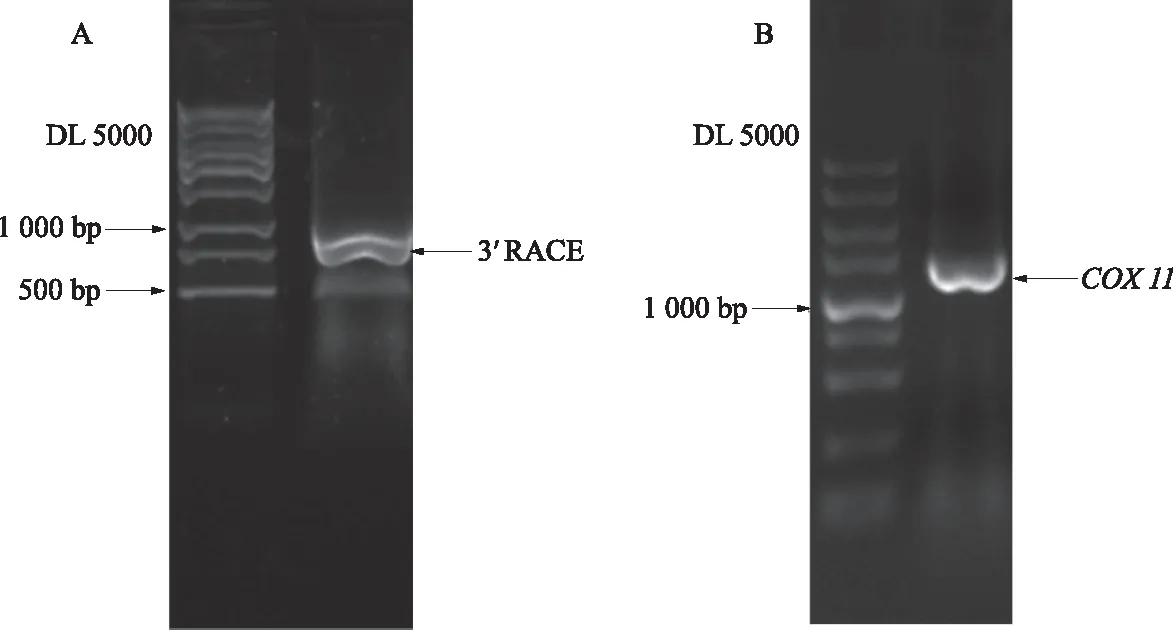
图1 大白菜BrCOX11基因PCR扩增
2.2 BrCOX11基因编码氨基酸序列同源性分析
通过比对分析大白菜BrCOX11基因的序列,发现其编码蛋白质有COX11结构域(图2)。用Clustal X进行多重比对分析发现,大白菜与其他作物COX11氨基酸序列高度相似,是COX家族的一员(图3)。

图2 大白菜BrCOX11结构域预测
2.3 BrCOX11蛋白理化性质预测及亲水性分析
用ProtParam软件预测大白菜BrCOX11氨基酸的理化性质,蛋白质分子质量32.206 ku,理论等电点8.75,分子式C1 434H2 214N386O435S12,脂肪系数66.78,疏水性平均值-0.394。含量最高的氨基酸是丝氨酸(相对含量达到10.5%),色氨酸和半胱氨酸含量较低。疏水性平均值小于零,说明BrCOX11是亲水性蛋白。
2.4 BrCOX11蛋白二级结构预测
用SOPMA软件分析BrCOX11蛋白的二级结构:α-螺旋(h) 21.68%、延伸链(e)20.63%、β-转角(t) 5.24%、无规则卷曲(c) 52.45%,多肽链通过形成二级结构来给BrCOX11蛋白提供稳定的空间(图4)。
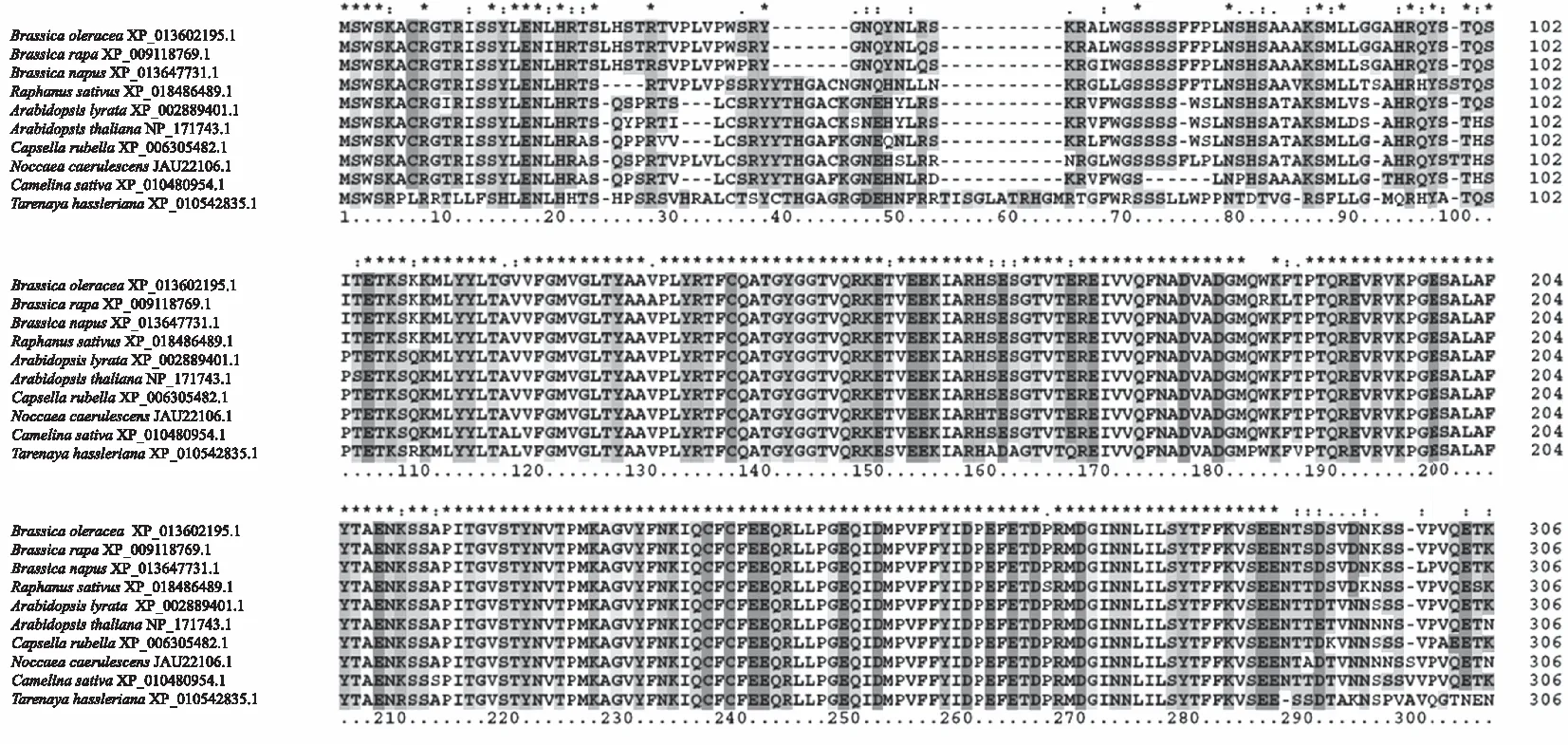
图3 大白菜BrCOX11氨基酸序列比对

图4 大白菜BrCOX11氨基酸二级结构预测
2.5 BrCOX11蛋白进化树分析
用Blastp进行同源性检索,用MEGA 7.0构建进化树。可以看出,大白菜BrCOX11与芸薹属、拟南芥属及萝卜属亲缘关系最近;而与棉花属、胡萝卜属和黄瓜属等亲缘关系较远(图5)。

图5 大白菜及其他物种COX11蛋白进化树分析
2.6 大白菜BrCOX11基因表达分析
从图6可以看出,无论抗根肿病材料还是感根肿病材料,BrCOX11基因在根肿菌侵染后的根部组织中表达上调,而在根肿菌侵染后的叶片组织中下调。
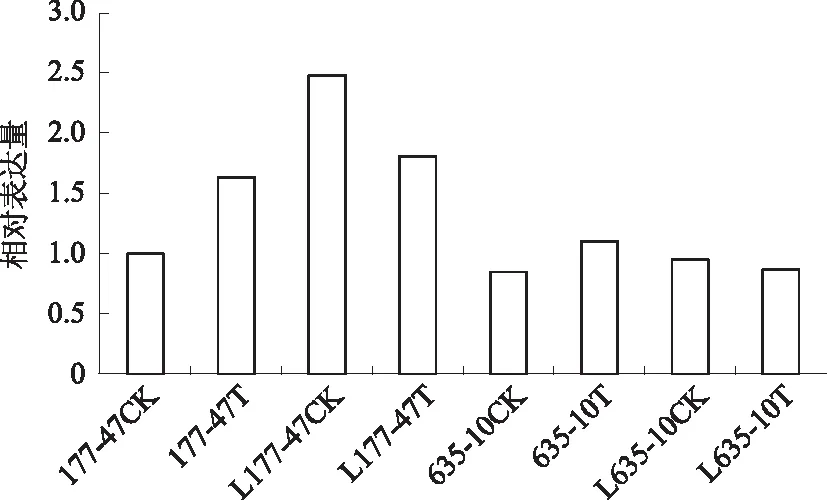
177-47CK、177-47T、L177-47CK、L177-47T分别为感根肿病DH系Y177-47接菌前地下部分、接菌后地下部分、接菌前叶片部分、接菌后叶片部分;635-10CK、635-10T、L635-10CK、L635-10T分别为抗根肿病DH系Y635-10接菌前地下部分、接菌后地下部分、接菌前叶片部分、接菌后叶片部分图6 BrCOX11基因在大白菜抗根肿病DH系Y635-10、感根肿病DH系Y177-47中的相对表达量
从图7可以看出,BrCOX11基因在大白菜不同组织器官如根、茎、叶、果荚中的表达量均不相同,其中,在果荚中表达量最高。
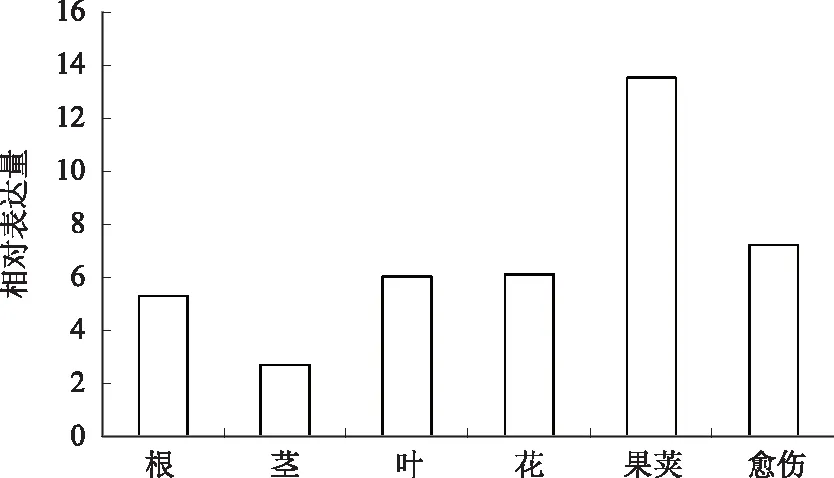
图7 BrCOX11基因在大白菜不同组织器官中的相对表达量
从图8中可以看出,BrCOX11在大白菜Ogura雄性不育系Tyms 和Polima雄性不育系22m2中表达量明显低于其共同保持系Y231-330中的表达量。

图8 BrCOX11基因在大白菜雄性不育系Tyms 、22m2及保持系Y231-330中的相对表达量
3 结论与讨论
通过对在杂交稻中广泛利用的野败型细胞质雄性不育(Cytoplasmic male sterility,CMS)基因WA352的克隆,发现该基因由多个功能未知的线粒体基因片段重组而成。研究发现,COX11具有消除活性氧的功能,是真核生物保守的一个新的细胞程序性凋亡抑制因子,与WA352蛋白的互作干扰了COX11的正常功能,导致水稻花药绒毡层线粒体的活性氧暴发和细胞色素C释放到细胞浆,提前启动PCD控制的绒毡层降解,从而产生花粉败育[8]。为了阐明植物线粒体新基因的起源进化机制,又对800多份野生稻和栽培稻材料的线粒体基因组进行序列分析,发现11种与WA352相关的重组结构,3个新的CMS基因WA352a、WA352b、WA314。证明这些CMS新基因是由2个结构相似但没有CMS功能的原基因通过序列变异和自然选择,获得了与COX11的互作能力即功能化演化而来,将有助于进一步了解CMS基因和恢复基因协同进化和互作的分子机制[15]。
COX11在花粉发育乃至植物生长发育的整个过程起着重要作用。COX11的敲除和过表达都会干扰蛋白质的功能,并具有显著的表型效果。研究表明,敲除拟南芥AtCOX11基因抑制植物的根生长;高水平的COX11可导致其蛋白质失去活性[16]。AtCOX11在拟南芥中不仅有供应能量的功能,而且通过不相关的功能,促进花粉萌发[17]。AtCOX11还参与水稻中COX11同源物的ROS代谢调控[8]。COX11启动子主要活跃在具有高分裂和/或高代谢率的组织,例如胚胎吸收过程中的COX11启动子,在发芽前需要区分、并修复其线粒体所产生的活性氧[18]。所有活跃组织都取决于呼吸链复合物的连续形成,因此需要足够量的组装因子如COX11。在这方面,它类似于与COX功能相关的其他基因的表达模式,例如COX组装因子HCC1(用于同源物铜伴侣SCO1)[19],COX亚基COX5b-1[20]和细胞色素C编码基因CYCT-1和CYCT-2[21]。
BrCOX11基因的表达量在大白菜不同的组织器官中存在明显差异,可能与组织特异性有一定的关系[22-23]。BrCOX11基因在抗根肿病和感根肿病材料以及大白菜地上及地下部分的表达量存在不同,说明该基因的表达量和大白菜是否抗根肿病也有一定的关系。BrCOX11基因的表达量在Ogura雄性不育系Tyms 和Polima雄性不育系22m2、保持系Y231-330中的相对表达量存在不同,在保持系中的相对表达量较高,说明该基因的表达可能与花粉发育及雄性不育有关。
