AGR2对毒胡萝卜素作用下人肺癌NCI-H460细胞增殖及凋亡的影响*
2018-09-27林志国刘振艳皮秀杰王玉凤战文娜李德海邓志会
林志国, 刘 佳, 杜 娟, 刘振艳, 彭 瑶, 皮秀杰, 王玉凤, 战文娜, 李德海, 刘 颖, 邓志会△
(齐齐哈尔医学院 1附属第一医院呼吸内科, 2附属第二医院药剂科, 3医药科学研究院, 黑龙江 齐齐哈尔 161006)
Anterior gradient 2(AGR2)基因是一种具有进化保守性的基因,最先在非洲蟾蜍中发现,局部性表达在原肠胚形成晚期背外胚层前部[1]。人和小鼠的AGR2主要在内胚层来源的器官组织中表达,如肺、气管、胃、结肠、小肠和前列腺等[2]。根据序列同源比对,AGR2属于蛋白质二硫键异构酶家族的成员,该家族蛋白对内质网蛋白中二硫键的正确连接具有重要作用[3]。研究表明,AGR2基因是原癌基因,在多种上皮肿瘤中高表达,如乳腺癌、前列腺癌、胰腺癌、肺癌和结肠癌等,并与肿瘤的发生、恶性转化及转移密切相关[4]。
内质网是细胞内重要的细胞器,调节细胞内蛋白质的折叠与聚集、细胞对应激的反应,同时可识别错误的蛋白折叠,通过蛋白酶体途径将其降解而维持内质网稳态以及细胞正常功能。内质网应激(endoplasmic reticulum stress,ERS)是一些理化因素引起内质网蛋白质折叠障碍,造成未折叠蛋白质在内质网内的堆积,从而引发细胞内一系列自我保护适应性反应[5]。目前研究表明,ERS在肿瘤细胞的发生、发展、浸润、转移及凋亡中发挥着重要作用[6]。毒胡萝卜素(thapsigargin)与内质网上的钙ATP酶结合,致使钙不能通过钙泵进入内质网而降低内质网内的钙储量,从而影响内质网功能引起ERS,是一种常用的细胞ERS诱导剂[7]。本研究以肺癌细胞系NCI-H460为模型,通过毒胡萝卜素诱导ERS,观察AGR2对细胞增殖和凋亡的影响,探讨AGR2在肺癌发生发展以及药物抵抗等方面可能发挥的作用,为AGR2作为肺癌诊疗的分子靶点提供理论基础。
材 料 和 方 法
1 材料
人肺癌细胞NCI-H460和人肾上皮细胞293T均购自国家实验细胞资源共享服务平台。RPMI-1640、DMEM和OPTI-MEM培养基购自Gibco;胎牛血清购自Clark Bioscience;Bradford蛋白质定量试剂盒、质粒小提和大提试剂盒购自天根生化科技有限公司;碘化丙啶(propidium iodide,PI)和毒胡萝卜素购自Sigma;Annexin V-FITC荧光标记抗体购自BD Bio-science;抗AGR2小鼠单克隆抗体和HRP标记的羊抗鼠IgG购自Santa Cruz;转染试剂聚乙烯亚胺(polyethylenimine,PEI)购自Polysciences;引物合成及质粒测序由上海生工生物工程有限公司完成,其它试剂均为国产分析纯。
2 方法
2.1shRNA慢病毒介导的AGR2基因沉默稳定细胞系的建立 (1)靶向AGR2基因的shRNA慢病毒表达载体的构建:应用小干扰RNA(small interfering RNA,siRNA)在线设计软件(http://sirna.wi.mit.edu/)根据AGR2基因序列设计2组针对人AGR2基因的特异性shRNA序列以及对照shRNA(shControl)序列。shControl为5’-CCTAAGGTTAAGTCGCCCTCG-3’;shAGR2(A)为5’-GCCGATATCACTGGAAGATAT-3’;shAGR2(B)为5’-CCTTGAGACTTGAAACCAGAA-3’。通过DNA连接酶将合成的双链DNA连接至线性化载体上,连接产物转化至Stable 3感受态细胞,经菌落PCR筛选出重组阳性克隆后进行测序鉴定。(2)shRNA慢病毒的包装及筛选:以PEI为转染试剂,将鉴定正确的慢病毒质粒与包装质粒混合物(psPAX2和pMD2.G)共转染到293T细胞内。转染3 h后更换完全培养基,转染48 h后,收集含慢病毒颗粒的细胞上清液,0.45 μm滤器过滤,分装后-80 ℃保存备用。胰酶消化处于对数生长期的NCI-H460细胞接种于6孔板,37 ℃、5% CO2培养箱培养。细胞贴壁后加入1 mL病毒液和介导慢病毒转染的终浓度为8 mg/L的polybrene。病毒感染24 h后更换含2 mg/L嘌呤霉素的RPMI-1640培养基,进行阳性筛选,1周后得到稳定传代的细胞克隆。 (3)Western blot检测稳定细胞系中AGR2蛋白的表达:收集各组稳转细胞,提取细胞总蛋白,Bradford法进行蛋白质定量,取30 μg蛋白上样进行SDS-PAGE,常规Western blot操作、ECL发光并于AI600多功能成像系统(GE Heathcare)中成像,并进行灰度值分析。以GAPDH作为内参照,分析目标条带的表达变化。
2.2集落形成实验 取对数生长期的各组稳转细胞,用0.25%胰蛋白酶消化并把细胞悬浮在10%胎牛血清的RPMI-1640培养液中备用。每组取1.5×106个细胞接种于6 cm皿中,37 ℃、5% CO2培养箱培养过夜后,分别更换含有1 μmol/L的毒胡萝卜素药物培养基作用24 h。0.25%胰蛋白酶消化各组加药处理过的细胞,利用Cellometer Mini自动细胞计数仪进行细胞计数,以每孔500个的细胞数分别接种于6孔板中,每组细胞设置3个复孔。将6孔板置37 ℃、5% CO2及饱和湿度的细胞培养箱中培养7~10 d,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。用PBS稀释甲醇配制的0.5%结晶紫至0.1%,染色15 min,流水缓慢洗去染色液,空气干燥,肉眼直接计数。
2.3流式细胞术(Annexin V-FITC/PI双染法)检测毒胡萝卜素诱导的细胞凋亡 采用AnnexinⅤ-FITC/PI双染法进行流式细胞术检测。取对数生长期的细胞以每孔3×105个细胞接种于6孔板中,待细胞80%融合时加入5 μmol/L的毒胡萝卜素作用24 h,然后分别收集各组上清和0.25%胰酶消化后的各组细胞于离心管中。预冷的PBS充分洗涤收集的细胞(4 ℃、1 800×g,5 min), 100 μL结合缓冲液(0.01 mol/L pH 7.4 HEPES、0.14 mol/L NaCl和2.5 mmol/L CaCl2)重悬细胞并使其浓度为1×109/L;向各个细胞悬液样品中加入5 μL Annexin V-FITC和2 μL的PI(100 mg/L)溶液,混匀后于室温避光孵育15 min;每管样品中加入 400 μL结合缓冲液,轻轻混匀后放置冰上,流式细胞仪分析,每个样品检测10 000个细胞。
3 统计学处理
采用SPSS 13.0统计软件进行统计学分析,实验数据以均数±标准差(mean±SD)表示,多组间差异的比较进行单因素方差分析,并用Bonferroni校正的t检验进行各组均数间的两两比较。以P<0.05为差异有统计学意义。
结 果
1 Western blot检测AGR2蛋白的表达
收集筛选出的稳转细胞,提取细胞总蛋白,Wes-tern blot检测AGR2的蛋白表达,以目的蛋白AGR2与GAPDH条带的灰度比值代表AGR2蛋白相对表达量。结果显示,与shControl组细胞相比,shAGR2(A)和shAGR2(B)组基因沉默细胞中AGR2蛋白表达量明显下调(P<0.01),见图1,表明AGR2基因沉默稳定细胞系构建成功。
2 毒胡萝卜素对AGR2基因沉默细胞增殖能力的影响
在未加药处理时,与shControl对照细胞相比,2组AGR2基因沉默细胞的集落形成数没有明显的变化,见图2A;而在毒胡萝卜素作用24 h后,shAGR2(A)和shAGR2(B)组基因沉默细胞的集落形成数和shControl细胞相比明显减少,见图2B(P<0.05)。这些结果表明AGR2基因缺失不影响正常条件下NCI-H460细胞的增殖能力,但在毒胡萝卜素作用下能够显著地降低细胞的增殖能力。
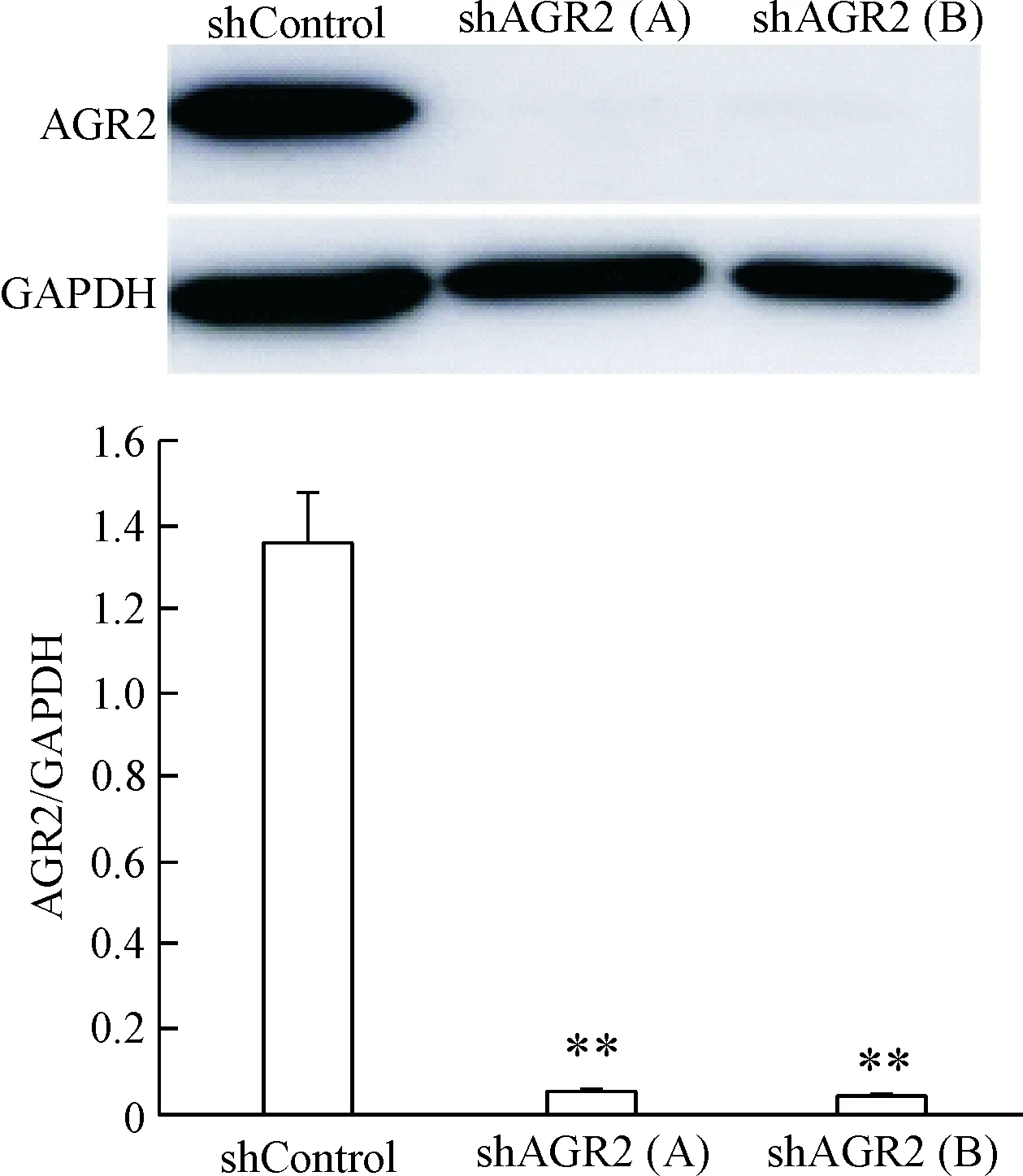
Figure 1. Establishment ofAGR2 gene konckdown cell line. Western blot was used to detect AGR2 expression in stable cells. Mean±SD.n=3.**P<0.01vsshControl group.
图1AGR2基因沉默细胞系的建立
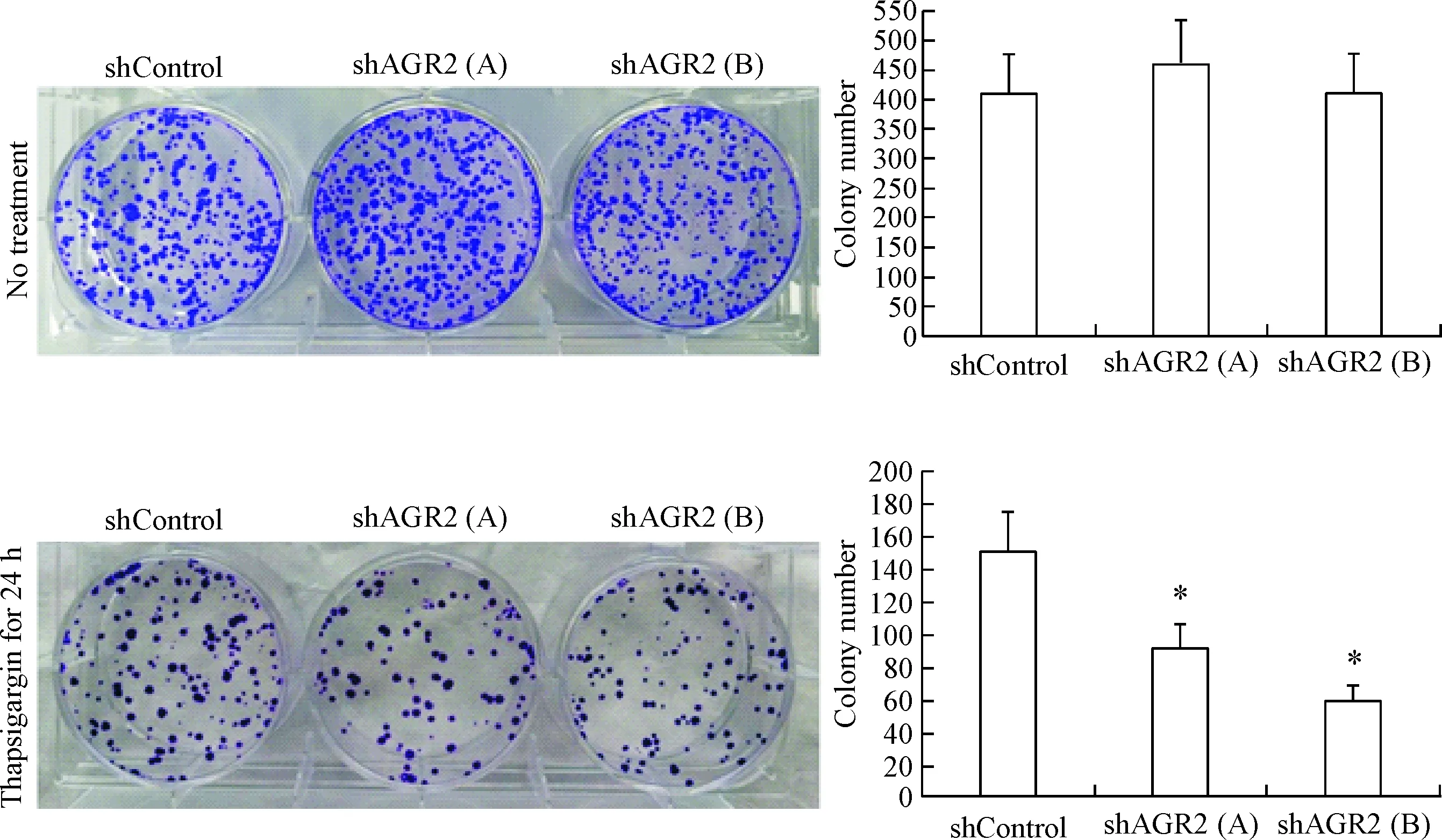
Figure 2. The effect ofAGR2 gene knockdown on proliferation ability of NCI-H460 cells detected by colony formation assay in the absence or presence of thapsigargin. Mean±SD.n=3.*P<0.05vsshControl group.
图2AGR2基因缺失对NCI-H460细胞增殖能力的影响
3 流式细胞术检测AGR2对毒胡萝卜素诱导细胞凋亡的影响
在未加药物处理时,各组细胞的凋亡率(Anne-xin V阳性率)很低,均在5%以内,且各组间的差异无统计学显著性,见图3A;在毒胡萝卜素作用各组稳转细胞系24 h后,shAGR2(A)和shAGR2(B)细胞凋亡率较shControl明显增高(P<0.05),见图3B。这表明AGR2基因缺失使NCI-H460细胞对毒胡萝卜素的作用更为敏感,凋亡率提高。
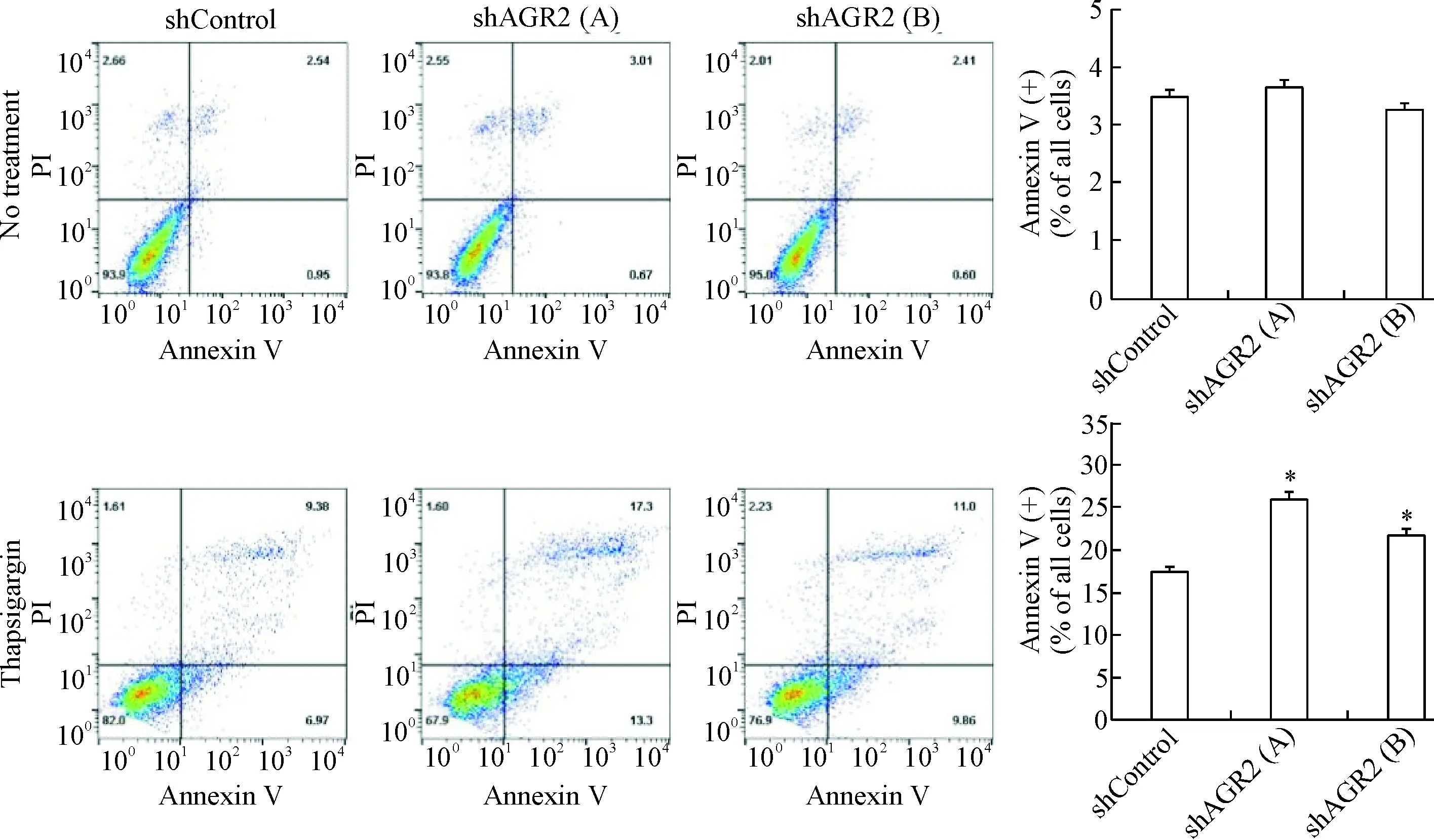
Figure 3. The effect ofAGR2 gene knockdown on apoptosis of NCI-H460 cells detected by flow cytometry in the absence or presence of thapsigargin. Mean±SD.n=3.*P<0.05vsshControl group.
图3AGR2缺失对NCI-H460细胞凋亡的影响
讨 论
肺癌是发病率和死亡率最高的的恶性肿瘤之一。发病率在中国呈上升和年轻化趋势,其死亡率居各类肿瘤的第一位。然而,肺癌的发生及调控机制非常复杂,肺癌细胞易于增殖、侵袭及转移等机制尚未阐明。本项目通过慢病毒介导的shRNA建立AGR2基因沉默稳定细胞系,在毒胡萝卜素诱导ERS后,我们发现AGR2能够增强肺癌NCI-H460细胞的增殖能力,同时降低其诱导的细胞凋亡。这些结果表明在ERS条件下,AGR2具有促增殖以及抗凋亡能力,在肺癌的发生发展、药物抵抗中可能发挥重要作用。
AGR2在非小细胞肺癌中高表达,特别是肺腺癌中高表达。Fritzsche等[8]研究显示,AGR2在66.3%的非小细胞肺癌组织中高表达;Pizzi等[9]通过免疫组化研究表明,在人肺腺癌组织中有30%病例AGR2为中度表达,70%为高度表达;而在人肺鳞癌中55%病例不表达AGR2,33%为弱表达,12%为中度表达。前期研究还显示肺腺癌病人血清AGR2的水平显著高于非肿瘤对照人群,且血清AGR2水平增高与手术后复发和不良预后显著相关[9]。我们检测了5种人肺癌细胞系AGR2的表达情况,包括小细胞肺癌细胞NCI-H446以及非小细胞肺癌细胞H1299、A549(肺腺癌细胞)、NCI-H460(大细胞肺癌细胞)、NCI-H226(肺鳞癌细胞),其中只有NCI-H460细胞中AGR2高表达(结果未显示)。本研究以AGR2高表达的非小细胞肺癌细胞NCI-H460为模型,通过靶向AGR2基因的shRNA慢病毒表达载体的构建、病毒的包装和筛选,建立AGR2基因沉默稳定细胞系,与对照细胞系相比AGR2蛋白表达下降90%以上。为深入研究原癌基因AGR2在内质网应激及肺癌发生发展中的作用,将来还需要在其它高表达AGR2的肺癌细胞中进行验证性研究。
AGR2基因作为一种原癌基因具有促进肿瘤细胞生长、侵袭和转移以及增加细胞存活的能力,但分子机制不十分清楚。AGR2能够通过调节组织蛋白酶B和D的表达促进胰腺癌细胞的侵袭和转移[10]。AGR2在乳腺癌细胞内可调节细胞周期蛋白D1、雌激素受体和存活素的表达促进乳腺癌细胞的生长和存活[11]。Dong等[12]研究显示AGR2通过影响Hippo通路YAP1在细胞核内的定位调控双调蛋白(amphiregulin,AREG)的表达,而AREG是表皮生长因子受体(epidermal growth factor receptor, EGFR)的配体,继而激活AKT磷酸化促进肺癌NCI-H460细胞的增殖;同时发现AGR2与EGFR在内质网内相互结合,促进其成熟使之转移到细胞膜上,调控EGFR的信号转导[13]。研究还发现AGR2可以与低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)结合,AGR2表达增多可以增加HIF-1α的稳定性而延迟其在蛋白酶体的降解,促进氯化钴诱导的新霉素耐药性,促进乳腺癌细胞的存活[14]。AGR2还参与上皮-间充质转化(epithelial-mesenchymal transition,EMT)的发生,促进肿瘤细胞的恶性转移[15]。我们的研究结果显示AGR2能够促进毒胡萝卜素作用下的肺癌细胞抗凋亡及增强存活的能力,具体的分子机制可能与上述提及的Hippo、EGFR-AKT及HIF-1α等通路相关。
研究表明,AGR2既分布在细胞内,又分布在细胞外。AGR2是一种分泌型蛋白,细胞外AGR2与细胞膜受体C4.4A相互作用[2],AGR2-C4.4A单克隆抗体能够降低胰腺癌细胞的生长和转移,从而提高胰腺癌细胞异种移植小鼠的存活率[16]。最新研究结果显示,细胞外AGR2与血管内皮生长因子和成纤维细胞生长因子2结合,并促进这些因子的同二聚体形成而使其活性增加,AGR2单克隆抗体能够降低内皮细胞的迁移及成纤维细胞的纤维化[17]。AGR2也是一种内质网蛋白,其羧基端具有KTEL序列与内质网内KDEL样受体结合,使其定位在内质网内并维持其稳定[18];在ERS条件下促进AGR2表达并参与胰腺癌的早期发生[19]。AGR2与ERS反应关键蛋白葡萄糖调节蛋白78相互作用,维持ERS反应通路的活化,增强细胞的存活能力[20]。我们的研究结果显示AGR2可以促进ERS状态下NCI-H460细胞的增殖以及抗凋亡作用。尽管这些结果不能说明AGR2发挥功能的具体途径,但提示AGR2能够在ERS状态下促进内质网功能的稳定,有利于肿瘤细胞在复杂的生长微环境中生长以及在抗肿瘤药物作用下的存活,进一步证实AGR2在肺癌发生发展及药物抵抗中发挥的重要作用,为AGR2作为肺癌早期诊断、治疗、药物研发新的分子靶点提供理论基础。
