Mito-cpYFP cDNA转基因小鼠的建立及其自由基分布规律的初步探讨*
2018-09-27郭静科刘树滔周建武柯李晶饶平凡
戴 优, 郭静科, 陈 琦, 刘树滔, 周建武, 柯李晶, 饶平凡△
(1浙江工商大学中国科学院上海生命科学研究院-浙江工商大学食品营养科学联合研究中心, 浙江 杭州 310012; 2福州大学生物科学与工程学院, 福建 福州 350108)
材 料 和 方 法
1 实验动物
SPF级C57BL/6小鼠、昆明小鼠及ICR鼠均由浙江省医学科学院实验动物中心提供,雌雄不限,6~8周龄,控光(12 h 明暗相间),自由饮水和采食。所有操作均符合伦理学要求。
2 主要试剂
DNA Marker (Thermo Fisher Scientific);琼脂糖(Bio-west); Premix Taq DNA Polymerase和反转录试剂盒(TaKaRa); Triton X-100和Trizma® hydrochloride solution (Sigma); Proteinase K (Merck); Tris (Bio Basic); RNA和DNA提取试剂盒(上海生工);RIPA裂解液(碧云天);抗GAPDH抗体(Cell Signaling Technology);其余生化试剂均为进口或为国产分析纯。所用引物序列见表1。

表1 引物序列
RGS7: regulator of G-protein signaling 7; F: Forward; R: Reverse.
3 主要方法
3.1Mito-cpYFP基因表达质粒的构建 本实验使用的质粒为pRP(Exp)-CAGG>mito-cpYFP,由福州大学生物工程研究所赠送。质粒图谱信息见图1,其中mito-cpYFP cDNA全长为810 bp[10]。

Figure 1. Structure map of pRP(Exp)-CAGG>mito-cpYFP vector. f1 ori: origin of f1 phage replication; Ampicillin: sequence of ampicillin resistance gene; pUC ori: origin of plasmid; SV40 pA: sequence of simian vacuolating virus 40 polyA sequence; Kozak: Kozak consensus sequence; CAGG: promoter sequence.
图1载体pRP(Exp)-CAGG>mito-cpYFP的图谱
3.2mito-cpYFP cDNA转基因小鼠的建立 取6周龄体型健硕的C57BL/6母鼠,注射孕马血清促性腺激素,48 h后注射人绒毛膜促性腺激素,随后与公鼠合笼交配。次日检查母鼠阴栓,有阴栓者作为供体母鼠,取其受精卵进行体外培养;与此同时,将输精管结扎成功的6周龄ICR公鼠与母鼠合笼,次日检查母鼠阴栓,有阴栓者作为代孕鼠。待受精卵出现大而清晰的原核时,通过显微注射将含有目的基因片段的质粒注射入体外培养的受精卵内。将注入质粒后存活良好的受精卵注射入代孕鼠的输卵管中,每只代孕鼠移植30枚左右的受精卵。待代孕鼠移植19~20 d后自然生产。
3.3转基因小鼠基因型的鉴定
3.3.1DNA的鉴定 取新生3周的小鼠尾巴约5 mm组织提取DNA,采用巢式PCR法进行PCR鉴定,使用的引物为表1中的cpYFP-1和RGS7。PCR反应条件为:94 ℃预变性3 min;随后94 ℃变性30 s,60 ℃退火35 s,72 ℃延伸35 s,38个循环;扩展72 ℃ 5 min。取得产物后,用1.5%的琼脂糖凝胶进行电泳,溴化乙啶染色后于凝胶成像系统中观察结果。
3.3.2mRNA的鉴定 同3.3.1步骤,对子代小鼠mRNA进行提取,并进行RT-PCR鉴定。为保证目的基因(mito-cpYFP)鉴定的准确率,本文设计了2对引物,分别为cpYFP-1和cpYFP-2,序列见表1。反应条件与DNA扩增条件相同。获得产物后,置于1.5%的琼脂糖凝胶中进行电泳,用凝胶成像系统采集图像并观察结果。
3.4mito-cpYFP cDNA转基因小鼠的荧光鉴定与分布 mito-cpYFP被氧化后,在488 nm的激发光照射下,可产生525 nm的绿色荧光。利用该特点,对经PCR及RT-PCR鉴定为阳性的新生F0代转基因小鼠进行荧光观察。鉴定是否出现荧光及荧光在其体内的分布情况。
结 果
1 F0代转基因小鼠的制备
将受精卵移植入17只8周龄的发情ICR母鼠的输卵管内,待其自然生产。孕期结束后共产下80只新生幼鼠,受孕率为100%,其中,4只具有繁殖能力,采用与野生型小鼠交配的策略,目前已繁殖到F3代。
2 转基因小鼠的鉴定
2.1F0代mito-cpYFP cDNA转基因小鼠的PCR鉴定 用上文提及的引物及方法,提取F0代小鼠的DNA进行PCR鉴定,结果如图2所示,共有8只小鼠的PCR扩增产物出现250 bp的目标条带,即有8只F0代小鼠为PCR阳性小鼠,mito-cpYFP的基因序列被成功转入这8只小鼠的基因组内。

Figure 2. Identification of positive F0 generation mice by PCR. 2, 19, 33, 39, 45, 47 and 64: the numbers of transgenic mice of F0 generation; M: DNA marker; P: positive control; WT: wild-type mice; H2O: the solution in this experiment.
图2F0代PCR阳性小鼠的鉴定结果
2.2F0代mito-cpYFP cDNA转基因小鼠的RT-PCR鉴定 用本文设计的RT-PCR引物及方法,提取鼠尾组织的mRNA,逆转录为cDNA后,使用1.5%的琼脂糖凝胶进行PCR鉴定,结果见图3。F0代小鼠中,有7只小鼠出现了本文所设计的2个目标条带,即转入的目的基因序列已在F0代转基因鼠体内表达出相应的mRNA及蛋白。

Figure 3. Identification of positive F0 generation mice by RT-PCR. 2, 19, 33, 39, 45, 47 and 64: the numbers of transgenic mice of F0 generation; WT: wild-type mice; cpYFP-1: the first target gene; cpYFP-2: the second target gene; GAPDH: the reference gene.
图3F0代PCR阳性小鼠的鉴定结果
3 转基因小鼠的荧光观察
根据mito-cpYFP被氧化后,在488 nm激发光照射下,可产生525 nm绿色荧光的特点,我们对DNA与mRNA鉴定均为阳性的转基因小鼠进行荧光观察,同时观察荧光分布。转基因阳性小鼠的荧光现象与昆明小鼠有明显差异。如图4~6所示,白色小鼠为昆明小鼠,黑色小鼠为转基因阳性小鼠。图4中,昆明小鼠的腹腔内无荧光,转基因小鼠腹腔内有荧光出现,荧光较强的部位主要集中在肠道、耻骨联合部及膀胱等部位,肾脏及肝脏则出现较弱的荧光。
如图5A所示,对二者的胸腔进行解剖,发现胸腔均无荧光,同时耻骨联合部及膀胱的荧光消失,此时距腹腔解剖出现荧光的时间间隔约为0.5 h。其中,转基因阳性小鼠的胸腺及因解剖而造成的伤口处有较弱的绿色荧光,见图5B。

Figure 4. The image of abdominal anatomy. The fluorescence in intestines was stronger than that in kidney and liver.
图4腹腔解剖对比图
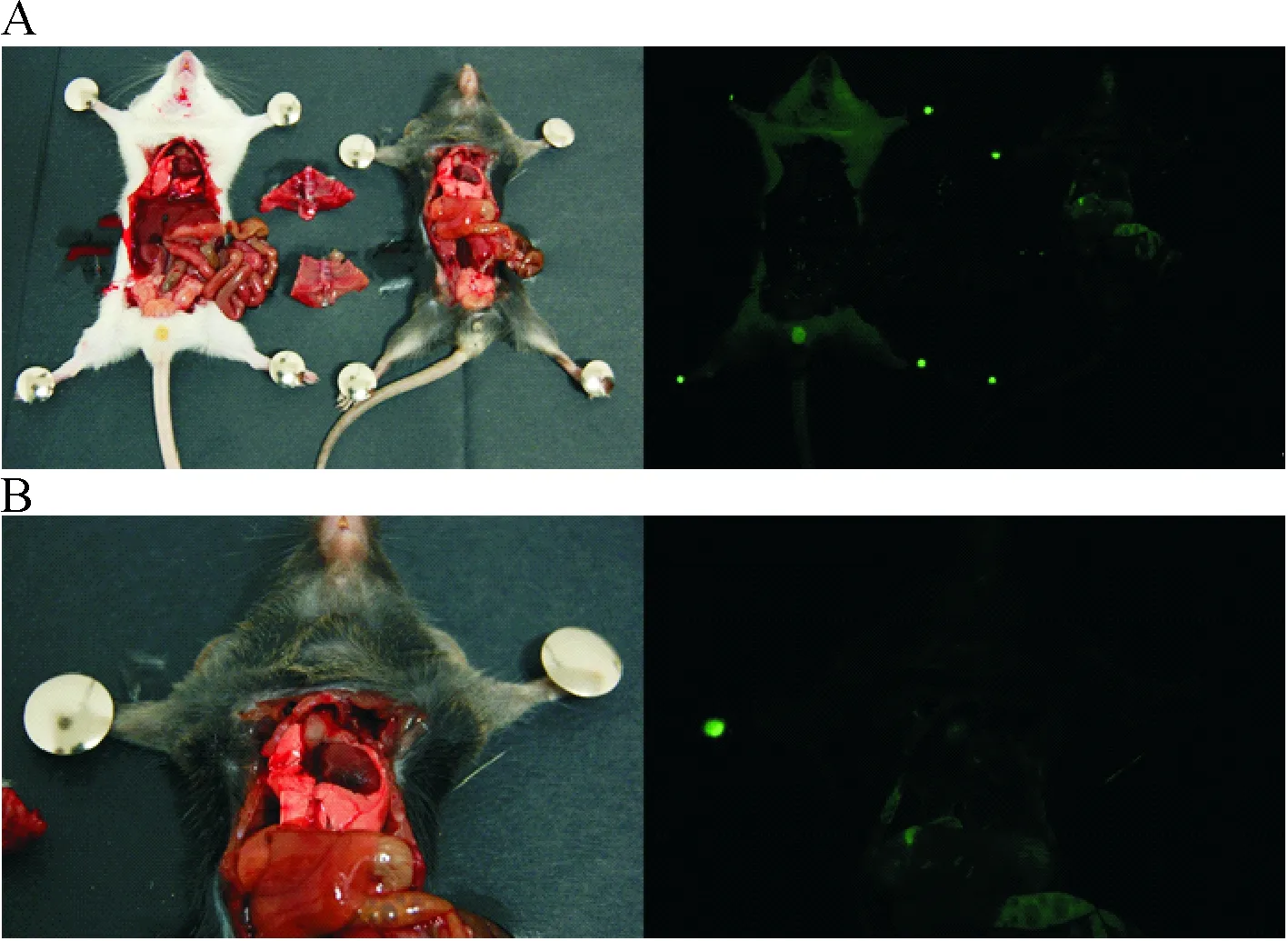
Figure 5. The images of thoracic anatomy. A: anatomized chests; B: enlarged chest of the transgenic mouse. The fluorescence of wound was weak.
图5胸腔解剖对比图
实施脑部解剖观察,转基因阳性小鼠的颅内出现荧光,如图6所示。对二者的口腔进行解剖发现,转基因阳性小鼠的口腔黏膜出现绿色荧光,见图7。

Figure 6. The image of anatomy of the brain. The fluorescence was observed in the brain.
图6脑部解剖对比图

Figure 7. The image of oral cavity anatomy. Green fluorescence in oral mucosa was intense.
图7口腔解剖对比图
讨 论
目前,不乏将cpYFP作为自由基探针用于构建动物模型,特别是构建哺乳动物模型的实验团队,他们都取得了较为显著的进展,如Ding等[11]认为由cpYFP引起的“超氧炫”现象可作为测量胰岛素抗性应激的唯一生物学指标;Cao等[5]发现,无论是在体内还是体外,软骨组织中促炎因子均可刺激细胞产生更多的自由基参与炎症反应,这对炎症的治疗方案有着重大意义。