1-甲基环丙烯对采后南果梨果实软化的影响
2018-09-26张梦媛吕静祎葛永红王文辉张俊虎李灿婴励建荣
张梦媛,白 琳,吕静祎,*,葛永红,王文辉,张俊虎,李灿婴,孟 坤,励建荣,*
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工与安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.中国农业科学院果树研究所,辽宁 兴城 125100)
南果梨是秋子梨系(Pyrus ussriensis Maxim)中的一种优良品种,属辽宁省特色水果,果实采收时色绿、肉脆质硬、汁少味甜、无香气。采后适当后熟,果色金黄艳丽、带红晕,香气诱人,肉质细腻,汁液丰富,酸甜适口,品质极佳,深受消费者青睐[1]。然而,南果梨采后常温贮藏过程中软化快,贮藏时间短,对果实的长期贮藏和远运销售造成了困扰。
南果梨属于呼吸跃变型水果,具有明显的呼吸和乙烯释放高峰,果实完熟后即逐渐衰老腐烂[2]。乙烯是一种成熟激素,其与跃变型果实成熟衰老息息相关[3]。研究表明,呼吸跃变型果实在成熟软化阶段,内源乙烯大量积累[4]。对苹果[5]、番木瓜[7]及猕猴桃[8]的研究显示,外源乙烯处理能够加速采后果实的成熟软化进程。可见,乙烯与果实的成熟软化密切相关。1-甲基环丙烯(1-methylcyclopropene,1-MCP)是乙烯作用抑制剂,能有效延长跃变型果实的贮藏时间,抑制软化与成熟[6-7]。据报道,1-MCP处理能够有效延缓油桃[9]、软枣猕猴桃[10]及番木瓜[11]等果实采后软化速度,延缓纤维素、果胶等细胞壁物质降解,抑制淀粉酶(amylase,AM)、纤维素酶(cellulase,Cx)、果胶甲酯酶(pectinmethylesterase,PME)及多聚半乳糖醛酸酶(polygalacturonase,PG)等软化相关酶活力,提高贮藏品质,从而延长保鲜期。对南果梨的研究表明,1-MCP处理能够抑制果实后熟,延长贮藏期[12],但目前关于1-MCP如何调控南果梨果实采后软化的研究极少。本实验以采后南果梨果实为材料,研究1-MCP处理对其常温贮藏过程中软化的影响,为研究南果梨果实的软化机理提供依据,也为进一步从分子水平研究其软化规律提供参考。
1 材料与方法
1.1 材料与试剂
供试材料南果梨于商业采收期(2016年9月4日)采自辽宁省锦州市廉政文化景区一商业果园。随机从100 棵南果梨树上选取位置、大小、成熟度一致,无病虫害和机械损伤的果实,纸箱包装当天运回辽宁省食品安全重点实验室进行处理。
1-MCP购自陕西咸阳西秦生物科技有限公司,有效质量分数为0.018%。
1.2 仪器与设备
BCD-102D型冰箱 广州万宝集团冰箱有限公司;JA5003电子天平 上海舜宇恒平科学仪器有限公司;HH-4A单列单控四孔水浴锅 常州国宇仪器制造有限公司;ZBS-20商用制冰机 上海安亭科学仪器厂;722N可见分光光度计 上海精密科学仪器有限公司;UV-2550紫外-可见分光光度计 日本岛津公司;GY-3指针式水果硬度计 浙江托普仪器有限公司;Legend Micro21R冷冻离心机 美国Thermo公司;SP-9890气相色谱仪 山东鲁南瑞虹仪器公司。
1.3 方法
1.3.1 1-MCP处理
将南果梨果实分为两组,进行如下处理:第一组用1 μL/L 1-MCP密闭熏蒸24 h;第二组作为对照,不进行任何处理,密闭24 h。每个处理均重复3 次,每重复90 个果实。处理后的南果梨果实放进纸箱常温(23±1)℃贮藏,每4 d随机取12 个果实,进行果实硬度和乙烯释放量的测定,另取10 个果实用液氮速冻,贮存于—80 ℃用于其他指标的测定。
1.3.2 指标的测定
1.3.2.1 硬度的测定
采用GY-3型果实硬度计测定,探头直径为5 mm。在每个果实的赤道部位去皮后,呈120°角取3 个点进行测定,取平均值,单位为kg/cm2。
1.3.2.2 乙烯释放量的测定
每组随机挑选4 个果实,放到1 000 mL的密闭容器内,常温密闭1 h后,抽取1 mL气体,使用SP-9890气相色谱仪测定。色谱条件为:氢离子火焰检测器,温度140 ℃;转化炉温度350 ℃;不锈钢填充柱,柱温120 ℃;载气为高纯N2,流速55~58 mL/min,燃气为高纯H20.05 MPa,空气泵0.1 MPa。乙烯释放量以µL/(kg·h)表示[13]。
1.3.2.3 MDA含量的测定
丙二醛(malondialdehyde,MDA)的含量采用硫代巴比妥酸法测定[14],单位以nmol/g表示。
1.3.2.4 纤维素质量分数与Cx活力的测定
纤维素质量分数参照许颖等[15]的酸性洗涤法测定,以每克果实组织(鲜质量)所含纤维素的质量表示。Cx活力以每小时每克果实组织样品(鲜质量)在37 ℃催化羧甲基纤维素水解形成还原糖的质量表示,即mg/(h·g)。
1.3.2.5 果胶质量分数、PG及PME活力的测定
咔唑比色法测定南果梨果实中果胶质量分数[14]。果蔬中果胶的质量分数以每克果实(鲜质量)生成半乳糖醛酸的质量表示。采用比色法进行测定PG活力[14],以每小时每克果实组织样品(鲜质量)在37 ℃催化多聚半乳糖醛酸水解生成半乳糖醛酸的质量表示,即mg/(h•g)。PME活力参照Vicente等[16]的方法并作改进,测定其在620 nm波长处1 min内的变化,以每分钟每克果实组织样品吸光度变化0.01为1 个活力单位,单位为U/g,结果以鲜质量计。
1.3.2.6 淀粉质量分数与AM活力的测定
根据曹建康等[14]的方法测定。制作标准曲线,再根据测得的吸光度,查出相应的葡萄糖质量,计算南果梨果实组织中淀粉的质量分数。AM活力以每分钟每克果实(鲜质量)中酶催化作用下产生的麦芽糖的质量表示,即mg/(min•g)。
上述各项指标均重复测定3 次。
1.4 数据分析
采用Excel 2010软件对数据进行分析与作图,并用SAS 8.0软件进行方差分析(ANOVA)和相关性分析。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 1-MCP处理对南果梨果实贮藏过程中硬度的影响

图1 1-MCP对南果梨果实硬度的影响Fig. 1 Effect of 1-MCP treatment on firmness of Nanguo pear fruits
硬度是反映果实软化程度的重要指标,呼吸跃变型果实成熟期间硬度变化显著[17]。由图1可知,在贮藏过程中南果梨的硬度随贮藏时间的延长不断降低。1-MCP处理后果实的硬度下降速率缓慢,硬度整体高于对照组果实。在第16天,对照组果实的硬度为3.57 kg/cm2,商业价值较低。在第20天,对照组果实极软,硬度已检测不到;而1-MCP处理组果实此时硬度为13.25 kg/cm2,相对于采样当天下降了29.1%(P<0.05)。在第32天,1-MCP处理组南果梨的硬度为6.05 kg/cm2,正适合食用[18]。整体来看,1-MCP处理组果实硬度在贮藏第12~20天内极显著高于对照组(P<0.01)。由此可见,1-MCP处理明显延缓了南果梨果实的软化,较好地保持了果实的硬度。
2.2 1-MCP处理对果实贮藏过程中乙烯释放量的影响

图2 1-MCP处理对南果梨果实乙烯释放量的影响Fig. 2 Effect of 1-MCP treatment on ethylene production of Nanguo pear fruits
由图2可知,南果梨贮藏期间,对照组果实和1-MCP处理组果实乙烯释放量均呈现先上升后下降的趋势。在第12天,对照组果实的乙烯释放量达到最高,峰值为74.36 µL/(kg·h),而1-MCP处理组南果梨果实则检测不到乙烯。在第32天,1-MCP处理组南果梨乙烯释放量达到了高峰,比对照组果实推迟了20 d。由此可见,1-MCP处理推迟乙烯释放高峰出现的时间,并在贮藏前20 d内抑制乙烯的生成。
2.3 1-MCP处理对南果梨果实贮藏过程中MDA含量的影响

图3 1-MCP处理对南果梨果实MDA含量的影响Fig. 3 Effect of 1-MCP treatment on MDA content of Nanguo pear fruits
MDA含量反映了果实组织的膜脂氧化程度[19]。对照组和1-MCP处理组的南果梨果实MDA含量均随着贮藏时间延长呈上升趋势,其中1-MCP处理组果实的MDA含量整体低于对照组(图3)。在第24天,1-MCP处理组果实的MDA含量比对照组低57.8%(P<0.05),与采样当天相比,1-MCP处理组果实MDA含量升高了1.32 倍(P<0.01),而对照组果实MDA含量升高了4.48 倍(P<0.01)。可知,1-MCP处理组果实MDA含量增加缓慢,表明1-MCP处理抑制了果实MDA含量的积累,保持了细胞膜的完整性。
2.4 1-MCP处理对果实纤维素质量分数和Cx活力的影响

图4 1-MCP处理对南果梨果实纤维素质量分数(A)和Cx活力(B)的影响Fig. 4 Effect of 1-MCP treatment on cellulose content (A) and Cx activity (B) of Nanguo pear fruits
由图4A可知,在南果梨成熟软化过程中,对照组和1-MCP处理组果实的纤维素质量分数均呈现下降趋势。贮藏第4~24天内,1-MCP处理组果实纤维素质量分数高于对照组。在第24天,1-MCP处理组果实纤维素质量分数为32.0%,是对照组(12.9%)的2.48 倍。可见,1-MCP处理可抑制南果梨果实采后贮藏过程中纤维素的降解。
Cx可以促进纤维素分解,纤维素降解则意味着果实细胞壁解体,最终会导致果实软化[20]。如图4B可知,随着贮藏时间延长,Cx活力呈现先上升后下降的趋势。对照组果实的酶活力高峰出现在第16天,而1-MCP处理组果实酶活力高峰则出现在第32天,比对照组果实推迟了16 d。在第16天,对照组果实的Cx活力达到最高值,为1.073 mg/(h·g),而1-MCP处理组果实Cx活力只有0.172 mg/(h·g),仅为对照组果实的16.0%(P<0.01)。由此可知,1-MCP处理可推迟南果梨Cx活力高峰的出现,并在贮藏前20 d内抑制其活力。
2.5 1-MCP处理对南果梨果实贮藏过程中果胶质量分数的影响

图5 1-MCP处理对南果梨果实原果胶(A)和可溶性果胶(B)质量分数的影响Fig. 5 Effect of 1-MCP treatment on protopectin (A) and soluble pectin (B) contents of Nanguo pear fruits
果胶是构成细胞壁的主要成分,果实采后贮藏过程中果胶的降解能够反映果实的软化进程[21]。如图5A、B所示,在整个贮藏期间,1-MCP处理组果实和对照组果实的原果胶质量分数逐渐下降,可溶性果胶质量分数持续上升。由图5A可知,在贮藏第8~24天内,1-MCP处理极显著抑制了原果胶质量分数的下降(P<0.01);由图5B可知,在整个贮藏期间,1-MCP处理极显著抑制了可溶性果胶质量分数的升高(P<0.01)。可见,1-MCP处理能有效抑制南果梨果实中原果胶的降解,延缓可溶性果胶的生成,这与杨艳萍等[22]研究库尔勒香梨的结果一致。
2.6 1-MCP处理对果实果胶酶活力的影响
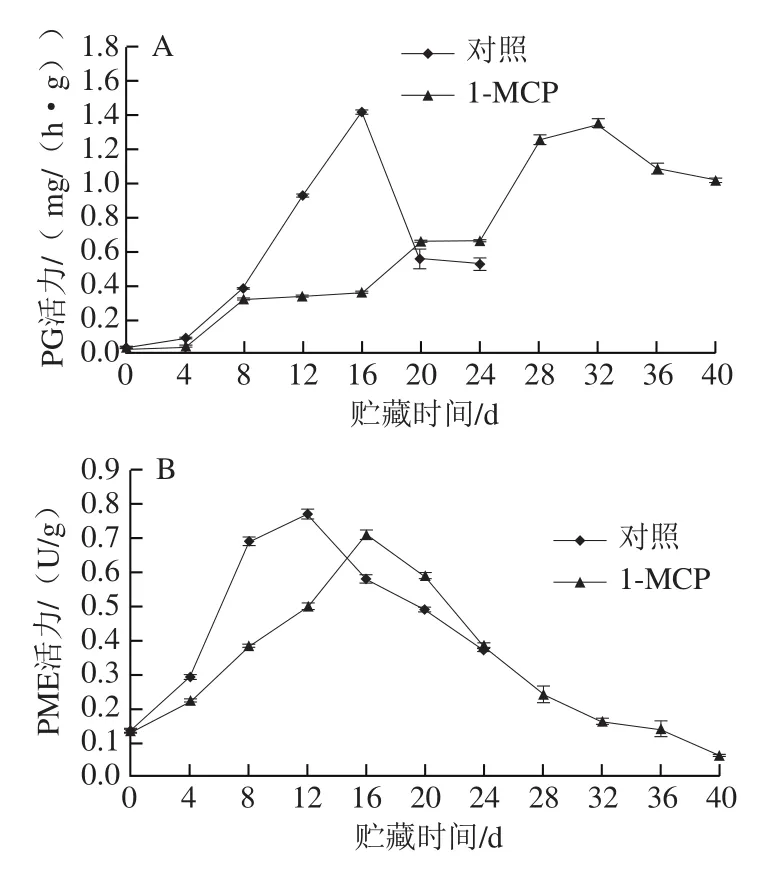
图6 1-MCP处理对南果梨果实PG(A)和PME(B)活力的影响Fig. 6 Effect of 1-MCP treatment on PG (A) and PME (B) activity of Nanguo pear fruits
PG将果实细胞壁多糖中多聚半乳糖酸降解为半乳糖醛酸,使细胞壁结构解体,导致果实软化[20]。如图6A所示,对照组和1-MCP处理组果实在采后后熟软化的过程中,PG活力呈现先上升后下降的趋势,在贮藏第12~16天内,1-MCP处理组南果梨果实PG活力显著低于对照组(P<0.05)。在第16天,对照组果实的PG活力达到最高,为1.415 mg/(h·g),1-MCP处理组果实PG活力则在第32天达到最高,为1.345 mg/(h·g),比对照组推迟了16 d。由此可知,1-MCP处理推迟了南果梨果实PG活力高峰的出现,降低了其峰值,但峰值差异不显著。
PME能够作用于果胶半乳糖醛酸残基,使果胶部分脱去甲氧基,催化果胶酯酸转化为果胶酸,生成适合PG作用的底物[23]。南果梨果实PME活力随贮藏时间的延长呈现先上升后下降的趋势(图6B)。在贮藏第4~12天内,1-MCP处理组果实的PME活力显著低于对照组(P<0.05)。第12天,对照组果实的PME活力达到最高,即0.77 U/g,而1-MCP处理组果实的PME活力在16 d时达到最高,即0.71 U/g,比对照组推迟了4 d。由此可知,1-MCP处理可抑制南果梨果实贮藏早期的PME活力,推迟PME活力高峰的出现,并降低其峰值。
2.7 1-MCP处理对南果梨果实贮藏过程中淀粉质量分数和AM活力的影响
淀粉在细胞中以淀粉粒状态存在,对细胞起着支撑作用,当淀粉被AM水解为可溶性糖后,淀粉对细胞的支撑作用下降,导致果实软化[24]。由图7A可知,随着贮藏时间的延长,对照组和1-MCP处理组果实的淀粉质量分数变化趋势基本一致,1-MCP处理组果实淀粉质量分数整体高于对照组。在贮藏第16天后,对照组果实淀粉质量分数下降迅速,而1-MCP处理组果实在贮藏28 d后迅速下降。表明1-MCP处理可以在一定程度抑制南果梨果实中淀粉质量分数的降解。

图7 1-MCP处理对南果梨果实淀粉质量分数(A)和AM活力(B)的影响Fig. 7 Effect of 1-MCP treatment on starch content (A) and AM activity (B) of Nanguo pear fruits
随着南果梨果实的软化与后熟,AM活力逐渐增强,与淀粉质量分数和硬度均呈极显著负相关(P<0.01)。如图7B所示,对照组与1-MCP处理组果实的AM活力均呈现上升的趋势,1-MCP处理组果实AM活力总体低于对照组。在贮藏期第16~24天内,1-MCP处理组果实AM活力显著低于对照组(P<0.05);由此可知,1-MCP处理在贮藏后期抑制了AM活力,从而抑制淀粉降解。
3 讨 论
1-MCP是一种无毒、高效的新型乙烯抑制剂[25],可与细胞膜上乙烯受体结合阻断乙烯信号传导,延缓果实的软化[26]。对‘早魁’梨[27]、鸭梨[28-29]、京白梨[29]、库尔勒香梨[30]及丰水梨[31]等梨果实的研究表明,1-MCP能推迟乙烯高峰出现。本研究显示,1-MCP处理能够有效延缓南果梨果实乙烯高峰的出现,并降低其峰值,与上述研究结果一致。1-MCP处理能够延缓南果梨果实的硬度的下降、MDA含量的上升,这与李江阔等[32]的研究结果一致。
果实软化与细胞壁降解酶催化细胞壁物质降解有关[33]。本研究表明,南果梨采后贮藏过程中,原果胶、纤维素和淀粉质量分数下降,并且均与硬度呈显著正相关(r>0.873,P<0.05)。在第8~16天内,对照组果实硬度迅速下降,同时Cx、PG、PME及AM的活力迅速上升,且均与硬度呈极显著负相关(r>0.852,P<0.01)。由此可见,南果梨果实的软化与原果胶、纤维素、淀粉等细胞壁物质的降解及降解酶活力密切相关。对柿子[34]、李子[35]、番木瓜[36]等果实的研究表明,1-MCP处理能够抑制细胞壁降解酶(PG、PME、Cx)的活力,减缓细胞壁物质(原果胶、纤维素)的降解,从而使硬度下降缓慢,延缓果实的软化衰老,延长果实的贮藏时间。对京白梨的研究发现,1-MCP处理抑制了AM活力的升高[37]。本研究表明,在对照组果实贮藏24d内,与对照组相比,1-MCP处理能够在整个期间抑制PG、Cx活力的升高,延缓纤维素的降解;在早期抑制PME活力的升高,有效抑制原果胶的降解及可溶性果胶的生成;而在后期抑制AM活力的增加及淀粉的降解,减慢了果实的软化速率。
综上所述,1-MCP处理能够有效抑制采后南果梨果实Cx、PG、PME和AM等细胞壁降解酶的活力,减缓纤维素、果胶、淀粉等的降解,保持细胞壁的完整结构,从而可控制果实软化。
