培养液匀浆人参发根抗氧化、抗黑色素瘤作用
2018-09-26郜玉钢何忠梅张连学
王 璐,郜玉钢*,郭 阳,刘 杨,陈 思,臧 埔*,何忠梅,赵 岩,张连学
癌症严重威胁人类健康,每3 例确诊癌症病例中就有1 例是皮肤癌,全世界每年发生200多万例皮肤癌病例,其中恶性黑色素瘤的致死率极高[1-2]。紫外线的辐射是皮肤癌发生的重要因素之一[3]。随着臭氧层的破坏,越来越多的紫外线到达地面,研究表明人体长期暴露在紫外光,尤其是中波紫外线下,会引起皮肤衰老、DNA损伤、光老化甚至癌变[4]。人参皂苷可通过抑制自由基的生成,减少氧化损伤[5],达到抗氧化、抗紫外线、抗肿瘤等作用[6]。但人参及其提取物中的重金属、农药和溶剂残留等会带来安全风险[7],人参生长过程缓慢且大面积占用森林土地,为解决伐林栽参、老参地问题,科研人员以人参茎叶为外植体诱导出人参发根,工厂化生产人参皂苷[8]。目前人参发根研究多集中于发根诱导、培养条件优化、生产次生代谢产物[9],鲜见人参发根对黑色素瘤的作用研究。本实验选择富含人参皂苷成分、而无农药、无重金属、质量稳定的生物反应器人参发状根及其培养液为原料[10],对其进行抗氧化、抗黑色素瘤功效评价,以期为黑色素瘤的预防和治疗提供理论依据。
1 材料与方法
1.1 材料与试剂
人参发根及其培养液由本实验室采用1/2 MS液体培养基,在25 ℃、110 r/min的恒温摇床中继代培养30 d所得。人参(Panax ginseng C. A. Mey.),为吉林抚松4 年生人参。
CuSO4、乙醇 北京化工厂;邻苯二酚紫 上海源叶生物科技有限公司;抗坏血酸、焦儿茶酚 国药集团化学试剂有限公司;总抗氧化能力检测试剂盒、细胞周期试剂盒 碧云天生物技术公司;人黑色素瘤细胞A375 北纳创联生物技术有限公司;DMEM培养基、胰蛋白酶 美国GE公司;胎牛血清 杭州四季青生物工程材料有限公司;细胞凋亡试剂盒 美国BD公司;其他试剂均为国产分析纯。
1.2 仪器与设备
LC-2010A高效液相色谱仪(配有LC-2010A型液相色谱泵、LC-2010A型自动进样器、CLASS-VP色谱工作站) 日本岛津公司;Infinite Pro 200全波长酶标仪瑞士TECAN公司;HHS-6s电子恒温水浴锅 余姚市上通温控仪表厂;101A-2E烘箱 上海实验仪器厂有限公司;GXZ智光照培养箱 宁波江南仪器厂;Guava®easyCyte流式细胞仪 德国默克密理博公司;E000327 CO2培养箱 青岛Haier公司。
1.3 方法
1.3.1 细胞培养及样品溶液的制备
于150 mL发根培养瓶中加入50 mL pH 6.0的1/2 MS液体培养基,每瓶接种1 g鲜人参发根,30 d继代培养1 次,第30天取鲜人参发根10 g与培养液以1∶6(m/V)匀浆,于烘箱中60 ℃烘至质量恒定,待降至室温,置于-20 ℃储存备用,培养液匀浆人参发根用FG表示。
精确称取FG粉、人参粉0.5 g于10 mL离心管中,加入5 mL体积分数70%乙醇溶液超声108 min,离心取上清液,稀释至系列梯度质量浓度,做抗氧化能力测定,其余挥干乙醇,干燥至质量恒定,密封冷藏以备后续实验用。
人黑色素瘤细胞A375用含10%胎牛血清的DMEM培养基,于37 ℃、5% CO2培养箱中培养,液氮中冻存。
醇提的FG、人参(用RS表示)及达卡巴嗪(用DK表示)分别用DMEM培养基溶解后稀释成100、200、400、600、800 µg/mL的含药培养液。
1.3.2 人参皂苷含量的测定
取FG粉0.5 g加入5.0 mL色谱甲醇溶液,室温下超声提取30 min,4 000 r/min离心20 min,取上清液过0.45 µm滤膜备用[11]。每个样品设3 个平行。色谱条件参照本实验室建立的同时测定20 种人参皂苷的方法[12]。
1.3.3 Cu2+螯合能力的测定
取160 μL 0.1 mg/mL CuSO4溶液,加入40 μL 4 mmol/L的邻苯二酚紫溶液,再加入80 μL不同质量浓度的样品溶液后混匀,室温反应20 min后于632 nm波长处测吸光度。以同质量浓度VC作为阳性对照,实验重复3 次[13-14]。螯合率根据下式计算。

式中:Ai为加入样品的反应液吸光度;A0为用醇替代样品的反应液吸光度;A1为样品对照组的吸光度。
1.3.4 PPO活力的测定
准确量取100 µL pH 7.4磷酸盐缓冲液,向其中缓慢加入50 µL 2 mol/L的焦儿茶酚溶液,混匀后,置于37 ℃恒温培养箱预热15 min后加入50 µL各个质量浓度的样品、对照品溶液,于525 nm波长处分别测定第0、0.5、1.0分钟时的吸光度。定义1 min内1 g人参发根样品使A525nm改变0.01为1 个多酚氧化酶(polyphenol oxidase,PPO)活力单位[15]。
1.3.5 总抗氧化能力的测定
根据总抗氧化能力检测试剂盒建立FeSO4·7H2O标准曲线,求出线性回归方程。用试剂盒对人参发根的总抗氧化能力在593 nm波长处进行测定,OD值代入回归方程求出FG的抗氧化能力[16-17]。
1.3.6 流式细胞术检测黑色素瘤细胞A375凋亡
根据细胞凋亡检测试剂盒说明书,将对数期的A375细胞以1×106个/mL,接种于6 孔板内加药孵育24 h收集细胞,加V-FITC孵育15 min取1×104个细胞用配有GuavaSoft 3.1系统的流式细胞仪对每个样品进行分析。
1.3.7 流式细胞术检测细胞周期分布
根据细胞周期试剂盒说明书,将对数期的A375细胞以1×106个/mL,接种于6 孔板内加药孵育24 h收集细胞,于预冷体积分数70%乙醇溶液中4 ℃固定过夜。PI染色后,重悬细胞,37 ℃避光温浴30 min。用配有GuavaSoft 3.1系统的流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况。对细胞DNA含量和光散射进行分析。
1.4 数据分析方法
用SPSS 17.0软件进行ANOVA单因素方差分析,数据用 ±s表示,并进行Duncans’差异显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 FG中人参皂苷含量

表1 FG中20 种人参皂苷单体含量Table 1 Contents of 20 ginsenosides in ginseng hairy root culture

图1 FG高效液相色谱图Fig. 1 High performance liquid chromatogram of ginsenosides in ginseng hairy root culture
如表1、图1所示,采用20 种皂苷含量测定方法对FG进行测定,共检测出13 种人参皂苷。Rg1、Re含量较高,皂苷含量加和值为(0.160 7±0.011 0)%。
2.2 Cu2+螯合能力

图2 FG及VC对Cu2+螯合率Fig. 2 Cu2+-chelating rates of VC and ginseng hairy root culture
如图2所示,VC的Cu2+螯合率先增加后缓慢降低,FG对Cu2+的螯合率随着质量浓度的增大显著增加(P<0.05),其中40 mg/mL时螯合率已达到50.73%,100 mg/mL时螯合率为66.51%,显著高于FG的其他组(P<0.05),虽低于同质量浓度的VC,但差异不显著(P>0.05)。
2.3 FG的PPO活力

图3 多酚氧化酶活力Fig. 3 Polyphenol oxidase activity in the presence of VC or ginseng hairy root culture
如图3所示,在PPO活力测定中VC与FG呈现相同趋势,酶活力随着质量浓度的增加逐步提高,呈现较好的量效关系。在5、10、20 mg/mL时FG活力均显著低于同质量浓度VC(P<0.05),40、60、80、100 mg/mL时FG的PPO活力分别为2.19、3.36、4.66、5.16 U/g,低于同质量浓度VC,但差异不显著(P>0.05)。
2.4 FG的总抗氧化能力

图4 FG总抗氧化能力Fig. 4 Total antioxidant capacity of ginseng hairy root culture
参照总抗氧化能力试剂盒说明书建立FeSO4·7H2O标准曲线,线性回归方程:y=3.169 8x-0.284 97,吸光度在0.13~0.55范围内线性关系良好R2=0.997 2。如图4所示,在发根的总抗氧化能力测定中,随着质量浓度的增大抗氧化能力逐渐增加,除10 mg/mL与20 mg/mL总抗氧化能力差异不显著外,其余各组间均差异显著(P<0.05),当质量浓度升高到100 mg/mL时,FG的总抗氧化能力高达0.877 4 mmol FeSO4/g,显著高于其他组(P<0.05)。
2.5 FG对黑色素瘤细胞A375凋亡的影响



图5 FG对黑色素瘤细胞A375凋亡图Fig. 5 Flow cytometric analysis of apoptosis in A375 cells exposed to ginseng hairy root culture

表2 FG对黑色素瘤细胞A375凋亡的影响Table 2 Effect of ginseng hairy root culture on apoptosis in A375 cells
由图5、表2可知,不同质量浓度(200、400、600 µg/mL)的FG、RS、DK对A375细胞的增殖具有明显的抑制作用,且随药物质量浓度的增加,细胞的抑制率明显增加,呈剂量依赖性。200 µg/mL时FG组的早期凋亡率显著高于RS组、DK组(P<0.05);400 µg/mL时FG组早期凋亡与DK组差异不显著,晚期凋亡与RS差异不显著(P>0.05);600 µg/mL FG组晚期凋亡率显著高于RS组、DK组(P<0.05),RS组与DK组早期凋亡显著高于FG(P<0.05)。
2.6 FG对A375细胞周期的影响

表3 FG对A375细胞周期的影响Table 3 Effect of ginseng hairy root culture on cell cycle in A375 cells
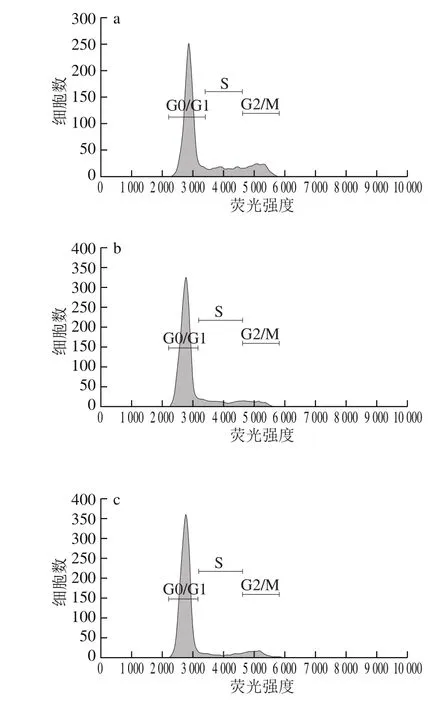
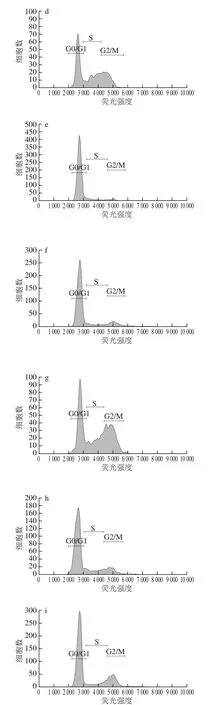

图6 FG对A375细胞周期图Fig. 6 Flow cytometric analysis of cell cycle in A375 cells
如表3、图6所示,200 µg/mL时FG组、DK组与对照组相比G0/G1期细胞比例降低,G2/M期细胞比例增加,说明200 µg/mL时FG、DK可将细胞阻滞在G2/M期。400 µg/mL时与对照组相比,FG组S期细胞比例显著增加,FG、RS、DK组G2/M期细胞比例显著增加,说明400 µg/mL时FG可将细胞阻滞于S、G2/M期,RS、DK可将细胞阻滞于G2/M。600 µg/mL时FG、RS、DK组与对照组相比G0/G1期细胞比例显著降低,S、G2/M期细胞比例显著增加,S期DK细胞比例最高,G2/M期RS细胞比例最高,FG的S、G2/M期细胞比例为29.82%、28.70%,显著高于对照组。说明600 µg/mL时FG、RS、DK可将A375细胞阻滞于S期、G2/M期,进而诱导细胞凋亡。
3 讨 论
人体长期暴露在紫外光下,尤其是中波紫外线,会引起皮肤过敏、衰老、DNA损伤、光老化甚至癌变。黑色素瘤是一种侵袭性皮肤癌,传统疗法对其无效[18]。主要由紫外线辐射使皮肤层产生黑色素,黑色素在合成过程中产生的亲氧化状态使其易受到氧化应激,氧化应激水平升高导致细胞的生长、分裂失控,入侵临近的机体组织而成癌[19]。氧化应激能诱导DNA、蛋白质、线粒体等细胞成分损伤并影响细胞内信号转导途径[20-21]。线粒体为细胞中水平最高的抗氧化剂,在维护细胞的氧化还原状态中起着重要的作用[22]。研究报道黑色素瘤的发生都伴有抗氧化酶活性降低或其表达下调、氧化与抗氧化作用失衡[23-24]。抗氧化酶可保护细胞免受氧化应激损伤,抗氧化酶活性和表达的失调与黑色素瘤发生密切相关,是黑色素瘤发生发展的重要影响因素[25-26]。人参[27-28]、人参发根[29]抗氧化活性显著。而关于FG的抗氧化能力未知,因此选用Cu2+、PPO、总抗氧化能力3 种方法对FG的抗氧化能力进行测定。由实验结果可知随着质量浓度的增大,FG的Cu2+螯合率逐渐接近VC,在100 mg/mL时FG的Cu2+螯合率达到66.5%与VC差异不显著;FG与VC有相同的酶活力清除趋势,大于40 mg/mL时两者差异不显著;FG的总抗氧化能力在100 mg/mL时达到0.877 4 mmol FeSO4/g。
研究发现,中草药提取物产生抗肿瘤作用的主要机制是阻滞细胞周期、诱导细胞凋亡,在肿瘤细胞中细胞周期阻滞能够抑制细胞增殖和诱导细胞凋亡[30]。主要抑制细胞周期蛋白、细胞周期蛋白依赖性蛋白激酶及其抑制因子等3大类与细胞周期有关的分子的表达对细胞进行调控,从而诱导细胞周期阻滞并抑制肿瘤细胞增殖[31]。主要表现为药物作用于细胞干预DNA复制或者造成DNA损伤及有丝分裂所必需的蛋白质合成,细胞周期进程就会发生停滞,若不能及时进行修复,就会抑制细胞增殖,甚至诱导细胞产生凋亡[32]。与对照组相比,FG组、RS组、DK组均出现明显的凋亡细胞,FG组较RS组、DK组晚期凋亡率高,这种作用可能是将皮肤癌细胞周期阻滞在S、G2/M期实现的。人参发根与人参具有相似的化学成分[33-34],可通过减少氧化损伤、阻滞细胞周期进程、诱导黑色素瘤细胞凋亡产生抗皮肤癌作用,其具体促凋亡机制有待进一步研究。综上,人参发根具有抗氧化、抗黑色素瘤作用。本研究为人参发根产品开发提供了理论依据。
