动物鼻式气溶胶暴露装置的运行效果评价
2018-09-26郝新彦向志光
郝新彦,向志光,高 虹
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
动物鼻式气溶胶暴露装置(nose-only inhalation exposure device)是可模拟产生药物、毒物等化学物质及病毒、细菌等病原微生物气溶胶、气体或蒸汽的设备,仅将动物鼻部暴露于设定环境中,使动物吸入含有受试物的空气而达到定量攻毒感染[1- 3]。鼻式气溶胶暴露装置可通过装有细菌、病毒等病原微生物悬浮液的雾化器雾化产生微生物气溶胶,实验动物吸入气溶胶后,在感染过程中避免了消化道、皮肤等其他暴露途径感染,感染方式与自然环境极为相似[1-9]。为使用动物鼻式气溶胶暴露装置进行安全有效的病原微生物气溶胶感染,本实验选择大肠杆菌(Escherichiacoli,E.coli)、鼠肝炎病毒(mouse hepatitis virus)MHV-JHM作为模式微生物,分别代表细菌和病毒,使用此暴露装置发生细菌、病毒气溶胶,探究装置能否正常运行,同时探讨装置运行过程中产生的气溶胶粒径大小、装置气密性、气溶胶在暴露舱内的分布均匀性及消毒剂对装置的消毒效果。
1 材料和方法
1.1 实验材料
菌种、病毒:大肠杆菌(有氨苄抗性,Amp+)、鼠肝炎病毒毒株MHV-JHM毒株均引自中国医学科学院医学实验动物研究所。
1.2 主要试剂与仪器
LB固体培养基(Amp+),LB液体培养基(Amp+),DMEM无血清高糖培养基,RNA提取试剂盒(TaKaRa,9766,北京宝日医生物技术有限公司),一步法RT-PCR试剂盒(TaKaRa,RR064A,北京宝日医生物技术有限公司),硝酸纤维素(NC)膜(Millipore,0.45 μm)。ABI 7500 Real-time PCR扩增仪(USA),动物鼻式气溶胶暴露装置(美国In-TOX P.O.BOX2070,NM505-832-5107):动物鼻式气溶胶暴露装置主要由洁净压缩空气系统、气溶胶输送管路、净化装置(真空泵、高效过滤器)、气溶胶发生装置(Lovelace喷雾器、稀释器、混合器)、48孔鼻式暴露舱、测试动物安置装置(动物固定管)、采样装置(ZR-A02型安德森六级采样器、In-TOX液体撞击采样器)和暴露系统控制柜组成(如图1所示)。
1.3 实验方法
1.3.1 动物鼻式气溶胶暴露装置产生大肠杆菌气溶胶
(1)气溶胶粒径大小评价:将6.5 mL 2 × 109CFU/mL大肠杆菌菌液倒入喷雾器小管内,稀释流量为18.3 L/min,排气流量为20 L/min,维持暴露舱微负压。设置装置在雾化压力为5, 10, 15, 20, 25 PSI下发生气溶胶,安德森六级采样器在总排气管路分别采样20 min。采样平皿于37℃下培养12 h,评价在不同压力下采样气溶胶的粒谱分布。将各级采样平皿采集的气溶胶颗粒按级别分为6组数据,依据偏态分布50%中值直径计算公式算出发生气溶胶总粒子的中值直径。
(2)气溶胶到达暴露舱端口评价:将6.5 mL 2 × 109CFU/mL大肠杆菌菌液倒入喷雾器小管内,稀释流量为18.3 L/min,排气流量为20 L/min,雾化压力为20 PSI,采样流量为2.2 L/min,维持暴露舱微负压,以LB液体培养基作为采样液,液体撞击采样器采样20 min。分别取采样液1 mL涂于两个LB固体培养基上,于37℃下培养12 h,观察采样平皿上是否有菌落生长,评价暴露舱端口是否有气溶胶通过。
(3)气溶胶分布均匀性评价:48孔动物鼻式暴露舱共4层,每层间隔3个端口放置一个固定管(如图2所示),NC膜(1 cm × 1 cm)置于小鼠固定器前端端口处采样20 min。将NC膜放于LB固体培养基上,于37℃下培养12 h,观察NC膜上是否有菌落生长并计数,评价暴露舱各端口是否都有气溶胶到达,气溶胶分布是否均匀。其他参数设置同1.3.1中的(2)。
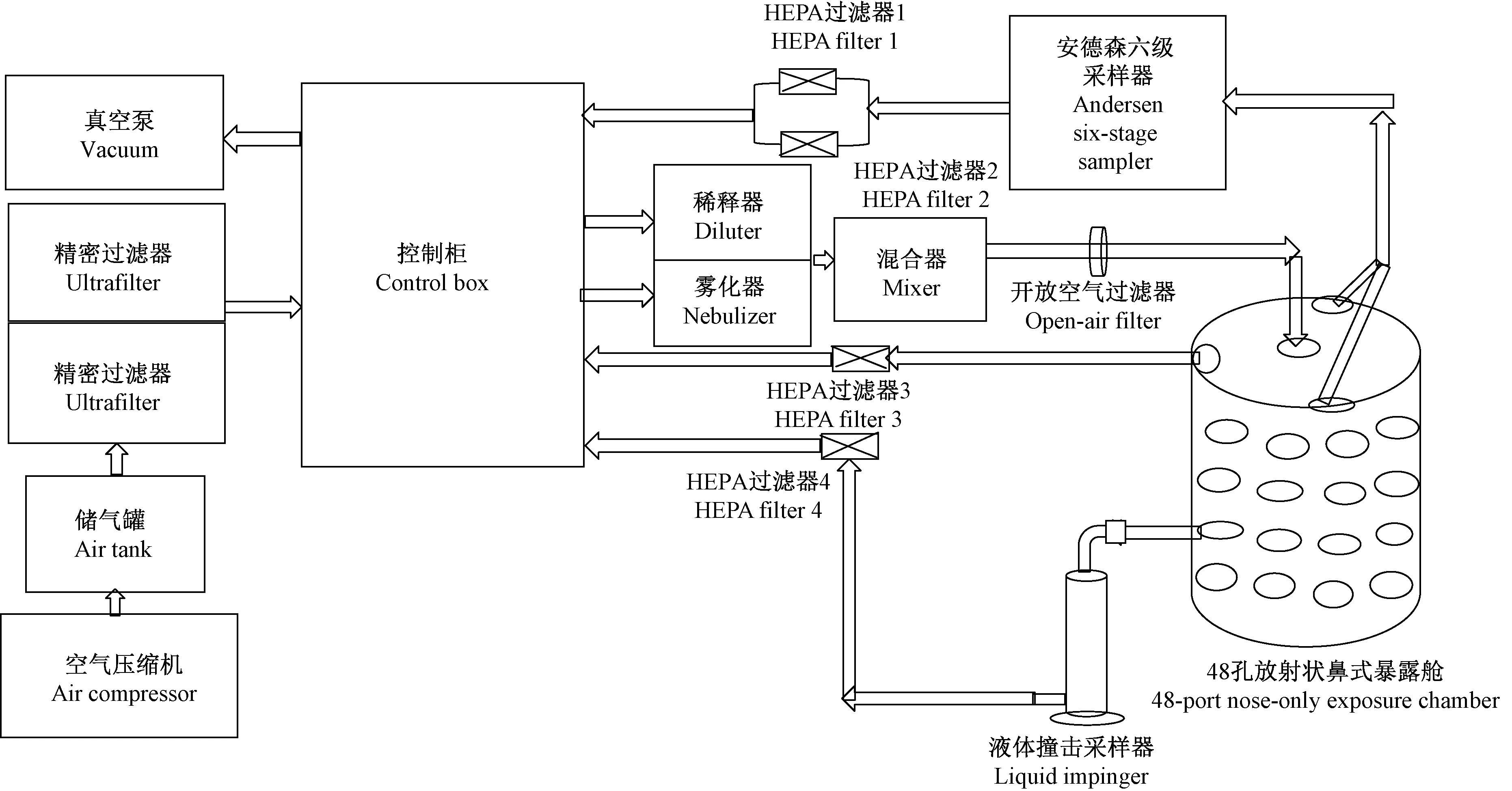
图1 In-TOX鼻式气溶胶暴露系统示意图Figure 1 Schematic figure of the In-TOX nose-only inhalation exposure device
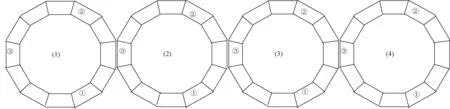
注:图中(1)~(4)分别为暴露舱的从上至下1~4层,在各层①、②、③暴露口放置小鼠固定器,并用NC膜进行采样。图2 48孔鼻式暴露舱各层各端口分布图Note. Figures (1)-(4) are representative of layers 1-4 of the exposure chamber from top to bottom. Animal tubes were placed on port ①, port ②, and port ③ of each layer. The NC membrane placed at the nozzle of animal tubes was used for sampling.Figure 2 Each port of each layer in the 48-port nose-only exposure chamber
(4)装置气密性评价:在进行1.3.1中的(1)、(2)、(3)发生E.coli气溶胶操作时,在暴露装置易发生泄露的6处(雾化器旁、暴露舱上端排气处、安德森六级采样器旁、液体撞击采样器旁、高效过滤器旁、真空泵旁)摆放沉降平皿,沉降20 min。将沉降平皿于37℃下培养12 h,观察沉降平皿上是否有菌落生长,评价暴露装置是否发生气溶胶泄露。
(5)装置消毒效果评价:大肠杆菌气溶胶停止运行后,空运行系统10 min,以排出含有大肠杆菌气溶胶的气体;将8 mL 75%乙醇加入喷雾器小管内,系统运行30 min进行消毒;消毒后空运行系统30 min,以排出含有乙醇的空气。消毒结束后,空运行系统并使用安德森六级采样器采样20 min。采样平皿于37℃下培养12 h,观察平皿上是否有菌落生长,评价在装置产生大肠杆菌气溶胶后,75%乙醇对装置的消毒效果。其他参数设置同1.3.1中的(2)。
1.3.2 动物鼻式气溶胶暴露系统产生MHV-JHM气溶胶
(1)发生MHV-JHM气溶胶:取6.5 mL备好的1.5 × 108拷贝数/mL的MHV-JHM病毒液倒入喷雾器小管内,雾化流量为0.6 L/min,稀释流量为18.3 L/min,排气流量为20 L/min,雾化压力为20 PSI,采样流量为2.2 L/min,维持暴露舱微负压,以DMEM无血清高糖培养基为采样液,液体撞击采样器在暴露舱单个端口采样20 min。收集采样液进行后续RNA提取[1.3.2中的(3)]及一步法RT-PCR检测病毒RNA扩增的荧光值[1.3.2中的(4)]。评价系统是否发生病毒气溶胶,及单个暴露舱端口是否有气溶胶气流通过。
(2)装置气密性评价:待系统停止气溶胶发生后,灭菌棉签采集易泄露的5处(开放空气过滤器处、雾化器小管处、液体撞击采样器处、暴露舱端口处、暴露舱上端进气管路处)MHV-JHM气溶胶。将采样棉签放于DMEM无血清高糖培养基中,对培养基进行后续RNA提取[1.3.2中的(3)]及一步法RT-PCR检测病毒RNA扩增的荧光值[1.3.2中的(4)]。评价装置在运行过程中是否发生气溶胶泄露。
(3)提取RNA:以DMEM无血清高糖培养基作为阴性对照,使用RNA提取试剂盒,按照试剂盒说明书提取气溶胶发生液、采样器采样液及1.3.2第(2)条中所采集样本的RNA,并于-30℃保存备用。
(4)一步法RT-PCR扩增:病毒MHV-JHM一步法RT-PCR的引物、探针由赛默飞世尔科技(中国)有限公司设计并合成,其序列见表1。其中,荧光探针5’端标记为FAM,3’端标记为BQ1。
以1.3.2第(3)条中提取的RNA为模板,以ddH2O设置阴性对照,使用一步法RT-PCR试剂盒,应用ABI 7500 Real-time PCR系统进行荧光定量PCR扩增。反应体系如表2所示,共20.0 μL。RT-PCR反应程序为:反转录反应(42℃,5 min;95℃,10 s),1个循环;PCR反应(95℃,5 s;60℃,34 s),共40个循环。进行病毒RNA检测。
(5)装置消毒效果评价:病毒气溶胶停止运行后,空运行系统10 min,以排出含有病毒气溶胶的气体;将6.5 mL 3%过氧化氢溶液加入喷雾器小管内,系统运行30 min进行消毒;消毒后空运行系统30 min,以排出含有过氧化氢的空气。消毒结束后,空运行系统,以DMEM无血清高糖培养基为采样液,液体撞击采样器在暴露舱单个端口采样20 min。收集采样液进行后续RNA提取[1.3.2中的(3)]及一步法RT-PCR检测病毒RNA扩增的荧光值[1.3.2中的(4)],评价在装置产生MHV-JHM病毒气溶胶后,3%过氧化氢溶液对装置的消毒效果。其他参数设置同1.3.2中的(1)。
2 结果
2.1 气溶胶粒径大小评价结果
由表3和图3可知,在雾化压力为5~25 PSI条件下,安德森六级采样器所采集的气溶胶颗粒主要集中分布在5级(1.1~2.1 μm)、6级(0.65~1.1 μm),中值直径在(1.27±0.61) μm。提示鼻式气溶胶暴露装置能正常运行,产生中值直径为(1.27±0.61) μm气溶胶颗粒。
2.2 气溶胶到达暴露舱端口评价结果
液体撞击采样器采样E.coli气溶胶,取采样液1 mL分别涂两平板,培养后两平板上均有菌落生长,菌落数分别为64、84。ABI 7500 Real-time PCR系统检测到液体撞击器采样样本中的MHV-JHM RNA为阳性(如图4所示)。提示装置能正常运行发生细菌、病毒气溶胶,且产生的气溶胶可以到达暴露舱端口。
2.3 气溶胶分布均匀性评价结果
NC膜上有菌落生长,菌落数均在10左右,计数结果如表4所示,暴露舱各端口菌落数一致。提示产生的气溶胶均到达暴露舱各端口,且气溶胶分布均匀。
表1MHV-JHM病毒RT-PCR扩增引物及荧光探针
Table1Primers and fluorescent probes for RT-PCR of MHV-JHM
探针/引物名称Probe/Primer names序列(5’ → 3’)Sequences (5’ → 3’)MHV-JHM FGGAACTTCTCGTTGGGCATTATACTMHV-JHM RACCACAAGATTATCATTTTCACAACATA探针 ProbeACATGCTACGGCTCGTGTAACCGAACTGT

表2 一步法RT-PCR反应体系Table 2 Reaction system of one-step RT-PCR

表3 安德森六级采样器捕获粒径分布情况及中值直径结果Table 3 Particle size distribution and mass median aerodynamic diameter of aerosol sampled by Andersen six-stage sampler
注:中值直径:P50=L + i/f(50%n - c),其中,L为中位数所在组段的下限;i为该组段的组距;f为中位数所在组段的频数;n为总的累积频数;c为小于L各组段的累积频数。
Note. Mass median aerodynamic diameter (MMAD):P50=L + i/f(50%n - c). In the formula, L: lower limit of group segment with median; i: the group range of the group segment with median; f: frequency of the group segment with median; n: total cumulative frequency; c: cumulative frequency of each group less than L.

注:标号1~5:分别是In-TOX动物鼻式气溶胶暴露系统在雾化压力为5,10,15,20,25 PSI条件下所产生的E. coli气溶胶结果图。第一行(标号1):1-1至1-6分别是雾化压力为5 PSI条件下,安德森六级采样器从1级到6级采样平皿的菌落数;第二行至第五行(标号2~5):每行内各标号与第一行同理,分别是雾化压力为10,15,20,25 PSI条件下,安德森六级采样器从1级到6级采样平皿的菌落数。图3 安德森六级采样器采样气溶胶分布结果Note. Labels 1-5: The distribution of E. coli aerosol sampled by the In-TOX animal nose-only inhalation exposure system under the conditions of 5, 10, 15, 20, and 25 PSI nebulizer pressure. In the first row (label 1), 1-1 to 1-6 represent the numbers of colonies from stage 1 to stage 6 of the Anderson six-class sampler under the condition of 5 PSI nebulizer pressure. For the second to the fifth rows (labels 2-5), equivalent values are presented for nebulizer pressures of 10, 15, 20, and 25 PSI, respectively.Figure 3 The distribution result of aerosol sampled by the Andersen six-stage sampler
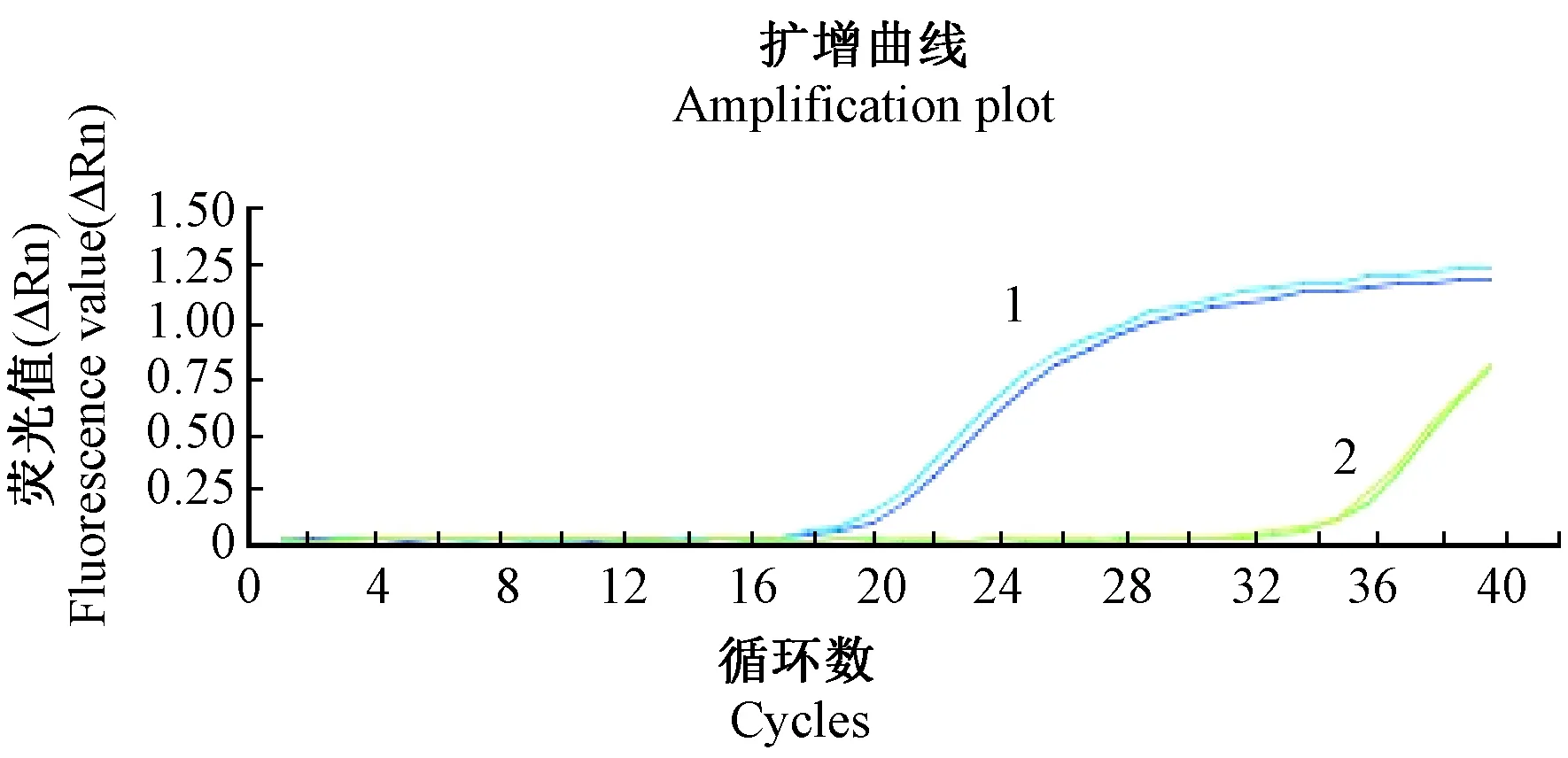
注:1:MHV-JHM病毒发生液;2:液体撞击器采集MHV-JHM病毒气溶胶。图4 实时荧光定量PCR实验Note. 1: MHV-JHM virus liquid; 2: MHV-JHM aerosol sampled by liquid impinger.Figure 4 Test of real-time fluorescence quantitative PCR

暴露舱层数The layer of the exposure chamber暴露舱各层端口 The port of each layer①②③均值Mean1109109.7211101010.3310101110.3410999.3
2.4 装置气密性评价结果
放置在暴露装置易发生泄露部位的6个沉降平板上大肠杆菌菌落计数为0;一步法RT-PCR检测易泄露处(开放空气过滤器处、雾化器小管处、液体撞击采样器处、暴露舱端口处、暴露舱上端进气管路处)采样样本中的病毒RNA为阴性。提示鼻式气溶胶暴露装置在发生气溶胶过程中未发生气溶胶泄露,气密性良好。
2.5 装置消毒效果评价结果
对系统进行消毒后,放置在安德森六级采样器上的6个采样平皿上大肠杆菌菌落计数为0;一步法RT-PCR检测装置进行消毒后的采样样本中的病毒RNA为阴性。表明E.coli气溶胶、MHV-JHM气溶胶分别在75%乙醇、3%过氧化氢运行后可被彻底杀灭,提示使用相应的消毒剂可对系统进行有效的消毒,消毒效果完全。
3 讨论
本实验选择大肠杆菌和鼠肝炎病毒分别代表细菌和病毒发生气溶胶,使用安德森六级采样器、液体撞击采样器、NC膜进行采样。安德森六级采样器采集粒谱范围广、采样效率高、微生物失活率低、敏感性高[10-11],故采样平皿培养后的菌落计数结果明显;液体撞击采样器采样时间通常为1~10 min时采样效率较高[12-13],之前研究表明,采样流量多设置为10 L/min左右[11];但在此鼻式气溶胶暴露装置中,液体撞击采样器所在采样管路本身采样流量小,最大为2.2 L/min,为增加采样量,实验中采样时间长,为20 min,存在微生物粒子撞击时的损伤、微生物粒子逃逸和再次气溶胶化、收集介质蒸发等问题,采样效率低,故采集到的细菌气溶胶经培养后活菌菌落数较少[11, 14]。对液体撞击采样器采集到的病毒气溶胶,使用灵敏度高、高效快速的实时荧光定量RT-PCR法进行检测。本次实验因NC膜易于裁剪、使用方便,故使用NC膜进行采样;LB液体培养基浸润的NC膜(1 cm × 1 cm)放在动物固定管喷嘴处,面积较小,且不宜长时间采样、采样效率低[11],故菌落计数较少。
对于安德森六级采样器1级(> 7.0 μm)、2级(4.7~7.0 μm)相当于人体的鼻、咽、喉等上呼吸道;3~6级相当于人体的下呼吸道:3级(3.3~4.7 μm)相当于人体的气管、支气管,4级(2.1~3.3 μm)相当于人体的二级支气管,5级(1.1~2.1 μm)相当于人体的终末细支气管,6级(0.65~1.1 μm)相当于人体的肺泡[15]。研究表明,气溶胶粒子在人体呼吸器官的沉积分节与其粒子大小有关,5~10 μm的易沉着于气管和支气管,而1~5 μm的粒子可直接侵入肺泡[16-20]。现已评价In-TOX鼻式气溶胶暴露装置能正常运行,产生中值直径为(1.27±0.61) μm的气溶胶颗粒,颗粒大小可直接侵入肺泡,所发生的气溶胶满足气溶胶吸入感染实验的要求;产生的气溶胶可以到达且均匀分布到暴露舱各个端口,运行过程中未发生气溶胶泄露,暴露装置气密性良好,使用相应的消毒剂可对系统进行有效的消毒,消毒效果完全。在实验过程中,用以发生气溶胶的悬浮液用量较少;鼻式暴露舱能同时感染多只动物,安全性、准确性提高,动物鼻式气溶胶暴露装置在微生物气溶胶感染中受到越来越多的关注。本研究为动物鼻式气溶胶暴露装置安全有效地用于实验动物高致病性病原微生物气溶胶的吸入感染研究提供依据。
