注射用二丁酰环磷腺苷钙与转化糖电解质注射液的配伍稳定性及辅助用药管理对策研究*
2018-09-25殷晓芹陈伯华
王 静,王 钦,高 捷,徐 新,殷晓芹,陈伯华
(南通大学附属医院药学部,江苏南通 226001)
二丁酰环磷腺苷钙是一种蛋白激酶激活剂,在体内能激活蛋白激酶A、蛋白激酶C,而蛋白激酶是由2个催化亚基与2个调节亚基构成的别构酶,其中催化亚基能催化多种酶的磷酸化作用[1]。因此,二丁酰环磷腺苷钙能增强心肌中蛋白激酶的活性,可用于急性心肌梗死、心绞痛、心源性休克、心肌炎的辅助治疗,也能用于术后网膜下出血,并能与抗肿瘤药物联合发挥白血病的辅助治疗作用[2-3]。转化糖电解质注射液的主要成分是果糖、葡萄糖及多种人体所需的电解质,在临床中可用于需非口服途径补充水分、电解质或能量的患者的补液治疗[4-5]。由于其中含有果糖和乳酸钠,在临床应用中有可能会出现风疹、脸红、发热等不良反应[6]。
本研究旨在了解注射用二丁酰环磷腺苷钙在转化糖电解质注射液中的稳定性,为临床用药安全和医院辅助用药管理提供实验数据支撑。
1 材料与方法
1.1仪器 1100型高效液相色谱仪(美国Agilent公司),包括四元泵、紫外检测器、手动进样器、色谱工作站、真空脱气机;FRQ-1010HT型超声波清洗机(杭州法兰特超声波科技有限公司);Cary 100 Conc型紫外可见光分光光度计(美国Varian公司);BP211D型电子分析天平(德国Sartorius公司);6178型台式pH /电化学测量仪(美国Jenco公司)。
1.2试药 注射用二丁酰环磷腺苷钙(每瓶20 mg,上海上药第一生化药业有限公司,批号:1608908);转化糖电解质注射液(每袋250 mL,四川美大康佳乐药业有限公司,批号:16050321);5%葡萄糖注射液(每袋250 mL,四川科伦药业股份有限公司,批号:P16071405);0.9%氯化钠注射液(每袋250 mL,四川科伦药业股份有限公司,批号:P17040604);乙腈(色谱纯,国药化学试剂公司);灭菌注射用水(每瓶500 mL,四川科伦药业股份有限公司,批号:M17050811);磷酸二氢钾(分析纯,国药化学试剂公司);二丁酰环磷腺苷钙对照品(湖北拓楚慷元医药有限公司,批号:1612035,纯度99.3%)。
1.3方法
1.3.1色谱条件 色谱柱:Diamonsil C18柱(美国Thermo公司,4.6 mm×150.0 mm,5 μm);流动相∶乙腈-0.68%磷酸二氢钾溶液(24∶76),采用0.2%醋酸溶液调整pH至4.5;进样量:20 μL;流速:0.8 mL/min;柱温:30 ℃;检测波长:272 nm。
1.3.2溶液配制 对照品溶液:精密称取二丁酰环磷腺苷钙对照品250 mg置于500 mL容量瓶中,加适量流动相超声溶解,然后加流动相至刻度,摇匀,即得二丁酰环磷腺苷钙质量浓度500 μg/mL的对照品溶液。供试品溶液:取注射用二丁酰环磷腺苷钙2支(40 mg),置于250 mL容量瓶中,加适量流动相超声溶解,然后加流动相至刻度,摇匀,即得注射用二丁酰环磷腺苷钙供试品溶液。配伍溶液:对照药品说明书,并结合本院临床用药实际和辅助用药专项处方点评情况配制配伍溶液,以下配伍溶液均在25 ℃、未避光、净化操作台中配制。(1)取注射用二丁酰环磷腺苷钙2支(40 mg),在250 mL转化糖电解质注射液中抽取5 mL溶解注射用二丁酰环磷腺苷钙,再将溶解液注入剩余的转化糖电解质注射液中,摇匀,即得配伍液Ⅰ。(2)取注射用二丁酰环磷腺苷钙3支(60 mg),在250 mL转化糖电解质注射液中抽取5 mL溶解注射用二丁酰环磷腺苷钙,再将溶解液注入剩余的转化糖电解质注射液中,摇匀,即得配伍液Ⅱ。(3)取注射用二丁酰环磷腺苷钙2支(40 mg),抽取5 mL 0.9%氯化钠注射液溶解注射用二丁酰环磷腺苷钙,再将溶解液注入250 mL转化糖电解质注射液中,摇匀,即得配伍液Ⅲ。(4)取注射用二丁酰环磷腺苷钙2支(40 mg),在250 mL 5%葡萄糖注射液中抽取5 mL溶解注射用二丁酰环磷腺苷钙,再将溶解液注入剩余的5%葡萄糖注射液中,摇匀,即得配伍液Ⅳ。(5)取注射用二丁酰环磷腺苷钙2支(40 mg),在250 mL 0.9%氯化钠注射液中抽取5 mL溶解注射用二丁酰环磷腺苷钙,再将溶解液注入剩余的0.9%氯化钠注射液中,摇匀,即得配伍液Ⅴ。
1.3.3标准曲线 精密量取对照品溶液适量,用流动相稀释成二丁酰环磷腺苷钙质量浓度15.62、31.25、62.50、125.00、250.00、500.00 μg/mL的系列对照品溶液。取上述系列溶液适量,采用0.22 μm微孔滤膜过滤,按照色谱条件,采用高效液相色谱法进样分析,并记录峰面积。以待测药品的质量浓度c为横坐标,对应的峰面积A为纵坐标,建立直线线性回归方程。将对照品混合溶液逐步稀释,按照信噪比3.0确定该方法的检测限。
1.3.4重复性试验 配制二丁酰环磷腺苷钙质量浓度125.00 μg/mL对照品溶液,共配制6份,采用0.22 μm微孔滤膜过滤,按照色谱条件进样分析,并记录峰面积。
1.3.5稳定性试验 配制对照品溶液,并稀释成二丁酰环磷腺苷钙质量浓度15.62、125.00、500.00 μg/mL的低、中、高浓度对照品溶液,每个浓度各配制3份,采用0.22 μm微孔滤膜过滤,按照色谱条件进样分析,并记录峰面积。
1.3.6回收率试验 精密称取二丁酰环磷腺苷钙对照品250 mg置于500.00 mL容量瓶中,加适量5%葡萄糖注射液超声溶解,然后加5%葡萄糖注射液至刻度,摇匀,即得二丁酰环磷腺苷钙质量浓度500 μg/mL的5%葡萄糖注射液混合溶液,再逐级稀释至125.00、15.62 μg/mL浓度。采用0.22 μm微孔滤膜过滤,按照色谱条件进样分析,并记录峰面积。
1.3.7配伍稳定性 按照《中国药典》(2015年版)的要求检查注射用二丁酰环磷腺苷钙与转化糖电解质注射液配伍溶液的颜色、澄清度、pH、不溶性微粒,采用高效液相色谱法检测配伍溶液中的药物相对百分含量。
2 结 果
2.1方法学考察
2.1.1专属性考察 待测药品的峰形良好,二丁酰环磷腺苷钙的保留时间为5.6 min,见图1。
2.1.2标准曲线 线性回归方程为:A=42.688c+55.450 (r=0.999 8),二丁酰环磷腺苷钙在5.62~500.00 μg/mL质量浓度的线性关系良好,定量限为5.62 μg/mL,检测限为2.81 μg/mL。
2.1.3重复性试验 二丁酰环磷腺苷钙的峰面积分别为5 393.6、5 409.5、5 380.9、5 426.8、5 399.4、5 372.8,相对标准偏差(RSD)为0.36%,该分析方法的重复性良好。
2.1.4稳定性试验 低、中、高浓度各样品在室温下放置0、1、2、4、6、12 h和1、2、3、4、5、6 d稳定,见表1。
2.1.5回收率试验 低、中、高浓度二丁酰环磷腺苷钙的回收率分别为(101.3±0.89)%、(98.6±1.06)%、(99.2±0.91)% 。
2.2配伍稳定性 0、1、2、4、6、12、24 h后,配伍溶液Ⅰ~Ⅴ均为无色澄清液体,pH值均无明显变化,见表2。转化糖电解质注射液、5%葡萄糖注射液、0.9%氯化钠注射液和配伍溶液Ⅲ、Ⅳ、Ⅴ的不溶性微粒符合药典的规定,而配伍溶液Ⅰ、Ⅱ≥10 μm不溶性微粒数量超出药典的规定,见表3。配伍溶液Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ中的二丁酰环磷腺苷钙相对百分含量符合药典要求,见表4、图2。

A:二丁酰环磷腺苷钙对照品溶液;B:5%葡萄糖注射液;C:5%葡萄糖注射液+二丁酰环磷腺苷钙对照品溶液
图1二丁酰环磷腺苷钙的高效液相色谱法色谱图

表1 分析方法的稳定性试验

表2 配伍溶液的pH变化
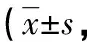
表3 配伍溶液的不溶性微粒个/mL)
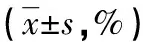
表4 配伍溶液的二丁酰环磷腺苷钙相对百分含量

A:配伍溶液Ⅰ;B:配伍溶液Ⅱ;C配伍溶液Ⅲ;D:配伍溶液Ⅳ;E:配伍溶液Ⅴ
图2配伍溶液的高效液相色谱法色谱图
3 讨 论
转化糖电解质注射液由于含有葡萄糖和果糖,厂家在制备时已调整pH至弱酸性,这是为了保护葡萄糖、果糖的稳定性。葡萄糖在pH 3~5时结构最为稳定,如果pH偏低或温度过高,以及有金属离子催化,葡萄糖会转化成5-羟甲基糠醛,继而形成黄棕色聚合物,产生变色现象。如果pH偏高,葡萄糖会差向异构化为果糖,受热后更易产生5-羟甲基糠醛,葡萄糖与碱性药物配伍也会异构化和受热变色。二丁酰环磷腺苷钙能在中性和弱酸性中保持稳定,其说明书中也规定,可溶于0.9%氯化钠注射液中肌肉注射或溶于5%葡萄糖注射液中静脉滴注。本研究采用了弱酸性流动相,高效液相色谱法色谱图表明配伍液经微孔滤膜过滤后,待测药物的峰形良好,该方法专属性良好。
二丁酰环磷腺苷钙能激活心肌中蛋白激酶,临床中主要用于急性心肌梗死、心绞痛、心源性休克、心肌炎的辅助治疗[7]。在过去的临床观察中,二丁酰环磷腺苷钙也出现了一些不良反应,如甲亢性心脏病患者输注二丁酰环磷腺苷钙后可能会出现恶心、呕吐等[8]。
转化糖电解质注射液中含有葡萄糖、果糖、钠、钾、镁等多种成分,其中果糖可在肝、肾与小肠内通过果糖激酶的催化而转变为1-磷酸果糖。果糖可在体内转化成葡萄糖或糖元,可绕过糖酵解过程中的限速酶磷酸果糖激酶,因而,在肝脏中果糖的分解速率快于葡萄糖;此外,果糖的代谢强度与其浓度相关,并不受胰岛素水平的影响,且果糖吸收过程不会造成低血糖反应。因而转化糖电解质尤其适用于烧创伤、术后及感染等胰岛素抵抗状态时需补充电解质、水或能量的补液治疗。
转化糖电解质注射液的说明书中明确载明:“与含钙药物配伍可能会产生沉淀”,其原因在于果糖会与某些药物中的钙离子发生化学反应,产生果糖钙不溶性微粒。本研究的结果表明,采用药品说明书规定的溶媒5%葡萄糖注射液、0.9%氯化钠注射液不会导致配伍液不溶性微粒增加;直接用转化糖电解质注射液溶解注射用二丁酰环磷腺苷钙的配制方法会导致大于或等于10 μm不溶性微粒增加;而使用0.9%氯化钠注射液溶解注射用二丁酰环磷腺苷钙再加入转化糖电解质注射液的配制方法则不会导致不溶性微粒增加。不溶性微粒的直径很小,因此在配置输液时无法通过肉眼观察到沉淀和变色现象,将这样的含有不溶性微粒的输液直接静脉滴注入患者体内具有极大的危害。输液中的不溶性微粒进入机体血液循环后,经过较大的静脉流入毛细血管网,在血液循环中作为异物不能被吸收和代谢,由于肾脏只能排泄直径小于3 μm的微粒,较大的不溶性微粒无法通过正常途径排出体外。因此,不溶性微粒的危害严重而且持久。不溶性微粒可能引起变态反应、热源样反应、静脉炎、肉芽肿、局部组织栓塞或坏死,以及肿瘤样反应或肿瘤形成[9-10]。
转化糖电解质注射液的说明书中并未载明可以作为溶媒稀释静脉药物,而实际上很多医院由于种种原因将转化糖电解质注射液作为药物溶媒使用,不少研究报道了相关的配伍禁忌问题。李秋等[11]发现转化糖电解质注射液与中药注射剂丹参多酚盐、血栓通配伍,可引起不溶性微粒超过药典标准。洪远等[12]发现转化糖电解质注射液与多烯磷脂酰胆碱注射液、注射用炎琥宁配伍会产生浑浊现象,与血必净注射液配伍会产生絮状物,与头孢曲松钠他唑巴坦钠、多种微量元素注射液、门冬氨酸鸟氨酸配伍后会颜色加深,并建议临床中不宜将转化糖电解质注射液代替生理盐水和葡萄糖作为溶媒使用。
由于二丁酰环磷腺苷钙和转化糖电解质注射液配伍不符合二者说明书的规定,且会导致不溶性微粒数量增加,这种超说明书配伍会对患者的用药安全产生危害,对于医院也存在法律风险[13-15]。由此,2017年7月13日本院药事管理与药物治疗学委员会发布了《关于加强部分药品临床合理使用管控的通知》,其中规定:转化糖电解质注射液一律不得作为溶媒使用,并应严格控制其用药适宜性;注射用二丁酰环磷腺苷钙的使用应严格掌握其适应证,并只能使用说明书规定的溶媒;药学部发现上述不合理处方/用药医嘱的,药房将拒绝调配;在处方点评中发现上述不合理使用现象的,将列入处方点评专项考核,对有关处方医生予以处罚。该通知在全院办公平台上发布后,药学部积极开展医嘱实时审核和处方专项点评工作,取得了较满意的管理效果,转化糖电解质注射液作为溶媒及与二丁酰环磷腺苷钙配伍使用的现象明显下降,提高了临床用药安全性和合理性。
