失神经化骨质疏松动物模型的建立与评价*
2018-09-25黄昌钊王锐英胡译文
黄昌钊,王锐英△,胡译文
(桂林医学院附属医院:1.四肢创伤骨外科;2.脊柱骨病外科,广西桂林 541001)
失神经化废用性骨质疏松是由于肢体骨骼肌肉失神经化营养支配后,因其活动长时间受限或不能,外界应力对骨的刺激减少或消失导致骨量丢失、骨脆性增加及骨组织微结构病变的一种局部或全身的骨质疏松[1]。本实验通过手术干预致臂丛神经根性损伤从而造成大白兔左侧肢体废用,构建废用性骨质疏松动物模型。在造模后3个不同时间点对其骨密度、干重、力学性能及骨组织微结构方面进行评价,为失神经化废用性骨质疏松的研究提供实验载体。
1 材料与方法
1.1实验动物 8个月龄雄性新西兰长耳白兔(由桂林医学院科学实验动物中心提供)24只,体质量3.0~3.5 kg,置于室内宽敞不锈钢圈笼中(4.5 m×3.5 m×4.8 m),保证动物笼内自由活动。在圈笼四角放置充足饲料与水,保证实验动物自由活动时能寻到足够食物,饲料由桂林医学院实验动物中心提供,饮用水为日常使用的自来水。控制室温于(26±3)℃,湿度50%~60%,定期84消毒液及紫外线室内消毒排风,确保12 h足够的光照,昼夜交替,适应喂养1星期。
1.2方法
1.2.1动物模型制作与分组 1周后,予以水合氯醛(360 mg/kg)兔耳缘静脉注射,麻醉成功后,取大白兔仰卧位,头部及四肢分别用绷带固定于特制兔手术台边缘,脱毛机脱毛术野及周围皮肤,常规聚维酮碘消毒,铺单,取左下颌骨经颈向下至胸大肌中部连线中后2/3皮肤切口,显露胸大肌,分别切断胸大肌、胸小肌,暴露左锁骨,于锁骨下镜下分离全臂丛神经至神经根孔处切断并向远端游离约2 cm切断后旷置,按解剖层次缝合术口。为预防缝合口感染,术后给予各组80万U青霉素肌内注射,1次/天,连续应用3 d,同时每日予以伤口换药1次,从而建立大白兔左侧臂丛根性损伤模型。根据术后第4、8、12周3个不同时间点将24只新西兰大白兔分为3组(每组8只)。继续圈笼内放养,自由活动。
1.2.2标本获取 分别于术后第4、8、12周3个时间点采用耳缘静脉快速注射空气栓塞法各处死8只兔。仔细解剖双侧肱骨,浮力法测量体积,于-80 ℃冰箱中冷冻保存。
1.2.3肱骨生物力学性能测定 取实验侧和对照侧肱骨试件,游标卡尺测量长度和直径。试件两端树脂包埋固定,维持试件竖直,包埋深浅均匀一致,保证自凝树脂基托与试验机接触面水平光滑。为避免收集三点弯曲试验时碎裂的骨组织及实验过程中试件干燥,采用薄塑料纸包裹试件。固定好的试件于WDW-20型天辰电子万能试验机上行三点弯曲试验。测量弯曲强度极限值,以最大载荷及弹性模量衡量骨强度。压力加载速率是2 mm/min[2-3]。将两端固定好的肱骨置于力学试验机楔形支架上,肱骨凹侧面朝上,压力杆由上向下匀速对肱骨中段施加压力,直至试件断裂。用与力学试验机连接的计算机记录整个测试过程,结果根据各组所测骨强度指标进行计算。
1.2.4骨密度测定 采用双能X射线骨密度仪(法国MEDILINK公司)测量不同时间段各组大白兔双侧肱骨骨密度值,检测时先纵向扫描,显示肱骨近端形态后,以骨骺线为参照移3.0 mm和12.0 mm处作断层测定[4]。
1.2.5骨骼重量测定 留取双侧肱骨,剔净附着于骨质的软组织,将肱骨全长标本放入烤箱,110 ℃干燥10 h后,用分析天平(精度为0.00 01 g)精确称取肱骨干重。
1.2.6骨组织形态学检测 取各组双侧肱骨近端干骺端,10%中性甲醛固定,乙二胺四乙酸(EDTA)脱钙液脱钙,行骨标本冠状面对剖,乙醇顺浓度梯度脱水,组织浸蜡及石蜡包埋,6 μm连续切片,行HE和Masson染色,观察骨组织形态学改变。

2 结 果
2.1骨密度 术后右对照侧与左实验侧相比,4、8、12周兔肱骨骨密度值分别由0.69、0.68、0.66 g/cm2降至0.47、0.31、0.19 g/cm2,骨密度值随着肢体废用时间的延长,实验侧下降程度明显,差异有统计学意义(P<0.05)。
2.2肱骨干重 术后3个不同时间点测定兔肱骨全长骨骼干重,左实验侧与右对照侧比较,肱骨干重值降低,且下降程度随肢体废用时间的延长而加重(P<0.05)。术后各实验侧组间值相比较,肱骨失神经化支配时间越长,骨骼干重值下降程度越显著,差异有统计学意义(P<0.05);各对照侧组间比较,肱骨干重值差异无统计学意义(P>0.05),见表1。

表1 各时间点大白兔双侧肱骨骨骼干重值的测定结果
2.3骨力学强度 术后第4、8、12周实验侧与对照侧相比,各时间点实验侧骨力学强度指标与对照侧相比明显降低,差异有统计学意义(P<0.05);各时间点实验侧组间比较,骨质失神经化支配时间越长,上述各变量值下降程度越显著,差异有统计学意义(P<0.05);术后各对照侧组间比较,骨强度值差异无统计学意义(P>0.05),见表2、3。
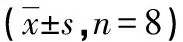
表2 各时间点大白兔肱骨弯曲实验最大载荷、弹性模量及弯曲强度值测试结果
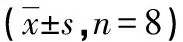
表3 各时间点大白兔肱骨弯曲实验弹性应力、弹性应变、最大应力、最大应变值测试结果

图1 术后第4、8、12周各组兔肱骨近端干骺端形态学变化(HE×100)

图2 术后第4、8、12周各组兔肱骨近端干骺端新生胶原变化(Masson×100)
2.4肱骨组织形态学检测 术后各时间点对照侧肱骨近端干骺端骨小梁连接紧密,粗大无断裂,孔隙较少,髓腔及破骨细胞数目无异常增多,骨皮质较厚,与对照侧组织表现一致(图1)。相比各时间点实验侧骨小梁结构稀疏、纤细并存在多处断裂,小梁间吻合程度明显降低,髓腔容积扩大,破骨细胞数目明显增多,且随着观察时间的延长,上述表现越发明显(图1)。为评价骨组织成熟程度,Masson染色显微镜下见新生骨胶原大多被染蓝色,成熟骨胶原为鲜红色,结果可见随着兔左上肢废用时间的延长,骨质中新生胶原的量明显在减少,成熟胶原量增多(图2)。
3 讨 论
目前臂丛神经损伤及废用性骨质疏松患者在临床诊疗过程中十分常见,临床上废用性骨质疏松也常常继发于中枢神经系统、脊髓或周围神经病变或损伤后引起的肌肉瘫痪[5-7],本研究通过手术构建臂丛根性损伤模型致大白兔左上肢废用,从而打乱其体内骨形成和骨吸收动态平衡,有研究报道新生骨合成需要成骨细胞介导,骨吸收则依赖于破骨细胞,此骨吸收大于骨形成动态平衡的紊乱,导致骨质发生疏松病变[8-9]。此外,COUPAUD等[10]指出基于人体四肢骨骼中含有极多的神经纤维,神经损伤后丧失了对骨骼的调节功能,骨组织细胞功能表达及骨重塑平衡紊乱,极易导致骨质疏松。
成骨细胞介导的新骨生成减少,而破骨细胞介导的骨吸收增强,导致上肢骨骨质的密度、干重、强度、力学性能及组织形态学结构均随着废用时间延长发生不同程度病变,骨折发生率显著提高[11]。这些指标的改变表明失神经化废用性骨质疏松的兔模型建立成功。
临床实验研究中复制失神经化废用性骨质疏松动物模型所采取的动物及方式多样,其中以兔及鼠备受青睐[12]。TROSS等[13]指出8个月龄左右的大白兔其体内二级松质骨的骨骼重建与人类的骨重建特别相似。因此,为了能更好地了解废用性骨质疏松症的发病机理,本实验采用大白兔为动物实验模型是合理高效的。与其他的废用性骨质疏松模型比较,失神经营养化废用引发的局部骨质疏松在临床表现及病理生理机制上更突出,其导致的骨质丢失起因于骨吸收能力的过表达和骨形成能力的减弱[14]。
ZENG等[15]报道了失神经化支配后骨生成明显下降,骨吸收增加,骨量丢失在造模术后第4~6周开始发生显著性废用性骨质疏松,并在 X 线片上有明显反映。但有大量研究发现采用大白兔失神经造模后,骨质发生废用性骨质疏松的时间段并不是一致的,可能与实验动物的饮食、睡眠、活动情况及身体营养状况等个体因素相关。同时,失神经化导致废用性骨质疏松的分子机制复杂,骨骼失神经化后打乱体内骨形成和骨吸收的动态平衡只是导致骨质疏松的机制之一,其骨动态平衡中相关蛋白和生化因子的分子变化机制还需进一步研究。
本实验研究结合了临床臂丛神经损伤机理及解剖结构,采用一侧兔臂丛神经根性切断造模方法。结果表明,肱骨失神经化营养支配后,骨密度、干重明显降低,骨的力学强度指标较对照侧明显减弱,骨小梁致密度、小梁间吻合、骨皮质厚度、孔隙、髓腔、破骨细胞数目及新生胶原纤维数量在不同的废用时间点与对照侧相比差异均有统计学意义。故本研究结果显示,臂丛神经切断术是有效建立废用性骨质疏松动物模型的方法,为废用性骨质疏松研究提供了良好的实验载体,也为骨科今后对骨质失神经营养方面的基础研究及临床防治提供了较为稳定可靠的实验基础。
