丹红注射液对大鼠局灶性脑缺血再灌注后脑血管内皮损伤的保护作用*
2018-09-22王欣玲秦桂芳吴胜英
罗 霞 胡 彬 王欣玲 秦桂芳 吴胜英
(1.湖北省十堰市太和医院,湖北医药学院附属医院,湖北 十堰 442000;2.湖北省十堰市人民医院,湖北 十堰 442000;3.湖北医药学院基础医学院,湖北 十堰 442000)
血管内皮细胞可通过内分泌、旁分泌和自分泌等途径分泌血管活性物质内皮素-1(ET-1)、一氧化氮(NO)等。ET-1和NO在抑制血管壁炎症反应及平滑肌细胞增殖、抗血栓形成、调节血管紧张性等方面发挥着重要作用[1]。NO是血管内皮细胞分泌的舒血管因子,L-精氨酸在NO合酶 (eNOs)作用和催化下产生NO,后者通过激活鸟氨酸环化酶,介导cGMP而发挥调控血管舒张功能[2]。不仅如此,NO还具有抑制平滑肌细胞增殖、血小板聚集及单核细胞黏附性等重要功能[3]。然而在缺血再灌注等有害因素作用下,内皮细胞释放的舒血管因子NO减少,缩血管因子ET-1增多,造成血管平衡稳态失衡,血管内皮功能发生紊乱[4]。除上述血管活性物质外,缺血再灌注后还会引起白细胞介素-10(IL-10)、转录因子(NF-κB)、转录激活蛋白-1(AP-1)、细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)等多因素参与缺血再灌注后血管内皮炎症反应[5]。临床收治的急性脑梗死患者在经溶栓治疗后,由于血流再通,常出现缺血再灌注后损伤而加重临床症状,患者因急性脑功能缺损而致残甚至死亡。中药制剂丹红注射液在抑制缺血再灌注后氧化应激反应、促进血管新生等方面有一定的作用,但针对缺血再灌注后损伤造成的血管内皮炎症性损伤的相关研究还不够系统[6]。本研究采用线栓大脑中动脉willis环缺血45 min后再灌注的方法模拟人急性脑梗死后缺血再灌注后损伤,并用丹红注射液进行治疗,分析其干预机制,为临床治疗急性脑梗死提供实验和理论基础。
1 材料与方法
1.1 实验动物 雄性SD大鼠共72只,体质量(180±20)g,实验动物购自湖北医药学院动物中心,许可证:SCXK(鄂)2017-0008。动物房12 h交替光照,22℃恒温,湿度控制在70%~80%,动物自由饮水,分笼、普通饲料适应性喂养1周。
1.2 试药与仪器 丹红注射液(云南生物谷药业股份有限公司,批号:16061034);麻醉用水合氯醛(上海展云化工有限公司,批号:20170119);奈必洛尔(杭州甫洛生物科技有限公司,批号:152520-56-4);鼠抗FLK-1、VEGF及eNOs检测用ELISA试剂盒 (上海酶联生物科技有限公司,批号:2017360323,20170412,218360343);NO试剂盒 (上海劲马生物科技有限公司, 批号:20170743);NF-κB 和 AP-1激活-核转运检测试剂盒 (北京百奥莱博科技有限公司,批号:2180124,201711294);ICAM-1、VCAM-1 和 ET-1 检测用ELISA试剂盒 (上海信帆生物科技有限公司,批号:XFR31370,XFR31374);FlexStation 3 多功能酶标仪[美谷分子仪器(上海)有限公司)];752N紫外可见分光光度计(上海仪电分析/上海精科)。
1.3 造模及分组 实验前将直径为0.22 mm的尼龙钓鱼线消毒剪成4 cm长,将一端用细沙布打磨平滑,然后消毒备用。配制10%水合氯醛备用。将丹红注射液和奈必洛尔均配制成0.1%溶液备用。选取60只体质量相近的SD大鼠进行线栓大脑中动脉willis环缺血45 min后再灌注手术,造模参考文献[7]执行,术前动物禁食禁水12 h,称质量后腹腔注射水合氯醛(3.0 mL/kg)麻醉,待大鼠麻醉后固定,用电动剃须刀清理颈胸部鼠毛,碘伏消毒,切开皮肤,分离左侧颈总动脉和颈内动脉,延颈内动脉分离进入颅内的翼腭动脉并分别夹闭。然后用眼科剪将左侧颈总动脉剪一V形口,将备用的栓线缓慢插入,插入深度约18 mm,或有阻力感为即止,待尼龙栓线进入willis环后,阻断willis环供血45 min,然后将丝线抽出约10 mm,使willis血液再通。剪去突出在皮肤上的尼龙栓线,使部分尼龙栓线保留在左侧颈总动脉中以防止出血,然后缝合创口并消毒。成模标准以大鼠行为学改变为准:1)12 h后大鼠出现左前爪内收,动物行走时向左侧偏转。2)将大鼠提起,出现左前爪内收或不能伸展,动物因此出现步态不稳或转圈。术后挑选造模成功的36只大鼠随机均分为模型组、奈必洛尔组和丹红组,每组12只,另12只未手术的SD大鼠设为对照组作为对照,对照组手术步骤同上,但在分离出左侧颈总动脉后不插入栓线造模。
1.4 干预方法 治疗前先将丹红注射液和奈必洛尔配制成0.1%的溶液备用,治疗前根据人与实验动物用药换算公式,计算丹红注射液和奈必洛尔的用药量分别是 5 mg/(kg·d)和 2.5 mg/(kg·d)。 模型组和对照组每只大鼠尾静脉注射0.9%氯化钠注射液0.2 mL。奈必洛尔组每只大鼠尾静脉注射β1受体阻滞剂奈必洛尔0.2 mL。丹红组每只大鼠尾静脉注射丹红注射液0.2 mL。4组均治疗14 d。
1.5 标本采集与检测 治疗结束后先采眶静脉血,再处死动物取willis动脉环编号后冻存。采用硝酸还原酶法检测血清NO含量(用752N紫外可见分光光度计读取所测值);双抗体酶联免疫吸附试验(ELISA法)检测血清ICAM-1含量:检测时取眶静脉血0.1 mL,4℃过夜后,1000g离心15 min,取上清检测。加样前先设空白孔、标准孔和待测样品孔,空白孔加标准品样品稀释液100 μL,其它分别加标准品或待测样品100 μL,37℃孵育90 min。倒去孔内液体,加入100 μL生物素抗体工作液,37℃孵育60 min。洗涤3次,加入100 μL酶结合物工作液,37℃孵育30 min。洗涤5次,加入50 μL底物溶液,37℃孵育 15 min。 加入 50 μL终止液,在酶标仪450 nm波长处测量ICAM-1的OD值。然后以OD值为横坐标,标准品的浓度为纵坐标,绘出标准曲线,由标准曲线查出样品的相应的实际浓度。NF-κB、AP-1、VCAM-1、IL-10 和 ET-1 参考以上方法严格按检测说明操作。
1.6 统计学处理 应用SPSS13.0统计软件。计量资料以(±s)表示。先进行方差分析,对于方差齐、正态分布的组间比较采用t检验,当方差不齐时组间比较采用校正t检验。P<0.05为差异有统计学意义。
2.结 果
2.1 各组 NF-κB、AP-1、ICAM-1和 VCAM-1水平比较 见表1。与对照组比较,模型组静脉血NF-κB、AP-1、ICAM-1、VCAM-1 和 ET-1 含量均升高 (P<0.05)。奈必洛尔组 NF-κB、AP-1、ICAM-1、VCAM-1 与模型组比较均有一定程度降低(P<0.05)。与模型组和奈必洛尔组比较,丹红组 NF-κB、AP-1、ICAM-1、VCAM-1均明显降低(P<0.05)。
表 1 各组 NF-κB、AP-1、ICAM-1 和 VCAM-1 水平比较(±s)
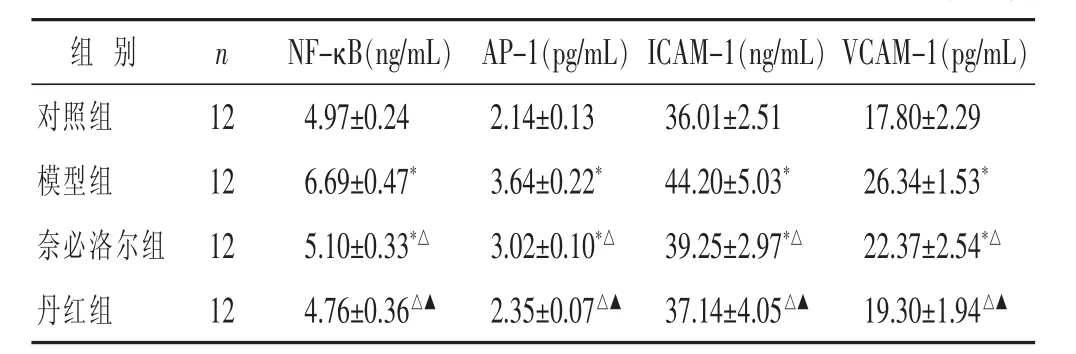
表 1 各组 NF-κB、AP-1、ICAM-1 和 VCAM-1 水平比较(±s)
与对照组比较,*P<0.05;与模型组比较,△P<0.05;与奈必洛尔组比较,▲P<0.05。 下同
组 别 n NF-κB(ng/mL) AP-1(pg/mL)ICAM-1(ng/mL)VCAM-1(pg/mL)对照组 12模型组 12奈必洛尔组 12 4.97±0.24 2.14±0.13 36.01±2.51 17.80±2.29 6.69±0.47* 3.64±0.22* 44.20±5.03* 26.34±1.53*5.10±0.33*△ 3.02±0.10*△ 39.25±2.97*△ 22.37±2.54*△丹红组 124.76±0.36△▲ 2.35±0.07△▲ 37.14±4.05△▲ 19.30±1.94△▲
2.2 各组NO、eNOs、ET-1及 IL-10水平比较 见表2。与对照组比较,模型组NO、eNOs和IL-10均降低,ET-1升高(P<0.05)。奈必洛尔组NO、eNOs均显著升高,与模型组比较差异有统计学意义 (P<0.05),但ET-1和IL-10与模型组比较差异无统计学意义 (P>0.05)。丹红组与模型组比较,NO、eNOs和IL-10均显著升高(P<0.05)。但丹红组NO、eNOs与奈必洛尔组比较,无明显差异(P>0.05),而ET-1降低程度和IL-10升高程度比较,差异均有统计学意义(P<0.05)。
表 2 各组 NO、eNOs、ET-1 及 IL-10 水平比较(±s)
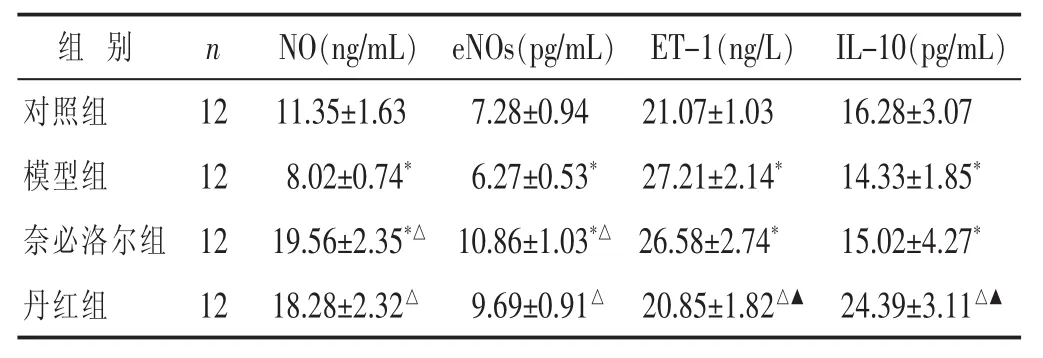
表 2 各组 NO、eNOs、ET-1 及 IL-10 水平比较(±s)
组 别 n NO(ng/mL) eNOs(pg/mL) ET-1(ng/L) IL-10(pg/mL)对照组 12模型组 12奈必洛尔组 12 11.35±1.63 7.28±0.94 21.07±1.03 16.28±3.07 8.02±0.74* 6.27±0.53* 27.21±2.14* 14.33±1.85*19.56±2.35*△ 10.86±1.03*△ 26.58±2.74* 15.02±4.27*丹红组 1218.28±2.32△ 9.69±0.91△ 20.85±1.82△▲ 24.39±3.11△▲
3 讨 论
临床收治的急性脑梗死患者其起病急骤,且在溶栓治疗后常因血液再通而引起严重的脑缺血-再灌注损伤,而缺血-再灌注后的氧自由基的产生和清除失衡造成氧化应激反应,这一反应会通过降解细胞外基质、促进内皮细胞凋亡、促进炎症细胞的生长和迁移并激活转录因子AP-1、NF-κB,促进黏附分子ICAM-1,VCAM-1及ET-1过表达而引起血管内皮损伤[8]。急性脑梗死患者患者常因以上级联反应,使该病病死率和致残率居高不下,故如何消除“氧化应激”反应,降低脑缺血-再灌注后血管内皮损伤对提高临床疗效具有重要意义。
丹红注射液提取自中药丹参和红花,其中丹参味辛,性凉,主治心脑腹痛,而《药品化义》记载红花“味辛性温”,善通利经脉,因其具有“活血、化瘀、通经、祛瘀、止痛”之功,现临床上常用于防治心脑血管系统疾病[9-10]。
在本研究中,阳性药组(奈必洛尔组)尾静脉注射β1受体阻滞剂奈必洛尔,作为高选择性的β1肾上腺素受体阻滞剂,奈必洛尔可刺激血管内皮细胞eNOs释放NO,从而增加血流介导的血管舒张功能,达到降低外周血管阻力和抗氧化应激反应的目的。实验发现,丹红组NO、eNOs均显著升高,且与奈必洛尔组比较差异无统计学意义(P>0.05)。提示丹红注射液有与阳性药奈必洛尔相同的药理作用,可通过提高内皮细胞eNOs活性,促进NO释放而产生保护损伤内皮的作用,与邓芬等研究发现丹红注射液可提高大鼠局灶脑缺血后eNOs含量一致[11]。脑缺血-再灌注后炎症反应是脑组织损伤的重要机制,而转录因子NF-κB和AP-1的激活在炎症反应中发挥重要转录调控作用[12]。ICAM-1、VCAM-1和ET-1也参与炎症反应,可促进单核细胞、淋巴细胞和中性粒细胞向血管内皮黏附,而这会造成白细胞向炎症区移行,使白细胞与内皮细胞牢固黏附,造成脑组织微血管阻塞,使炎症反应加重。ET-1是血管活动的重要调节因子之一,具有强效的调节血管收缩作用,其参与新生血管生成和血管重塑,促进细胞外基质合成,尤其在血栓性疾病的病理改变过程中发挥着重要的调节作用[13]。对心脑血管疾病的预后具有重要意义,高水平ET-1常预示发生血栓性疾病的机会远高于ET-1正常人群[14]。因此,调控或抑制脑缺血-再灌注时VCAM-1、ICAM-1和 ET-1的表达可减轻脑缺血时的氧化应激反应,降低脑缺血-再灌注损伤的程度。实验还观察到丹红组静脉血NF-κB、AP-1、ICAM-1、VCAM-1 和 ET-1 均明显降低 (P<0.05)。提示丹红注射液通过抑制缺血-再灌注后NF-κB信号通路的激活,减少炎性细胞因子及VCAM-1和ICAM-1的生成,从而减轻脑缺血-再灌注后脑组织继发性炎症反应引起的血管内皮损伤,从而发挥对脑组织脑缺血-再灌注损伤的保护作用[15-16]。研究表明,炎症反应也是脑缺血-再灌注损伤的重要机制之一,IL-10来源于调节性T细胞和Th2,具有抑制Th1细胞应答、抑制巨噬细胞的抗原提呈和合成细胞因子等功能,可促进B细胞分化、增殖及抗体产生,是机体重要的抗炎细胞因子,在脑缺血后发挥着重要的神经保护作用[17]。有学者[18]发现IL-10基因敲除小鼠脑梗死24 h后脑梗死面积和质量均较正常脑缺血-再灌注小鼠高,且在体外模型中,IL-10基因敲除小鼠与来源于野生型小鼠的神经元原代细胞对氧-糖剥夺及兴奋性毒性更加敏感;由此得出,不论是外源性IL-10,还是内源性IL-10,在脑缺血-再灌注时均具有神经保护作用[19-20]。本实验证实丹红注射液可提高内源性IL-10,这可能是丹红注射液保护脑缺血-再灌注损伤的重要机制之一。以上诸多观察结果证实丹红注射液在治疗急性脑梗死时的神经保护功能方面虽无β1受体阻滞剂奈必洛尔强,但可通过多机制发挥缺血-再灌注损伤的保护作用。
综上所述,丹红注射液有与β1受体阻滞剂奈必洛尔相同的脑血管内皮损伤保护作用,但其除可提高内皮细胞eNOs及静脉血NO含量而保护损伤内皮外,还可通过提高内源性IL-10表达,降低VCAM-1和ICAM-1的生成,抑制缺血再灌注后氧化应激造成的血管内皮炎症性损伤,从而改善血管内皮功能紊乱现象。
