心痛泰抑制动脉粥样硬化兔炎症反应的作用机理研究*
2018-09-22张建影郭志华
张建影 李 雅 郭志华 易 琼 任 欣 刘 梨
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙410208)
动脉粥样硬化是一种由动脉壁脂质潴留,血管内皮损伤引起的慢性炎症性疾病,是导致心脑血管疾病发生的重要因素[1-2]。动脉粥样硬化具有经典炎症变性、渗出和增生的特点,炎症反应是动脉粥样硬化致病的共同环节或通路,其可通过激活单核细胞产生促炎症因子,从而诱导血管平滑肌细胞发生迁移和增殖,导致内皮细胞损伤和炎症细胞激活,是动脉粥样硬化形成的主要原因。抗炎、保护血管内皮治疗对防治动脉粥样硬化具有重要作用[3-4]。心痛泰可有效治疗动脉粥样硬化,前期研究表明:其可通过降低动脉粥样硬化家兔的核因子-κB(NF-κB)、肿瘤坏死因子-α(TNF-α)、血清脂蛋白相关磷脂酶 A2(Lp-PLA2)、白细胞介素6(IL-6)、主动脉高敏C反应蛋白 (hs-CRP)、血凝素样氧化型低密度脂蛋白受体1(LOX-1)的表达,提高抗炎因子白细胞介素-10(IL-10)的表达,抑制动脉粥样硬化的炎症反应[5-6]。本文在前期研究基础上,以动脉粥样硬化兔为实验对象,通过测定Toll样受体4(TLR4)、p38丝裂原活化蛋白激酶(p38 MAPK)、髓过氧化物酶 (MPO)、Ras基因家族成员A(RhoA)、内皮型一氧化氮合酶(eNOS)的表达,进一步研究心痛泰能否通过Toll样受体、MAPK以及Ras基因家族等信号通路调控机体炎症反应,为中药新药研发奠定基础。
1 材料与方法
1.1 实验动物
120 只雄性日本大耳白兔,清洁级,10~12周龄,体质量(2.19±0.135)kg,购自湖南中医药大学实验动物中心提供,动物许可证号:SCXK(湘)2009-0012。动物购进后,单笼饲养,适应性喂养1周。
1.2 药物及饲料
心痛泰由丹参、川芎、三七、郁金、木香、山楂、枳壳、葛根组成,中药饮片购自湖南中医药大学第一附属医院中药房,经本院药剂科鉴定所有药材均符合药典标准。取2倍量处方药材,温水浸泡1 h,水量超出药物5~6 cm,大火煮沸后转小火煎30 min,趁热过滤,药渣按前法再煎煮两次,将3次药液混匀、过滤,减压浓缩至每克药粉相当于15 g生药。瑞舒伐他汀钙片,规格:10 mg/片,购自阿斯利康制药有限公司。高脂饲料由77.5%基础饲料、15%蛋黄粉、5%猪油、2%胆固醇、0.5%胆酸钠组成,由湖南中医药大学动物实验中心加工而成。
1.3 试剂及仪器
p-p38 抗体 (Bioss,Bs-0636R),MPO 抗体(Bioss,Bs-4943R),RhoA 抗体 (Bioss,Bs-1180R),TLR4 抗体(BOSTER,BA1717),eNOS 抗 体 (Abcam,Ab66127),GAPDH 抗体(CST,#5174),羊抗兔 HRP 标记二抗(碧云天生物技术研究所,A0208),羊抗鼠HRP标记二抗(碧云天生物技术研究所,A0216);Trizol(invitrogen 公司产品),DEPC处理水 (上海基尔顿生物科技有限公司),氯仿、异丙醇、无水乙醇(国药集团有限公司产品),SYBR Green PCR试剂盒、逆转录试剂盒(Thermo公司),RNaseⅠ(Fermentas公司),PCR 引物由上海捷瑞合成。电子天平秤(湘仪天平仪器设备有限公司,TP-2200B),电泳仪(BIO-RAD 公司,mini protean 3 cell),电转仪(大连竞迈科技有限公司,PS-9),酶标仪(芬兰雷勃酶标仪,型号为MK3),吉尔森P型移液器(Pipetman),水浴锅(莱卡公司),旋涡振荡器(上海青浦泸西仪器厂),手握式电动匀浆机 (德国FLUKO公司,F6/10), 低温冷冻离心机 (Sigma 公司,3K15),Real-time检测仪(ABI公司,ABI-7300),超纯水分离系统(美国LABCONCO 公司,90005-002)。
1.4 分组与造模
采用高脂饲料喂养联合免疫损伤建立兔动脉粥样硬化模型[7-8]:将120只大耳白兔随机分为空白组、模型组、心痛泰高剂量组、心痛泰中剂量组、心痛泰低剂量组、瑞舒伐他汀组(阳性组)各20只。除空白组外,其余组均在造模的第1天开始采用高脂饲料喂养,30 g/(kg·d),每日 2次;并于造模第 1天和第 7天耳缘静脉注射10%牛血清白蛋白(250 mg/kg),同时卵清白蛋白皮下注射,2.5 mg/kg,每2日1次,共5次。
1.5 给药方法
造模的同时予药物灌胃干预治疗,灌胃剂量根据人与兔的体表面积公式换算,心痛泰高、中、低剂量组给药量分别为9.2、4.6、2.3 g/kg,瑞舒伐他汀组给药量为0.55 mg/kg,空白组和模型组予同等体积生理盐水灌胃。灌胃量每次10 mL/kg,连续8周。
1.6 标本采集与检测
实验结束后,予25%乌拉坦4 mL/kg耳缘静脉麻醉,空气栓塞法处死。冰台无菌操作迅速取主动脉弓下2.5~4.0 cm的胸主动脉段,纵行剖开,剪碎置于液氮中冻存,用于HE染色、Western blotting、RT-PCR检测。
1.6.1 Western blotting 检测 TLR4、p38 MAPK、MPO、RhoA、eNOS蛋白的表达 将取出的主动脉组织剪成碎片,按每20 mg组织加入150~250 μL裂解液的比例加入裂解液,匀浆器匀浆直至完全裂解,BCA法测定蛋白质浓度。配胶后上样,进行电泳,采用48 mmol/L Tris、39 mmol/L glycine、0.04%SDS、20%甲醇配置电转缓冲液进行转模,5%脱脂奶粉 (检测磷酸化蛋白用BSA)室温封闭1 h,分别加入适量稀释后抗体RhoA(1∶100)、NF-κB(1∶1000)、eNOS(1∶400)、p38(1∶200)、TLR4(1∶150)、MPO(1∶100)、GAPDH(1∶1500),4 ℃孵育过夜。孵育一抗的膜用TBST洗涤5 min×2次,TBS洗涤 5 min×1次。随后按照1∶1000稀释HRP标记的二抗,与膜37℃孵育1 h。用TBST洗涤5 min×2次,TBS洗涤5 min×1次。加入适量增强化学发光法(ECL)发光试剂,暗室内曝显影,图像分析。
1.6.2 RT-PCR 检测 TLR4、p38 MAPK、MPO、RhoA、eNOS mRNA的表达 取组织置于Trizol的匀浆管中,于匀浆机匀浆20 s,酚-氯仿法提取各组细胞总RNA,测定 RNA 的完整性;37 ℃,30 min;Hold, 加 1 μL 的EDTA;65℃,10 min条件下消除总RNA中的 DNA,37℃,60 min;85℃,5 min;4℃,5 min进行反转录,-20℃保存;以cDNA以模板,与基因特异性引物,通过 PCR 扩增 TLR4、p38 MAPK、MPO、RhoA、eNOS,内参基因选定为GAPDH;采用仪器自带软件ABI Prism 7300 SDS Software测定分析,实验重复3次。引物序列见表1。

表1 各基因PCR引物序列
1.7 统计学处理
应用SPSS19.0统计软件。计量资料以(±s)表示,数据进行正态分布检验及组间方差齐性检验,符合正态分布及方差齐性,采用单因素方差分析;不符合正态分布、方差分析,采用Kruska-Wallis H进行统计处理;组间两两比较采用LSD法。检验水准为0.05。P<0.05为差异具有统计学意义。
2 结 果
2.1 各组兔主动脉组织病理学变化比较
见图1。空白组兔主动脉组织未见粥样斑块,镜下内膜光滑而完整,内皮细胞连续紧密,基本无内膜增厚及斑块形成。模型组兔主动脉动脉肉眼可见大量粥样斑块明显形成,镜下内膜壁明显增厚,形成较大斑块且突出管腔,内膜下大量泡沫细胞聚集及炎性细胞浸润;中膜被破坏,弹性纤维、平滑肌细胞排列疏松紊乱,符合动脉粥样硬化病理学改变,说明高脂饲料饲养联合免疫损伤方法造模动脉粥样硬化兔成功。阳性组肉眼可见极少量粥样斑块,镜下内膜稍增厚,内膜下可见少量泡沫细胞及炎性细胞浸润;内弹性膜未被破坏,中膜完整。心痛泰低剂量组肉眼可见较多粥样斑块,镜下内膜明显增厚形成斑块,可见泡沫细胞聚集及炎性细胞浸润,内膜破坏,与靠近内膜的部分中膜相融合;中膜内弹性纤维、平滑肌细胞排列较整齐。心痛泰中、高剂量组肉眼见少量粥样斑块,镜下内膜增厚较模型组明显减低,内膜下可见泡沫细胞聚集及炎性细胞浸润;内弹性膜未被破坏,中膜完整。
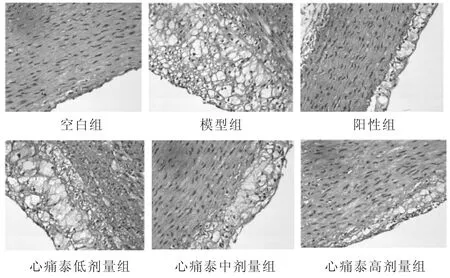
图1 各组主动脉组织病理切片(HE染色,400倍)
2.2 各组TLR4蛋白、TLR4 mRNA表达比较
见表2,图2。与空白组比较,模型组TLR4蛋白、TLR4 mRNA表达升高,差异有显著统计学意义(P<0.01);与模型组比较,心痛泰低剂量组TLR4蛋白、TLR4 mRNA表达均降低,但差异无统计学意义 (P>0.05);与模型组比较,心痛泰中剂量组TLR4蛋白表达降低,但差异无统计学意义(P>0.05),心痛泰中剂量组TLR4 mRNA表达降低,差异有统计学意义 (P<0.05);阳性组、心痛泰高剂量组TLR4蛋白、TLR4 mRNA表达均降低,差异有显著统计学意义(P<0.01);心痛泰高剂量组TLR4蛋白、TLR4 mRNA表达虽高于阳性组,但差异无统计学意义(P>0.05)。
2.3 各组p38MAPK蛋白、p38 MAPK mRNA表达比较
见表3,图3。与空白组比较,模型组p38 MAPK蛋白、p38 MAPKmRNA表达升高,差异有显著统计学意义(P<0.01);与模型组比较,心痛泰低剂量组p38 MAPK蛋白表达降低,但差异无统计学意义(P>0.05);与模型组比较,心痛泰低剂量组p38 MAPK mRNA表达降低,差异有显著统计学意义(P<0.01);与模型组比较,阳性组、心痛泰高、中剂量组p38 MAPK蛋白、p38 MAPK mRNA表达均降低,差异有显著统计学意义(P<0.01);心痛泰高剂量组p38 MAPK蛋白表达高于阳性组,p38 MAPK mRNA表达低于阳性组,但差异无统计学意义(P>0.05)。
表2 各组TLR4蛋白、TLR4 mRNA表达比较(±s)
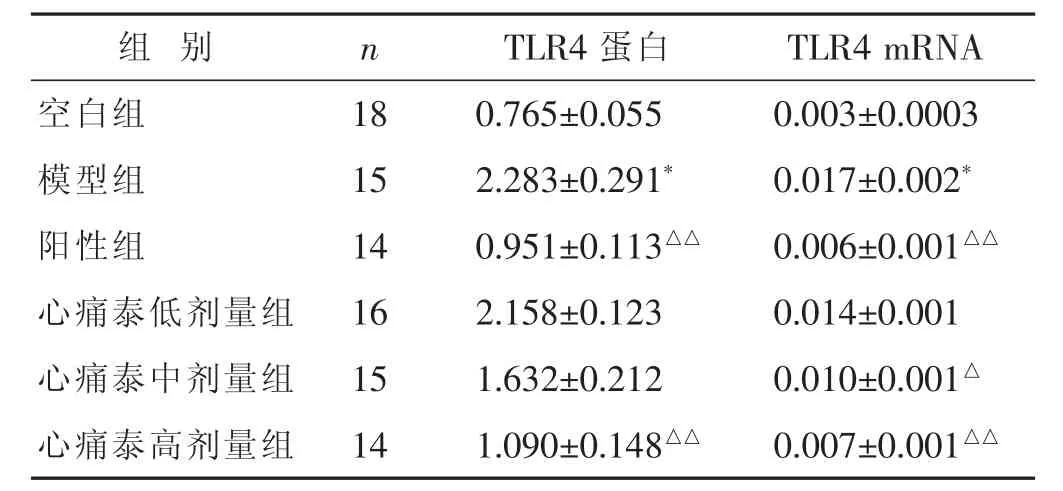
表2 各组TLR4蛋白、TLR4 mRNA表达比较(±s)
与空白组比较,*P<0.01;与模型组比较,△P<0.05,△△P<0.01。 下同
组 别 n TLR4蛋白 TLR4 mRNA空白组 18 0.765±0.055 0.003±0.0003模型组 15 2.283±0.291* 0.017±0.002*阳性组 14 0.951±0.113△△ 0.006±0.001△△心痛泰低剂量组 16 2.158±0.123 0.014±0.001心痛泰中剂量组 15 1.632±0.212 0.010±0.001△心痛泰高剂量组 14 1.090±0.148△△ 0.007±0.001△△
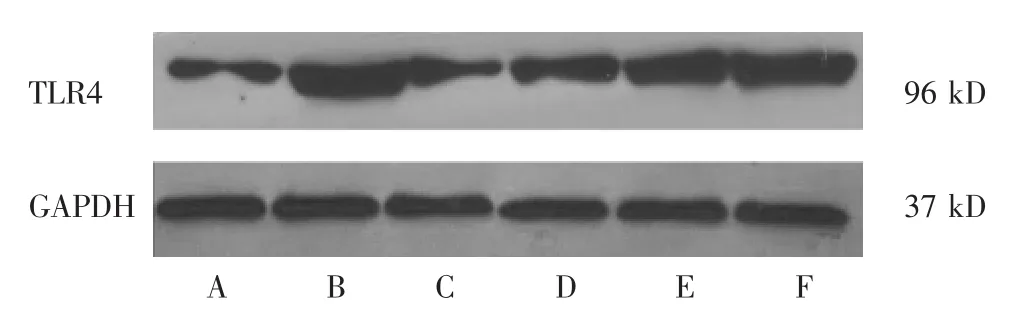
图2 各组TLR4的蛋白表达条带
表3 各组p38 MAPK蛋白、p38 MAPK mRNA表达比较(±s)

表3 各组p38 MAPK蛋白、p38 MAPK mRNA表达比较(±s)
组 别 n p38 MAPK蛋白 p38 MAPK mRNA空白组 18 0.251±0.020 0.008±0.0012模型组 15 1.141±0.152* 0.071±0.005*阳性组 14 0.358±0.023△△ 0.020±0.004△△心痛泰低剂量组 16 0.837±0.099 0.048±0.006△△心痛泰中剂量组 15 0.608±0.038△△ 0.040±0.0033△△心痛泰高剂量组 14 0.370±0.028△△ 0.019±0.003△△

图3 各组p38 MAPK蛋白表达条带
2.4 各组MPO蛋白、MPO mRNA表达比较
见表4,图4。与空白组比较,模型组MPO蛋白、MPO mRNA表达升高,差异有显著统计学意义(P<0.01);与模型组比较,心痛泰低剂量组MPO蛋白、MPO mRNA表达降低,差异有统计学意义(P<0.05);与模型组比较,阳性组、心痛泰高、中剂量组MPO蛋白、MPO mRNA表达均降低,差异有显著统计学意义(P<0.01);心痛泰高剂量组MPO蛋白表达虽高于阳性组,心痛泰高剂量组与阳性组MPO mRNA表达相当,差异均无统计学意义(P>0.05)。
表4 各组MPO蛋白、MPO mRNA表达比较(±s)
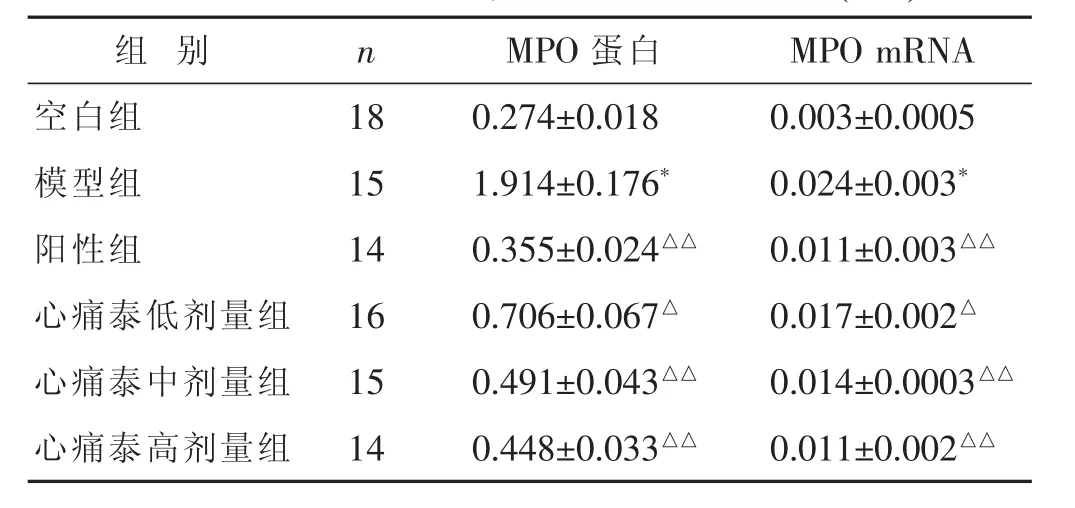
表4 各组MPO蛋白、MPO mRNA表达比较(±s)
组别 n MPO蛋白 MPO mRNA空白组 18 0.274±0.018 0.003±0.0005模型组 15 1.914±0.176* 0.024±0.003*阳性组 14 0.355±0.024△△ 0.011±0.003△△心痛泰低剂量组 16 0.706±0.067△ 0.017±0.002△心痛泰中剂量组 15 0.491±0.043△△ 0.014±0.0003△△心痛泰高剂量组 14 0.448±0.033△△ 0.011±0.002△△
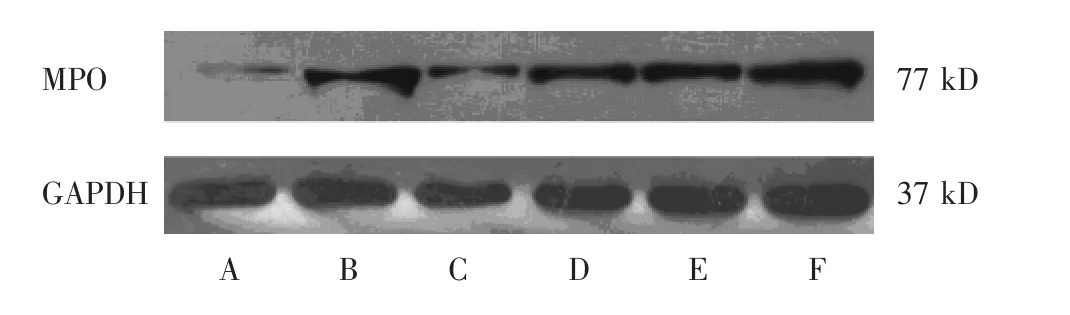
图4 各组MPO蛋白表达条带
2.5 各组RhoA蛋白、RhoA mRNA表达水平比较
见表5,图5。与空白组比较,模型组RhoA蛋白、RhoA mRNA表达升高,差异有显著统计学意义 (P<0.01);与模型组比较,心痛泰低剂量组RhoA蛋白、RhoA mRNA表达降低,差异有统计学意义(P<0.05);与模型组比较,阳性组、心痛泰高、中剂量组RhoA蛋白、RhoA mRNA表达均降低,差异有显著统计学意义(P<0.01);心痛泰高剂量组RhoA蛋白、RhoA mRNA表达虽高于阳性组,但差异无统计学意义(P>0.05)。
表5 各组RhoA蛋白、RhoA mRNA表达比较(±s)
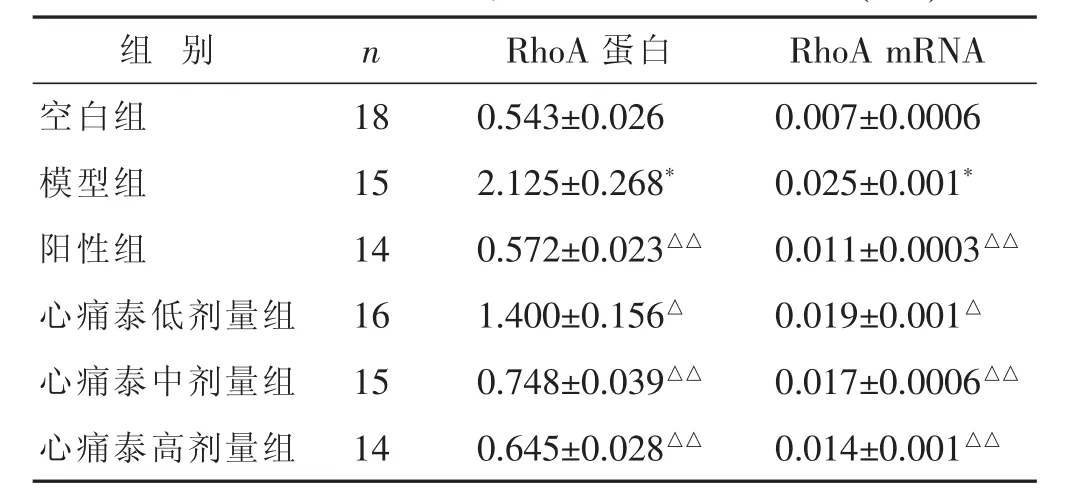
表5 各组RhoA蛋白、RhoA mRNA表达比较(±s)
组 别 n RhoA蛋白 RhoA mRNA空白组 18 0.543±0.026 0.007±0.0006模型组 15 2.125±0.268* 0.025±0.001*阳性组 14 0.572±0.023△△ 0.011±0.0003△△心痛泰低剂量组 16 1.400±0.156△ 0.019±0.001△心痛泰中剂量组 15 0.748±0.039△△ 0.017±0.0006△△心痛泰高剂量组 14 0.645±0.028△△ 0.014±0.001△△

图5 各组RhoA蛋白表达条带
2.6 各组eNOS蛋白、eNOS mRNA表达的比较
见表6,图6。与空白组比较,模型组eNOS蛋白、eNOS mRNA表达降低,差异有显著统计学意义 (P<0.01);与模型组比较,阳性组、心痛泰高、中、低剂量组eNOS蛋白、eNOS mRNA表达均升高,差异有显著统计学意义(P<0.01);心痛泰高剂量组eNOS蛋白表达低于阳性组、eNOS mRNA表达高于阳性组,但差异无统计学意义(P>0.05)。
表6 各组eNOS蛋白、eNOS mRNA表达比较(±s)

表6 各组eNOS蛋白、eNOS mRNA表达比较(±s)
组 别 n eNOS蛋白 eNOS mRNA空白组 18 0.568±0.033 0.019±0.0021模型组 15 0.175±0.013* 0.002±0.0001*阳性组 14 0.567±0.047△△ 0.013±0.001△△心痛泰低剂量组 16 0.336±0.022△△ 0.003±0.0003△△心痛泰中剂量组 15 0.376±0.024△△ 0.006±0.0005△△心痛泰高剂量组 14 0.489±0.058△△ 0.018±0.002△△
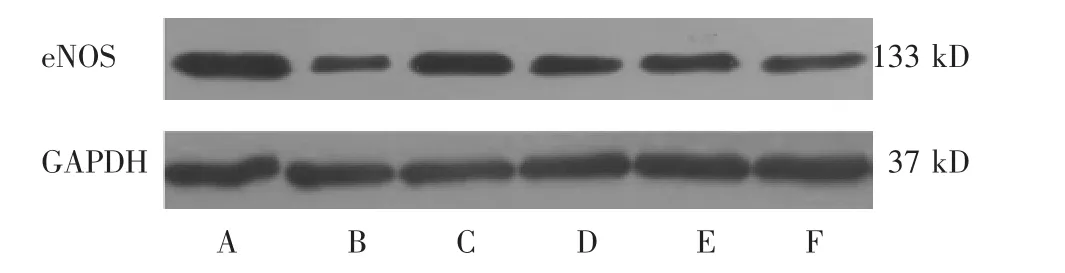
图6 各组eNOS蛋白表达条带
3 讨 论
中医无动脉粥样硬化一说,但其多认为,脉为心所主,是奇恒之腑,是气血运行的主要通道,与现代医学的血管在解剖形态上具有同一性,因此多将动脉粥样硬化归属于“脉痹”的范畴。本病主要因外感六淫、情志内伤、饮食劳倦等常导致脏腑气机运行障碍,气机阻滞后常引起血液在脉道中运行异常,脉络瘀阻而发为本病,其病机多为“气滞血瘀,阻滞经络”[9-10]。心痛泰以丹参活血祛瘀止痛,合有“血中气药”之称的川芎共为君药,三七、郁金、木香、山楂共为臣,助君药调畅气机祛瘀止痛,佐以葛根、枳壳,一升一降共调气机。诸药配伍,共奏活血化瘀、理气止痛之功。
Toll样受体是白细胞介素-1受体/Toll样受体超家族的一部分,具有富含亮氨酸重复序列的细胞外N末端配体识别结构域和具有Toll/白细胞介素-1受体(TIR)信号结构域的胞质羧基末端尾。TLR4是toll家族中重要的一员,其与动脉粥样硬化的形成密切相关[11]。p38 MAPK是丝裂原活化蛋白激酶家族中最重要的抗炎成员之一,其可通过渗透性休克、氧化应激等多种炎症反应促进白细胞的聚集和活化,引起血管炎症反应[12]。MPO是炎症及氧化应激标志物,可氧化脂蛋白,引起血管痉挛,损伤内皮细胞,促使斑块糜烂、破裂,促进动脉粥样硬化。同时,MPO通过与结合内皮细胞,跨膜转运到内皮下基质,浸润血管组织,消耗一氧化氮,引起血管内皮舒张功能障碍[13]。RhoA是小G蛋白Ras大家族Rho亚族的成员,是重要的细胞内信号分子,RhoA被激活后可与Rho激酶结合,进一步磷酸化下游底物,从而调节细胞的分泌、增殖等;有研究表明,RhoA蛋白与Rho激酶活化后可抑制血管内皮细胞eNOS的表达[14-15]。血管内皮的损伤是导致动脉粥样硬化的重要原因,而eNOS可依赖氧化应激影响内皮功能和新生内膜形成,在动脉粥样硬化小鼠模型中,发现eNOS解聚导致的超氧阴离子的生成作用显著增加,加速小鼠的动脉粥样硬化斑块的形成[16-17]。
本研究结果显示,心痛泰可降低TLR4、p38 MAPK、MPO、RhoA蛋白及其mRNA的表达水平,升高eNOS蛋白及mRNA的表达水平;且在心痛泰使用到高剂量时,其调控作用更加显著。这可能阐释心痛泰通过降低TLR4、p38 MAPK、MPO等炎症因子,降低与血管内皮功能相关的RhoA表达水平,提高eNOS的表达水平,从而起到减轻动脉粥样硬化炎症反应,保护血管内皮,来起到治疗动脉粥样硬化的作用,且其调控作用与其使用剂量呈正相关。
