守恒法在高中化学解题中的应用分析
2018-09-21钟淮真
钟淮真
(福建省厦门海沧实验中学 361026)
在高中化学教学过程中,涉及许多化学实验,物质在一定条件下生成新物质的过程即为化学反应.在化学反应过程中分子分裂成若干原子,并重新组合生成新物质,期间会产生化学量,这些化学量在反应前后总量不变,称之为化学反应守恒.依据化学量之间守恒关系,可解决化学反应相关问题,为此在高中化学教学过程中,需向学生讲述守恒法有效应用方略,为学生有效解决化学反应问题奠定基础.
一、守恒法定义
守恒现象在自然界中普遍存在.在化学反应过程中,可运用守恒法对化学反应前后原子变化情况进行分析,介于原子数量在反应前后不变,借助守恒法可分析化学反应中物质质量关系.高中化学教师在指导学生运用守恒法解决化学反应问题时,无需思考化学反应条件、操作方法等客观因素,只需从化学反应物质本身着手,思考其反应前后的状态,便可达成解答化学问题的目的.守恒法由能量守恒、电子守恒、化合价守恒、质量守恒、原子守恒等形式构成,适用于任何化学反应的分析与计算,教师在指导学生善用守恒法同时,需引导学生掌握各类守恒法应用方略,提升守恒法综合应用效率,达到提高学生化学能力的目的.
二、守恒法在高中化学解题过程中的应用分析
通过对守恒法定义进行分析可知,该方法可用于分析解决与化学反应相关的一些问题,为此教师应从化学教育实况出发,以学生为教育主体,帮助学习分析其在化学解题过程中存在的问题与困难,引导学生善于使用守恒法解决不同的化学问题,以提高学生的解题效率并由此提升高中化学教育质量.下面笔者浅析各种守恒法在解题中的具体应用.
1. 质量守恒法
在化学反应前后,化学物质质量总和不变,呈现出质量守恒结果.基于该原理,教师指导学生学会对化学反应关系式中的物质进行推断与计算,使化学问题得以有效解决

解析这是一道较为经典化学例题,旨在考查学生质量守恒法灵活运用能力,基于C2H8N2化学反应前后原子个数相等,由此可知燃烧反应后有2个碳原子,6个氮原子,8个氧原子,8个氢原子,运用质量守恒法,可得出2X中有氮原子4个,氧原子8个,每个X分子中,有氧原子4个,氮原子2个,继而得出X化学式为N2O4.
2. 能量守恒法
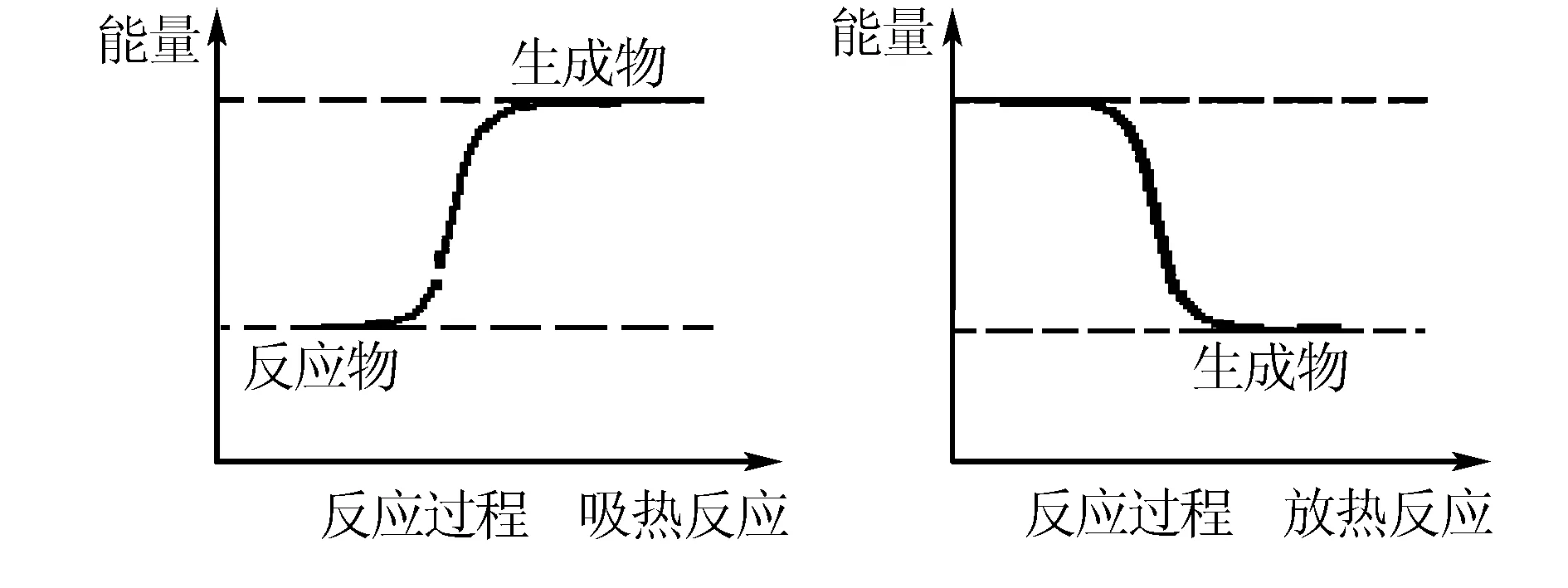
能量既不会凭空产生,也不会凭空消失.在任何化学反应中也一样,不管经历什么样的能量形式转化,总能量一定守恒.教师应以此为依据引导学生充分应用能量守恒法,简化解题思路,提高化学问题解题成效.如在讲解如何利用反应物具有的总能量与生成物具有的总能量的相对大小来分析化学反应的热效应时,教师就可以利用能量守恒法帮助学生理解判断:如图所示,当反应物具有的总能量高于生成物具有的总能量时,为了遵循能量守恒,高出来的一部分能量去哪里了?以热量的形式释放出去了,所以反应为放热反应;反之当反应物具有的总能量低于生成物具有的总能量时,生成物高出来的部分能量哪里来?从外界获取即吸收热量,故反应为吸热反应.这样一分析即强化了能量守恒的观念,同时也帮助同学们在理解中记忆了知识,得到事半功倍的效果.
3.原子守恒法
在化学反应前后原子种类及数量不会发生变化,基于此可有效解决化学反应相关问题,简化化学计算及推导的步骤,同时提高解题的正确率.教师在利用原子守恒法指导解题的教学过程中,应着重培养学生探究化学反应式前后元素的转化关系,继而得出结论.
例2 浓HNO3与38.4 mg铜进行化学反应,待铜完全反应后,收集22.4 mL气体,请学生分析在化学反应过程中HNO3消耗量是多少?
解析在该例题中铜与浓HNO3反应生成Cu(NO3)2、NOx,其中浓HNO3起两部分作用:作氧化剂和酸的作用,其中起到氧化剂作用的浓HNO3被还原成22.4 mL NOx;起酸作用的浓HNO3反应后生成Cu(NO3)2.经分析可得出原子守恒关系式n(HNO3消耗)=n(NOx)+2×n(Cu(NO3)2),得出化学反应过程中共消耗HNO3:1×10-3mol +1.2×10-3mol=2.2×10-3mol,故得出结论,HNO3共消耗2.2×10-3mol.
教师在引导学生应用原子守恒法解决化学问题特别是相关计算问题时,应引导其关注化学关系中式中的反应元素,依据化学反应前后元素种类及数目不变的观念掌握其去向及量的变化情况,继而得出化学问题结论.
4. 电荷守恒法
电荷守恒法产生与应用基础在于电荷不会因化学反应而改变或消灭,反应前后化学物质电荷总数不变.应用该方法,学生可有效解决化学反应问题,提升化学解题速度.电荷守恒原理经常用于解决电解质溶液的常见问题.
例3 在常温下将甲酸(HCOOH)与NaOH溶液进行混合,所得溶液pH>7,试析该化学溶液中c(HCOO-)和c(Na+)的关系.
解析在分析这道化学问题时,需用电荷守恒法,经分析得出关系式:c(Na+)+c(H+)=c(HCOO-)+c(OH+),基于问题中说明溶液pH>7,继而得出c(H+)
5.得失电子守恒法
氧化还原反应知识是高中化学学习中的重点也是一大难点,其中氧化还原反应的配平更是重中之重.氧化还原反应配平方法有很多:顺配法、逆配法、双向配平法等等,但不管用什么配平方法,利用得失电子守恒法指导学生进行氧化还原反应配平是教学中的基本手段.


