17β-雌二醇浸浴对小黄鱼早期生长及性腺发育的影响
2018-09-19周锋祺谢庆平孟祥磊陈睿毅王立改徐冬冬
周锋祺,谢庆平,楼 宝,孟祥磊,何 雪,孙 毅,詹 炜,陈睿毅,刘 峰,王立改,徐冬冬
(1.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316021;2.嵊泗县海洋与渔业局,浙江嵊泗 202450)
鱼类生存的水域环境分布广泛、自身种类丰富,其性别决定也具有多样性[1]。同时,鱼类的性别也具有高度的可塑性[2],性别除了由遗传因素决定外,还可以通过环境因素产生影响,这些因素包括类固醇激素、温度、密度等[3-4]。类固醇激素对性别影响的研究中,以雌激素(雌二醇17β-estradiol,E2)较多,雌二醇是一种常用的诱导雌性化的类固醇激素,即使在低浓度下也具有高效的雌激素效应[5],因此被认为是性别决定过程中的关键因子。例如:方永强等[6]使用E2浓度为10 mg/kg诱导实验中,鲻鱼Mugil cephalus有90%以上的雌性率;张晓彦等[7]通过浸浴E2的方式,对半滑舌鳎Cynoglossus semilaevis的处理中,1 μg/L和30 μg/L的雌性率分别为74%和97%。诱导鱼类雌性化的方法通常有投喂、浸浴、注射和埋植雌激素,这些方法都可以诱导产生性逆转的雌鱼,但过量的激素处理也会影响其生长发育,不足又会导致诱导不成功。
小黄鱼Larimichthys polyactis俗称厚鳞仔、黄花鱼、小黄瓜,是我国重要的经济海产鱼类之一,为渤、黄、东海群众及机轮渔业的主要捕捞对象[8]。由于过度捕捞,环境污染,气候环境变化等原因,小黄鱼捕捞量急剧下降,捕获的小黄鱼个体表现出日趋小型化、性成熟提前的现象,种质资源退化相当严重,已经无法满足人们的消费需求[9-11]。2000年,在黄海南部捕捞野生小黄鱼的雌雄性比平均为1:2.7;且形态上雌性的体形比雄性稍大[12]。2015年,小黄鱼全人工繁殖技术取得成功[13],人工养殖试验过程中也发现雌鱼体型比雄鱼偏大,更具有经济价值。因此,实现小黄鱼全雌化育种成为了现有阶段的主要目标,本研究用不同浓度雌激素E2诱导孵化后17 d的小黄鱼,通过常规测量及组织切片观察的方法研究该药物对小黄鱼生长和性腺发育的影响,为研究小黄鱼性别分化的机制奠定理论基础。
1 材料与方法
1.1 实验材料
实验时间从2017年5月开始,在浙江省海洋水产研究所西轩渔业科技岛海水鱼类营养联合实验室进行实验。实验鱼苗为浙江省海洋水产研究所自主人工繁育的F3代鱼苗,在500 L蓝色玻璃钢水缸中孵化、养殖。实验所用海水为经高位池沉淀和砂滤池过滤处理之后的海水,由于小黄鱼人工自然水温养殖环境下雌雄性比近似为1:1,因此本实验水温采用自然水温,实验期间水温范围为19~27℃,盐度29左右,供氧充足。实验前期投喂轮虫、丰年虫和桡足类,孵化后15 d开始投喂配合饲料,每日4次,定时、饱食。
1.2 实验设计及样品处理
实验用药品采用浸浴的方式,即直接将配置好浓度的药品加入养殖缸体中。本研究E2处理鱼的浸浴液的配制是先将纯度为99%的E2粉末药品(Sigma,德国)用95%乙醇溶解,配置成4 mg/mL的浸浴液母液,并避光保存。设置 3 个浸浴实验组,浸浴浓度分别为 1(E1)、10(E10)、50(E50)μg/L;即分别在养殖缸体400 L水中分别直接加入0.1、1和5 mL浸浴液母液,同时设置2个对照组:95%乙醇组C(95%)和正常养殖组C(0,无任何添加)。在小黄鱼孵化17 d时开始进行浸浴实验,按实验浓度梯度1、10和50 μg/L分别于水缸中浸浴,C(95%)按照E2 50 μg/L的添加量,加入同等体积5 mL 95%乙醇。每日断水浸浴2 h,浸浴后充分换水并开启流水,保证药物在水体中无残留,持续60 d。分别在浸浴处理20、40和60 d时测量体长(精确到0.1 cm)、体重(精确到0.01 g)、性腺重等数据并进行性腺取材。20、40和60 d C(0)数据取自同期水泥池人工繁育鱼苗。
1.3 组织切片观察
性腺组织用1:15以上体积的波恩氏液固定过夜,石蜡包埋性腺,梯度乙醇脱水:75%乙醇3次,每次5 min;80%乙醇 1次,2 min;90%乙醇 1次,2 min;95%乙醇 1次,2 min;100%乙醇 3次,每次 2 min;乙醇二甲苯混合液(V:V=1:1)1次,10 min。二甲苯透明:二甲苯I 1次,时间随材料大小变动,材料越大时间越长;二甲苯II 1次,时间随材料大小变动,直至材料透明。浸腊:二甲苯石蜡混合液(V:V=1:1)1 h;石蜡2 h;包埋:材料整齐摆放在平皿内,将液体石蜡倒入平皿,保证石蜡凝固后可以浸没材料,水平室温放置,待其凝固后4℃保存。切片采用横切,厚度为5 μm。使用RM2245切片机(莱卡,德国)。
1.4 H.E(苏木精-伊红)染色
对材料进行石蜡切片HE染色,用于观察性腺组织结构,步骤如下:二甲苯脱蜡、梯度乙醇脱水至75%乙醇后,苏木精染色:苏木精,10 s左右;自来水反蓝:流水冲洗,15 min;超纯水,2 min;酸水分色(可不用),10 s左右;梯度乙醇脱水:70%乙醇,2 min;80%乙醇,2 min;95%乙醇,2 min;伊红染色,依情况而定30~60 s;95%乙醇冲洗,2 次;100%乙醇脱水,2 min;二甲苯透明:1/2 二甲苯+1/2 乙醇,10 min;二甲苯 I,10 min;二甲苯Ⅱ,10 min;中性树胶封片。通过Carl Zeiss Axio Imager A2(蔡司,德国)显微镜拍照,观测性腺组织的结构和发育状况,并判断性别。
1.5 数据分析
实验数据通过SPSS17.0统计软件进行处理,单因素方差分析(One-Way ANOVA)跟随Duncan氏检验各生长参数的显著性水平,P<0.05为显著。
数据中性腺成熟系数(Gonadosomatic index,GSI)的计算公式为:(性腺重/体重)×100%。
2 实验结果
2.1 E2浸浴对小黄鱼早期生长发育的影响
采用不同浓度的雌激素E2(1、10和50 μg/L)对孵化后17 d的小黄鱼进行持续60 d浸浴,结果表明,随着浸浴激素浓度的升高,3种不同浓度浸浴组与对照组C(95%)、C(0)相比,小黄鱼的体型呈减小趋势(图1a)。采集并进行统计学分析各实验组体长与体重,结果显示,在20 d时,实验组组间在体长和体重上均没有显著性差异(P>0.05),对照组 C(95%)和 C(0)高于各实验组且有显著性差异(P<0.05);在 40 d 时,实验组组间在体长上没有显著性差异,但体重方面,E50显著性低于E10与对照组C(95%)、C(0),但与E1没有显著性差异,E10与C(95%)、C(0)无显著性差异,且显著高于E1与E50。在60 d时,小黄鱼E10与E50相比体长和体重均无显著性差异,且两者显著低于E1与对照组C(95%)、C(0),E1与对照组相比,体长与体重均显著低于对照组C(95%)、C(0),两个对照组之间无差异(图1b)。
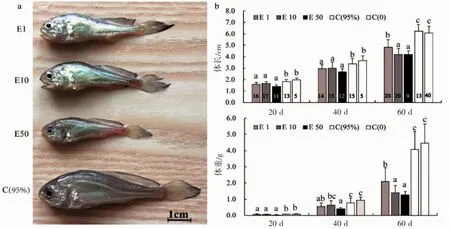
图1 不同浸浴浓度雌激素(E2)对小黄鱼生长发育的影响Fig.1 Effects of different concentrations of estrogen (E2)on the growth of L.polyactis
2.2 E2浸浴对小黄鱼性腺发育及性腺成熟系数的影响
于60 d时,秤取不同浓度浸浴实验组和对照组C(95%)、C(0)性腺重量,区分对照组雌雄并分别计算GSI。统计学分析表明,实验组 E1、E10、E50 和 C(0)雌性相比GSI没有显著性差异,并且这四组显著高于C(95%)雄性、C(95%)雌性和 C(0)雄性(图 2)。
对E2不同浓度浸浴组(1、10和 50 μg/L)及对照组C(0)雌性、C(0)雄性、C(95%)雄性和 C(95%)雌性小黄鱼于60 d时进行解剖学观察,由于性腺在腹腔内难于辨认,因此滴加波恩氏液再进行拍照,结果表明,对照组C(0)性腺已经产生较为明显的雌雄差异,C(0)卵巢与C(0)精巢相比性腺发育较粗、饱满、易识别;E1和E10与C(0)卵巢相似,但性腺长度更短,性腺头端更加粗短,随着浓度的升高,更加倾向于圆柱形,E50性腺发育畸形,鱼鳔末端与性腺末端相连,形成块状。C(95%)卵巢与精巢从外观上无法准确辨认雌雄,且它们之间的GSI数据没有显著性差异(图3)。
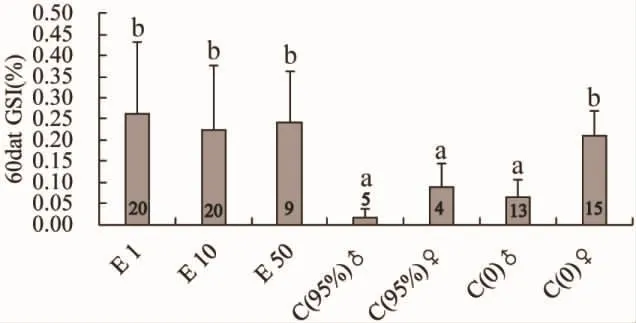
图2 不同浸浴浓度雌激素E2对小黄鱼性腺成熟系数的影响Fig.2 Effects of different concentrations of estrogen (E2)on Gonadosomatic index of L.polyactis

图3 不同浸浴浓度雌激素E2及对照组小黄鱼性腺解剖学观察Fig.3 The morphology and anatomical observation of gonads in different concentrations of estrogen (E2)and control groups of L.polyactis
2.3 E2浸浴小黄鱼性腺组织学观察
组织学观察不同浸浴浓度E2及对照组小黄鱼性腺(图4)。结果表明,60 d时对照组C(0)卵巢已出现二时相至三时相卵母细胞,并伴有卵巢腔,而C(0)精巢仍然未开始减数分裂,性腺充满精原细胞。C(95%)卵巢虽出现了二时相的卵母细胞,但整个卵巢发育不饱满,体细胞较多,呈现出发育滞后的状态;C(95%)精巢则形态松散,只见少量的精原细胞。E1、E10、E50组均出现二时相至三时相卵母细胞,E1、E10组有明显卵巢腔,E50组性腺形状非圆形。
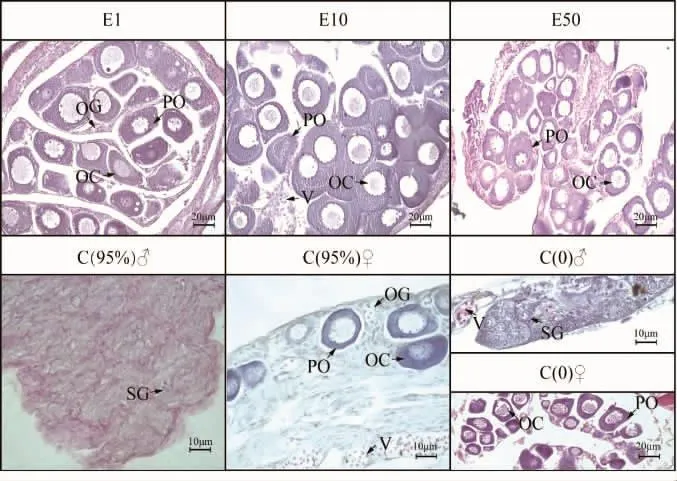
图4 不同浸浴浓度雌激素(E2)及对照组小黄鱼性腺组织学观察Fig.4 Histological observation of the gonads in different concentrations of estrogen (E2)of L.polyactis
通过组织切片观察,统计不同雌激素E2浸浴组及对照组小黄鱼性别比例情况,结果表明,E1的雌性率为82%,E10为88%,E50为63%,当浓度达到E10以上时,未发现雄性及未分化性腺,且随着浓度的上升,出现畸形的比率上升。C(95%)养殖的雌雄性别比例与C(0)的雌雄性别比例相近,都近似1:1(表1)。

表1 不同雌激素(E2)浸浴对小黄鱼性别比例的影响Tab.1 Effects of different concentrations of estrogen (E2)on sex ratio of L.polyactis
3 讨论
3.1 雌激素E2抑制小黄鱼的生长
本研究中各实验组浓度均抑制了小黄鱼的生长发育,且随着E2浓度的升高,抑制作用与对照组相比更显著。这点主要表现为E2浸浴组在60 dat时体长与体重均显著性低于对照组。本研究结果与CARVALHO,et al[14]在小锯盖鱼Centropomus undecimalis的投喂实验组,50和100 mg/kg均抑制体长和体重的增长;BULKLEY[15]报道的斑鮰Ictalurus punctatus摄食含有乙基雌酚的饵料时,当浓度为2.2 mg/kg会出现生长减慢。及BLÁZQUEZ,et al[16]在欧洲鲈Dicentrarchus labrax中也发现E2会抑制体重的增长结果相一致。然而,MALISON,et al[17]发现投喂浓度为15 μg/g的含有E2的饲料,可以促进金鳟Perca fkvescens的体重增加;李国超[18]选用10 ng/L的E2溶液分别对10 hpf(受精后10 h)的斑马鱼幼鱼进行处理,得出E2的毒性主要体现在会抑制细胞增殖和增强皮肤屏障作用,也推测出高浓度E2会影响了某些控制体轴发育的关键基因的正常表达。因此E2对小黄鱼生长上呈负面影响,这一点可能是由于E2的毒性所致。这些研究表明雌激素用于鱼类生长的实验,有正负两方面的结果。这取决于对激素种类、剂量的选择和实验鱼对所用激素、剂量的适应性[19]。
3.2 雌激素E2可诱导小黄鱼雌性化
由于小黄鱼人工自然水温养殖环境下雌雄性比近似为1:1,在自然水温的条件下的人工养殖对小黄鱼性腺分化的影响较小,因此本研究水温采用自然水温,并没有对养殖水温进行控制。根据表1的统计结果表明,雌激素E2对小黄鱼卵巢的分化具有促进作用,浸浴低剂量的E2便可提高小黄鱼的雌性比例,且E2对性腺的发育有一定的抑制作用,随着浓度的升高,会出现性腺发育畸形的现象。本研究结果与MEIJIDE,et al[20]在玉丽体鱼Cichlasoma dimerus中浸浴浓度为1 μg/L的E2诱导雌性率为88.5%,实验中出现了兼性性腺但未发现不育性腺一致,而BLÁZQUEZ,et al[16]在欧洲鲈中雌激素投喂实验发现在受精后60~260 d的期间E2诱导会出现兼性和不育性腺,乙炔基雌二醇(17α-ethynylestradiol,EE2)诱导会出现不育性腺,正常雌性诱导率分别为13%和80%,在48~88 dpf时期段EE2处理不会发生畸形性腺的现象,在226~426 dpf时期段E2处理会发生兼性性腺的现象。王星等[21]在E2浓度为259、1 180 ng/L的浸浴处理中,稀有鮈鲫Gobiocypris rarus雄性性腺则出现了明显的萎缩现象,精巢组织中的大量生殖细胞被脂肪组织取代,精巢生殖细胞数量减少。本研究中E2处理从低浓度到高浓度都有部分畸形性腺发生,由于处理时期较早,未发现兼性性腺。PANDIAN,et al[22]总结出类固醇激素处理会导致部分鱼类兼性性腺或性腺不育。雌激素的处理的时间和种类对性腺发育和分化也会有相应影响。
3.3 乙醇抑制小黄鱼性腺的发育
本研究中,低剂量的乙醇浸浴对小黄鱼幼鱼的生长发育及性别分化影响较小,这主要体现在乙醇浸浴组与无添加乙醇对照组体长体重均无显著差异,及这两组中性别比例都近似1:1。但乙醇浸浴对性腺的发育具有抑制的作用,这体现在95%乙醇浸浴组与不添加乙醇组的GSI水平前者显著低于后者。在哺乳动物研究中,CALLEJA,et al[23]认为酒精通过不同的机制产生的毒性,会导致许多激素的变化,导致性腺器官的功能障碍和不育的问题,在白鼠的酒精处理实验中也发现白鼠的体重增加缓慢,睾丸体积减小且抑制精小管的发育,这与本研究结果一致。而OXENDINE,et al[24]在青鳉Oryzias latipes受精卵发育0~3、3~6和6~9 d三个时期分别暴露在0.1%、0.5%和1%的乙醇浓度下,结果现实三种乙醇浸浴浓度均抑制了青鳉鱼头宽的增长。体长的生长在0~3和6~9 d这两个时期受抑制最为明显,这一点与本研究不同,可能是由于本研究所加的乙醇浓度非常低所致。因此,根据乙醇暴露剂量的不同,会对仔鱼生长和性腺发育产生抑制作用。
综上所述,本研究发现不同浓度(1、10和50 μg/L)E2浸浴都将引起小黄鱼群体的雌性化并抑制身体生长,随着浓度的升高,抑制作用越显著。综合比较雌性化率及产生畸形率得出当E2浓度为10 μg/L时,诱导效果最好,主要表现在雌性率最高。
