眼点拟微绿球藻养殖过程中细菌污染的治理方法
2018-09-19耿金峰赵鄢鹏蔡忠贞王慧岭张晋阳刘敏胜白雪梅
耿金峰,赵鄢鹏,冯 倩,蔡忠贞,王慧岭,张晋阳,王 冰,刘敏胜,白雪梅
(新奥科技发展有限公司,煤基低碳能源国家重点实验室,河北廊坊 065001)
微藻是一类种类繁多、生长速度快、具有极大应用价值的生物资源。微藻是海洋生物资源的重要来源,是生态系统中最主要的初级生产者。藻类是地球上通过光合作用合成物质量最多的生物,它合成的物质量约占全部光合作用合成生物量的1/3。许多海洋微藻富含对人体有重要生理作用与保健功能的长链多不饱和脂肪酸,微藻及其代谢产物可用于天然食品、营养品、保健食品、生物饵料、生物肥料、可持续生物能源生产等方面,具有重要的经济价值和社会价值[1-5]。其中眼点拟微绿球藻体内含有大量的二十碳五烯酸(EPA),是天然的EPA来源[6-7],其藻粉添加到畜禽饲料和畜牧饲料中,将提高鸡蛋中EPA含量和动物肉质中EPA含量,提升产品营养价值和附加值,可为养殖户增加收入;而且眼点拟微绿球藻已经进入中国饲料原料目录中,具有巨大的应用潜力。
世界范围内很多科研机构和高校都在对微藻进行着系统的、深入的、高水平的研究[8]。在研究条件稳定的情况下,其微藻的产量较高,如Zhang等[9]在日本的北方地区,夏季利用1.5 cm板式反应器培养集胞藻,在试验控温的情况下占地面积产量可达39.0 g/(m2·d);Torzillo等[10]研究发现养殖水平可达到14.8 g/(m2·d);Moheimani等[11]报道的养殖水平为16.0~33.5 g/(m2·d)。而微藻生产企业实际的户外微藻养殖中产量较低,一般在5~10 g/(m2·d)。究其原因,除了自然的晴天、阴天、多云、高温、低温等多变的条件外,还有一个重要的影响因素就是敌害生物污染问题。微藻养殖过程若遇到严重的敌害生物污染发生,将会导致养殖颗粒无收[12]。因此,微藻养殖过程中的敌害生物污染严重制约着微藻的规模化过程,限制生物资源的开发,限制眼点拟微绿球藻在饲料产业中应用。目前科学家们对污染的关注度也是越来越高。微藻养殖过程的污染可分为原生动物污染和细菌污染,其中对原生动物污染目前研究成果显著,如吴松[13]使用表面活性剂、漂白粉对原生动物的灭杀;丛立晶等[14]利用酸化法、碱化法等对藻液中的纤毛虫、游捕虫进行治理;规模化较常用的方法还有碳酸铵盐法等[12,15]。而细菌和微藻是一个共生体[16-19],有些细菌对微藻有促进作用,有些细菌对微藻有抑制作用[20-22],甚至有些细菌具有溶藻的特性[23-25],可以导致藻细胞较快速死亡,严重的将导致养殖失败。目前针对细菌污染的有效方法是抗生素治理,如刘晓娟等[26]研究多种抗生素去除藻液中细菌,从而获得无菌藻株;宋程飞等[27]利用抗生素建立杜氏盐藻的无菌培养体系。但抗生素对环境存在污染,主要残留在水体中[28],将影响人类健康。抗生素残留去除的研究主要集中在畜禽类废水中,研究的去除方法有活性炭吸附、光降解、紫外法、臭氧法等[28-31],而藻液中关于抗生素残留的去除研究鲜见报道,而且部分抗生素对藻类的毒性很大[28]。因此,笔者以可应用于饲料领域的眼点拟微绿球藻为研究对象,针对该藻株户外养殖过程的细菌污染进行研究,首先筛选对藻细胞有致死作用细菌的有效抗生素,在此基础上针对抗生素开展深入的去除方法研究,获得的去除方法既要保证抗生素的有效去除同时又要保证不能对微藻生长带来显著的抑制作用。这些研究结果将会为微藻的细菌污染治理提供基础数据积累与支持,为眼点拟微绿球藻的户外稳定养殖提供一种抗细菌污染的技术储备。
1 材料与方法
1.1材料试验所用抗生素均购自Sigma公司,配制成1 g/L 母液,根据需要进行稀释(母液经0.22 μm滤膜除菌,稀释全过程无菌操作)。金黄色葡萄球菌,购自中国微生物研究所,编号1.2465。试验过程其他试剂均为常规分析纯试剂。
1.2仪器臭氧机,北京山美水美环保高科技有限公司CF-YG10型。分光光度计,日本岛津UV-2550型。
1.3藻种与培养试验所用眼点拟微绿球藻(Nannochloropsisoculata),由ENN生物质能源技术中心藻种质库提供。所有试验培养基均采用f/2海水培养基[16],盐度为(3.3±0.1)%。试验采用批次培养的方式进行。
细菌污染的藻液,简称污染藻液(下同):来自眼点拟微绿球藻户外培养过程得到,细菌数量在106/mL数量级上。其中导致藻细胞死亡的细菌已经得到分离,并得到分子鉴定。
1.4试验方法
1.4.1接种密度。各试验组藻细胞接种密度在0.8~1.0 g/L,主要以各试验组相同体积下具有相同的生物质量为原则。
1.4.2试验用反应器规格。玻璃板式反应器,10 cm(长)×5 cm(宽)×60 cm(高),其中反应器宽度即反应器光程。玻璃柱式反应器,内径5 cm、高度80 cm玻璃柱式(管式)反应器,一侧封口、一侧开口。
1.4.3抗生素选择试验。
1.4.3.1藻种对抗生素耐受性试验。从5大类抗生素(β-内酰胺类、氨基糖苷类、四环素类、大环内酯类和氯霉素类)中选择常见的抗生素对藻细胞进行其耐受性试验,依次分别选取青霉素、庆大霉素、四环素、红霉素和氯霉素,其中各抗生素的使用量均分别为50、100、200 mg/L这3个浓度梯度。
试验方法:各试验组使用100 mL三角瓶,装有30 mL无菌培养的藻液,根据表1依次加入对应量的抗生素,放置在摇床中、2 000 lx光强下摇床培养48 h,测定微藻生物量。根据生物量的增强情况考察藻细胞对不同抗生素的耐受范围。每组试验3个平行样。
1.4.3.2抗生素对细菌治理试验。根据藻细胞耐受性试验结果,选择对藻细胞无明显负作用的抗生素进行细菌治理效果试验,最终选择既具有细菌治理效果又不影响藻细胞自身特性的抗生素种类。
污染藻液分装到各组试验组的玻璃板式反应器中,每组试验3个平行样,每组反应器中加入800 mL的污染藻液;并按照表1所示加入对应种类的抗生素和加量,在10 000 lx光强的人工光源下连续培养7 d,反应器中底部通入含有5%二氧化碳的空气混合气,将藻液pH控制在7.5~8.5;同时每天监控藻细胞浓度和细菌数量。

表1 抗生素添加
1.4.4庆大霉素的检测。
1.4.4.1庆大霉素检测法的制定——比浊法。配制10个浓度梯度(2、4、6、8、10 mg/L)的庆大霉素标准液,分别取3 mL各标准液于100 mL三角瓶;每个样品3个平行。将提前活化至对数生长期的金黄色葡萄球菌稀释至OD580为1的菌悬液,取3 mL菌液加入已灭菌的LB培养基和生理盐水的培养体系中,并分装至灭过菌的100 mL三角瓶中,每瓶27 mL;将分装好的三角瓶于恒温振荡摇床上培养(摇床,140 r/min,37 ℃,避光);在3 h时检测菌液OD580。
1.4.4.2庆大霉素的去除。取20 L经庆大霉素治理后的藻液,经5 000 r/min离心5 min后,取离心清液开展试验。各组试验方法:①臭氧组。将臭氧发生器产生的稳定臭氧通过软管导入玻璃柱式反应器底部,通过软管连接的曝气石向藻液通入臭氧气体。试验组依次为试验5、试验6、试验7,分别通入臭氧0.5、1.0、2.0 h。②次氯酸钠组。将含量10%有效氯的分析纯次氯酸钠溶液按照各组所需有效氯浓度折算取量。试验组依次为试验8、试验9、试验10,分别加入次氯酸150、500、1 000 μL/L。③臭氧+紫外组。臭氧通入方式同①中所述,紫外处理指同时将15 W的紫外灯管直接插入玻璃柱式反应器中直接紫外照射藻液。④有效氯+紫外组。在②的基础上,同时将15 W的紫外灯管直接插入玻璃柱式反应器中直接紫外照射藻液。⑤紫外处理组。单独使用15 W的紫外灯管直接插入玻璃柱式反应器中直接紫外照射藻液。
参照表2,分装到内径5 cm的玻璃柱式反应器中,每个反应器中装800 mL。各试验组处理完毕后均通入空气20 min,以排除水中残留的臭氧因素等干扰。处理后的样品进行庆大霉素含量的检测,采用比浊法测定,利用标准曲线确定庆大霉素含量。
表2 庆大霉素去除方法
1.4.5细菌污染治理方法验证试验。取20 L经庆大霉素治理后的藻液,混合均匀后直接分装到内径5 cm玻璃柱式反应器中,每个反应器中装800 mL液体,每组3个平行样。试验设计:试验16为向藻液中同时加入150 μL/L 次氯酸溶液和利用紫外灯处理0.5 h。同时阳性对照(CK7)为无菌状态下的藻液,未经任何处理;阴性对照(CK8)为受到污染的藻液,不经过任何处理。以上试验组均在避光条件下进行操作,试验组通入空气与二氧化碳的混合气16 h,检测庆大霉素残留量,期间藻液避光。16 h后,给10 000 lx人工光,开始正常养殖5 d,每24 h进行OD检测。
1.5生物量的测定[32-33]取一定体积量V的藻液先利用3 500 r/min 进行离心分离藻细胞和培养液,藻液中若有细菌此时由于其自身质量轻、形态小,将在培养液层存在;再加入5倍V体积量的一次水进行溶解藻泥层,待混匀后进行抽滤,此时将藻细胞截留在滤膜(恒定质量,m0)上,并用等体积量蒸馏水悬浮藻细胞3次,最后将滤膜于105 ℃的烘箱过夜至恒定质量,冷却后称量m1。细胞质量浓度(g/L)=(m1-m0) /V。
2 结果与分析
2.1不同抗生素对藻细胞生长的影响图1为5种抗生素在3种浓度梯度下对眼点拟微绿球藻生长的影响程度。通过生物量生长数据对比可知,庆大霉素、四环素和红霉素在200 mg/L以内对藻细胞无明显的抑制作用;而青霉素在50 mg/L 时藻细胞就有较小的抑制作用,达到100 mg/L以上时对藻细胞抑制作用非常显著;氯霉素在50 mg/L对藻细胞无明显的抑制作用,当浓度达到100 mg/L以上时对藻细胞的抑制随着浓度的增加而显著提高。

图1 不同抗生素对眼点拟微绿球藻细胞生长的影响 Fig.1 Effect of different antibiotics on the growth of Nannochloropsis oculata cells
2.2不同抗生素对藻液细菌污染治理方法的研究由图2可知,污染藻液的阴性对照组(CK1组)未经任何处理,其藻细胞经过几日的连续培养,藻细胞逐渐大幅死亡,同时藻液中明显短杆状细菌增加。硫酸庆大霉素处理组(试验组1)和四环素处理组(试验组2),污染的藻细胞生长状态良好;其中试验组1藻细胞生长状态与空白对照组(CK2组)生长状态相当;试验组2前期抑菌效果明显,藻细胞生长状态良好,但后期抑菌效果差,细菌又得到大量繁殖,藻细胞生长受到明显的影响。红霉素处理组(试验组3)对导致藻细胞死亡的细菌无明显的治理作用,其试验组3藻细胞初期就开始死亡,细胞浓度呈现快速下降趋势。在选用的3种抗生素中,对导致拟微绿球藻死亡的细菌,有效的抗生素有庆大霉素,四环素短期有效,红霉素对该类细菌无抑制效果。

图2 不同抗生素对眼点拟微绿球藻的细菌污染治理情况对比Fig.2 Comparison of bacterial contamination control of Nannochloropsis oculata with different antibiotics
2.3庆大霉素去除方法的研究
2.3.1硫酸庆大霉素检测标准曲线测定结果。图3为以LB培养基作为金黄色葡萄球菌的培养体系、加入低浓度庆大霉素标准液(2、4、6、8、10 mg/L)培养3 h后检测的OD580结果。从图中可以看出,培养3 h后,菌悬液OD均与庆大霉素标准品中的庆大霉素浓度呈线性关系,且庆大霉素浓度越高,菌悬液OD越低,即庆大霉素浓度越高,对金黄色葡萄球菌的灭杀性越好,细菌的增长量越低。根据线性拟合结果Y=-6.355 7X+11.351 0(R2=0.991 7)可知,3 h时检测结果的线性关系良好。因此,利用比浊法检测水中庆大霉素时,应以LB培养基作为细菌的培养体系,培养3 h时进行检测的效果较好,且只能对低浓度的庆大霉素进行检测(检测范围为2~10 mg/L),对于高浓度的待测样品可进行适当倍数的稀释处理。
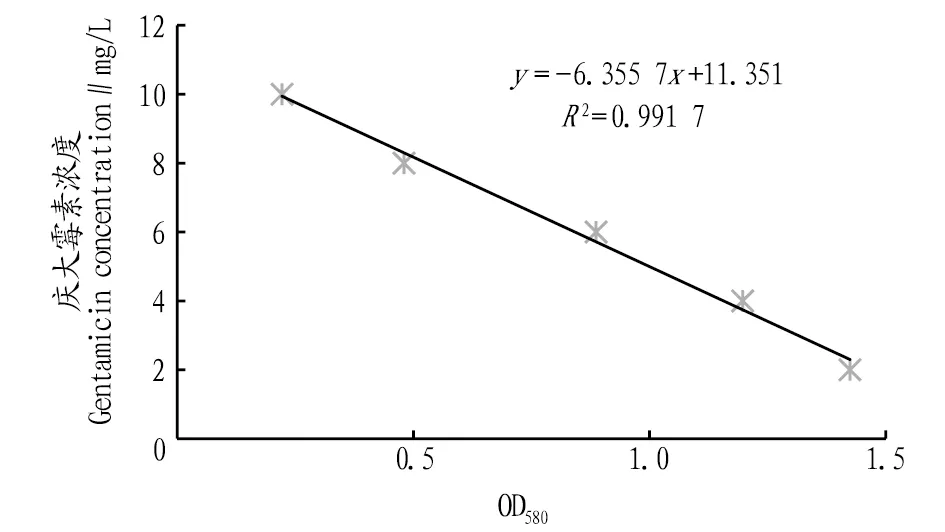
图3 测试样品中庆大霉素浓度变化Fig.3 Change of gentamicin concentration in the test sample
2.3.2庆大霉素去除方法的比较。各试验组的出水庆大霉素浓度和庆大霉素去除率见图4。根据检测结果可知,试验5(臭氧处理0.5 h)水样中庆大霉素浓度约为13.40 mg/L,去除率为81.83%;臭氧处理1.0 h组(试验组6)、臭氧处理2.0 h组(试验组7)水样中庆大霉素浓度分别为12.78和3.80 mg/L,折合去除率分别为82.69%和94.84%。臭氧氧化法去除水中庆大霉素具有一定稳定性和可应用性,随着作用时间的增加,庆大霉素的去除率可达到95%左右。而CK3对照组庆大霉素去除率为97.11%,表明藻液中通入臭氧后再经过20 min的曝气将过多的臭氧去除的方法对细菌无明显的致死作用,而且也消除了可能残留的臭氧气体对庆大霉素的干扰。
用一定浓度的有效氯氧化去除水中庆大霉素时,去除效果受有效氯添加量影响严重。15 mg/L有效氯组(试验组8)水样中庆大霉素浓度为34.23 mg/L,去除率为53.60%;50 mg/L 有效氯组(试验组9)水样中庆大霉素浓度为25.73 mg/L,去除率为65.12%;100 mg/L有效氯组(试验组10)水样中庆大霉素浓度为1.98 mg/L,去除率为97.31%,即添加有效氯的量低于50 mg/L时对庆大霉素去除效果较差,当添加的有效氯达到100 mg/L时,水样中庆大霉素含量降至1 mg/L以下时去除效果较好;且通过对CK4对照组结果可知,有效氯的加入对庆大霉素浓度的检测结果基本无影响。

图4 庆大霉素的化学方法去除对比Fig.4 Comparison of chemical removal of gentamicin
在图4方法的基础上,庆大霉素去除方法的使用过程中又增加了紫外照射的方法,2种方法结合对庆大霉素的去除效果如图5所示。根据检测结果可知,臭氧+紫外处理0.5 h组(试验组11)水样中庆大霉素浓度为2.30 mg/L,去除率达到97.41 %;15 mg/L有效氯+紫外处理0.5 h组(试验组12)水样中庆大霉素浓度为8.51 mg/L,去除率达到90.44%;50 mg/L有效氯+紫外处理0.5 h组(试验组13)水样中庆大霉素浓度为6.13 mg/L,去除率达到93.12%。2种方法的组合使用比单独每一种方法的去除效果明显。而单独使用紫外处理其庆大霉素的去除效果较差,紫外处理0.5 h组(试验组14)和紫外处理1.0 h(试验组15)的庆大霉素去除率分别为32.61%和67.99%。

图5 庆大霉素的物理方法去除对比Fig.5 Comparison of the physical methods of gentamicin removal
2.3.3细菌污染治理验证试验。庆大霉素的去除方法研究表明,有效氯和紫外照射这2种方法的共同作用对样品中庆大霉素的去除具有很好的作用。但“2.3.2”中研究方法是将藻液中的藻细胞利用离心方式去除,仅针对离心后的清液水体进行的方法研究。为此,在藻液中的应用也进行了研究,证实该方法在去除庆大霉素的同时,又对藻细胞本身无明显的负作用。

图6 藻液中庆大霉素去除方法对养殖的影响情况Fig.6 Effect of gentamicin removal method on culture in algae solution
由藻液中庆大霉素去除方法对养殖影响情况对比(图6)可知,CK7对照组与CK8对照组藻细胞生长情况相当,说明在庆大霉素治理藻细胞细菌污染时,庆大霉素的治理效果很好,治理后的藻细胞保持与无污染正常状态下藻细胞相同的生长状态;而试验组16在庆大霉素去除的试验前期藻细胞生长迟缓,藻细胞第1天负增长,从第2天开始逐渐恢复,说明庆大霉素去除方法中的15 mg/L有效氯对藻细胞具有一定的损伤,随着养殖天数的增加,藻细胞形状逐渐恢复,生长趋于正常。治理后的第2天,测定藻液中的庆大霉素含量,CK8的庆大霉素含量为80.15 mg/L,通过有效氯和紫外2种方法一同处理的试验组16中庆大霉素含量为5.05 mg/L,则庆大霉素的去除率为93.70%。
3 讨论与结论
该研究过程中,首先通过藻细胞对5种抗生素的耐受性选择,选定3种抗生素;并对3种抗生素对污染藻液进行污染治理效果的筛选,确定出硫酸庆大霉素对眼点拟微绿球藻中致死菌具有很好的灭杀作用,并可将受到细菌污染的藻液治愈成生长速度正常的藻细胞,有利于微藻的持续养殖。该试验选出的最佳试剂为庆大霉素,参考刘晓娟等[26]给出的庆大霉素对眼点拟微绿球藻细胞的生长抑制率为8.95%的结论,可以初步确定硫酸庆大霉素对藻细胞负作用较低,而且对细菌具有良好的致死作用。该方法有利于户外连续养殖的稳定性。虽然硫酸庆大霉素对藻液中致死菌具有较好的杀灭作用,但硫酸庆大霉素毕竟是一种抗生素,如果将残留庆大霉素的水体外排将严重污染环境[24]。因此该研究考察几种方法单独处理庆大霉素的作用效果,以及2种方法联合处理庆大霉素的作用效果。
从试验数据可知,单独使用治理方法中,通入臭氧2 h和100 mg/L高浓度有效氯的方法对庆大霉素的去除效果最好,去除效率可达到97%以上。虽然庆大霉素的去除率很高,但由于单独方法中单一方法使用药剂的剂量或作用时长较大,对藻细胞的损伤很大,有些剂量最严重可导致藻细胞死亡,因此这些方法不适宜对庆大霉素处理后的藻液再进行庆大霉素的去除。但是单一的去除方法作用简单、操作简便、庆大霉素去除率高,这些优点可将该方法应用于去除藻细胞后的清液的庆大霉素的去除,将清液中的庆大霉素含量尽可能地降到最低,为抗生素的深入去除奠定基础。
在2种方法联合处理庆大霉素方面:臭氧0.5 h+紫外0.5 h和15 mg/L有效氯+紫外0.5 h,这2种联合作用方法在去除庆大霉素方面效果最好,去除率可达90%以上。上述方法均可应用到藻液中,但臭氧较长时间通入到藻液中,会对藻细胞产生较为严重的负影响。该试验中所采用的15 mg/L有效氯+紫外0.5 h的方法是非常有效的一种去除藻细胞中庆大霉素残留的方法,虽然应用前期也存到一些负影响,其原因是有效氯对藻细胞的作用导致藻细胞受到一定损伤,但藻细胞性状很快就能得到恢复,达到之前的生长速度,因此该方法可作为室内外养殖的藻种环节针对该类细菌污染时的一种有效的治理方法,也为微藻稳定养殖提供细菌污染治理方面的数据积累和技术支持,为眼点拟微绿球藻的稳定养殖提供一种有效的治理细菌污染的方法,促进该藻株的稳定养殖及产业化推广,有助于EPA饲料产业及EPA产品市场的发展。
