灵芝转化体系的建立
2018-09-19孙墨可李晓薇孙晓文董玉迪李海燕
孙墨可,李晓薇,孙晓文,张 曼,田 娟,董玉迪,李海燕*
(1.吉林省白城市农业科学院生物技术实验室,吉林白城 137000;2.吉林农业大学生物反应器与药物开发教育部工程研究中心,吉林长春 130118;3.吉林省镇赉县芦苇湿地管理站,吉林镇赉 137300)
灵芝是我国的传统药用真菌,在我国和东南亚国家有着悠久的应用历史[1]。灵芝含有多糖、萜类化合物、核苷、生物碱、氨基酸多肽、微量元素等多种活性成分。现代药理研究表明,灵芝具有保肝、抗肿瘤、抗HIV-1及HIV-1蛋白酶活性、抗组织胺释放、抑制血管紧张素、抗氧化、调节免疫及延缓衰老的作用[2-7]。自Mishra等[8]首次实现粗糙链孢霉(Neurosporecrassa)的 DNA 转化以来,已经成功建立了许多丝状真菌外源基因的遗传转化体系。近年来,研究人员对灵芝转化方法进行了广泛和深入的研究。Sun等[9]将电击转化方法引入灵芝的分子遗传学研究中,获得15个转化子。Kim等[10]在灵芝中成功应用限制性内切酶介导的转化方法,获得4~17个转化子。郭溆等[11]从灵芝中克隆了合成三萜的关键元件GLCYP450 及其还原酶 GLNADPH的基因,并在酵母中获得了表达;方星等[12]利用农杆菌介导法将灵芝甾醇14α-脱甲基酶基因在灵芝中进行表达。逄春梅等[13]通过电击法将双元细菌人工染色体(BIBAC)载体上的100 kb人参大片段DNA转化到灵芝原生质体内。笔者利用PEG转化法将带有GPD启动子及GFP绿色荧光蛋白的表达载体pCAMBIA1302转入灵芝原生质体中,以期为利用灵芝作为生物反应器表达蛋白及其中间产物提供理论基础。
1 材料与方法
1.1材料灵芝(Goanodermalucidum)由吉林农业大学菌物研究所保存。大肠杆菌 DH5a 由吉林农业大学生物反应器保存。质粒pCAMBIA1302及TaqDNA聚合酶购自大连TaKaRa公司。
1.2菌株培养将灵芝菌丝接入PDA液体培养基中,培养条件为摇床120 r/min,28 ℃培养6 d。将大肠杆菌DH5a在LB培养基中37 ℃培养,在含有15%甘油的LB培养基中,-80 ℃保存。
1.3引物序列PCR 引物均由金唯智公司合成,GPD启动子引物为GPD - F:5′- GCTCTAGACGTTCGTGACTCGCAATATC-3′;GPD- R:5′- CGGGATCCTGCGGGTGAAAGAGGAGG-3′。
检测灵芝转化子GFP引物为GFP -F:5′- GTTGTATAATAGCACCCGGTTT -3′;GFP-R:5′- GGCTCGGTACGGAAGTTG -3′。
1.4平菇基因组DNA的提取将平菇菌种接种于液体PDA培养基中,27 ℃培养6 d后,收集菌丝,采用TPS法提取平菇基因组。
1.5构建pCAMBIA1302重组表达载体
1.5.1PCR 扩增 GPD启动子。根据已报道的平菇GPD启动子序列设计2对引物,由金唯智公司合成,以平菇基因组 DNA为模板进行GPD启动子片段的扩增。扩增程序为预变性94 ℃7 min;变性94 ℃45 s,退火65 ℃45 s,72 ℃1 min,30个循环;延伸72 ℃ 7 min反应终止,于4 ℃保存。取2 μL扩增PCR产物进行1%的琼脂电泳,检测PCR扩增结果。电泳结果后连接T载体测序。
1.5.2双酶切。将pCAMBIA1302质粒用NcoI 和BamH I于37 ℃进行过夜酶切,切胶回收大片段,用NcoI和BamH I限制性内切酶处理pSB1302质粒。 酶切后置于65 ℃水浴锅中反应12 min使限制性内切酶失活。
1.5.3GPD启动子连接pCAMBIA1302。用Solution Ⅰ 连接载体与基因,于4 ℃进行过夜连接,将连接产物加入到大肠杆菌感受态中进行转化,过夜培养后,挑单菌落进行菌液PCR和酶切的验证,鉴定结果为阳性则测序。
1.6灵芝原生质体潮霉素抗性筛选对灵芝原生质体再生培养基中的潮霉素抗性浓度进行筛选,分别选取浓度值为15、20、25、30、35、40、45、50、55、60、65、70、75、80 mg/mL的潮霉素放入固体MYG培养基中,将制备好的原生质体均匀地平铺到MYG培养基中,5~7 d后观察原生质体再生结果。
1.7PEG介导的灵芝原生质体转化灵芝原生质体制备参照试验前期得到的最优灵芝原生质体制备方法进行[14]。取1×106个灵芝原生质体,放入MYG 液体培养基中,加入10~20 μg 待转化的质粒,再加入 1 mL PEG 缓冲液(25% PEG4000,10 mmoL/L CaCl2,10 mmoL/L Tris-HCl,pH 7.4),冰浴20 min。然后再加入1 mL PEG缓冲液,混匀后室温放置5 min,4 000 r/min离心5 min 沉淀原生质体,最后重新悬浮原生质体于1 mL MYG再生培养基中,28 ℃静置培养5 d,涂布含有40 mg/mL潮霉素的MYG再生平板。一般7~10 d后转化子在抗性平板上长出。
1.8灵芝转化子的鉴定
1.8.1PCR检测灵芝转化子。从带有潮霉素抗性平板上挑取转化子,利用CTAB法提取转化子基因组DNA。以转化子DNA为模板,利用引物GFP-F和GFP-R扩增GFP基因片段。扩增程序为预变性95 ℃ 5 min;变性94 ℃45 s,退火52 ℃ 45 s,72 ℃1 min,30个循环;延伸72 ℃7 min反应终止,于4 ℃保存。
1.8.2荧光倒置显微镜观察转化的灵芝菌丝。在倒置显微镜下观察转化GFP绿色荧光蛋白的灵芝转化子,观察灵芝菌丝在倒置荧光显微镜下是否有荧光。
2 结果与分析
2.1TPS法提取平菇基因组TPS 是提取水稻基因组的一种方法,它是一种小量的快速简单提取真菌基因组的方法,首次运用到提取平菇基因组,可以看出 TPS 法提取平菇基因组电泳条带清晰,证明基因组提取成功(图 1)。

注:M.DL10000 Marker;1~5.平菇基因组Note:M.DL10000 Marker; 1-5.Pleurotus ostreatus genome图1 平菇基因组Fig.1 Pleurotus ostreatus genome
2.2pCAMBIA1302表达载体构建以 pCAMBIA1302为基础表达载体,将其中的原启动子 35s替换为GPD启动子(图2)。
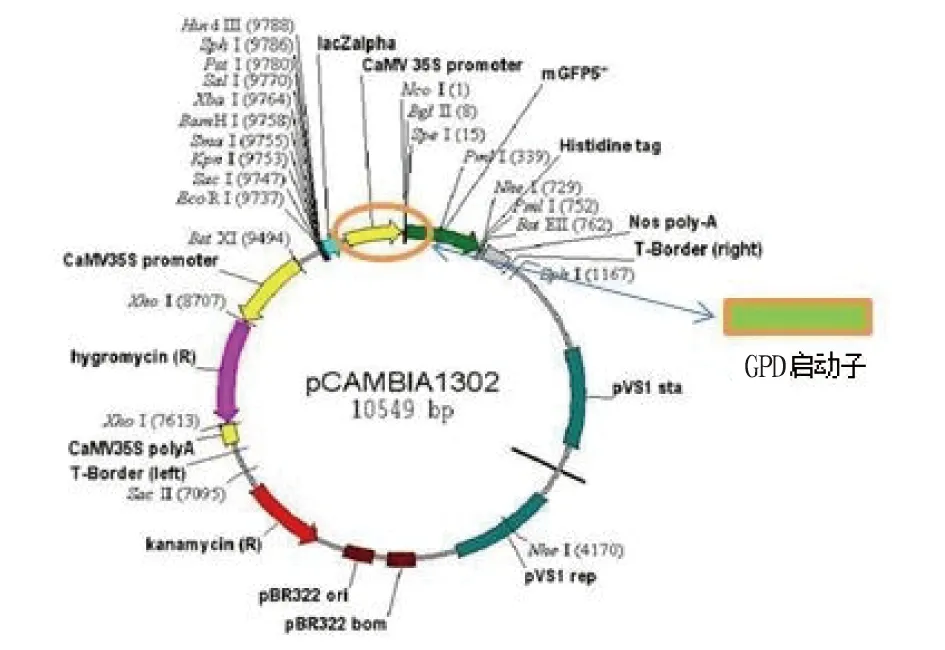
图2 表达载体 pCAMBIA1302 图谱Fig.2 Construction of expression vector pCAMBIA1302
2.2.1GPD启动子的克隆。根据已报道的GPD启动子的序列设计引物GPD-F1和GPD-R1,并引入酶切位点NcoI和BamH I。经过Kan抗性筛选,37 ℃过夜培养后抽提质粒,进行PCR、酶切鉴定并测序,得到正确的GPD启动子(图3)。
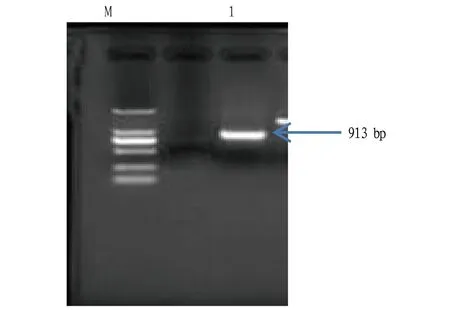
注:M.DL2000 Marker;1.GPD启动子Note:M.DL2000 Marker;1.GPD promoter图3 GPD 启动子的 PCR 扩增检测Fig.3 PCR amplification of GPD promoter
2.2.2pCAMBIA1302表达载体构建。提取重组 pCAMBIA1302 菌液质粒,分别经NocI和BamH I双酶切后进行电泳检测并测序表明,GPD启动子已经成功构建到pCAMBIA1302 表达载体中(图4)。
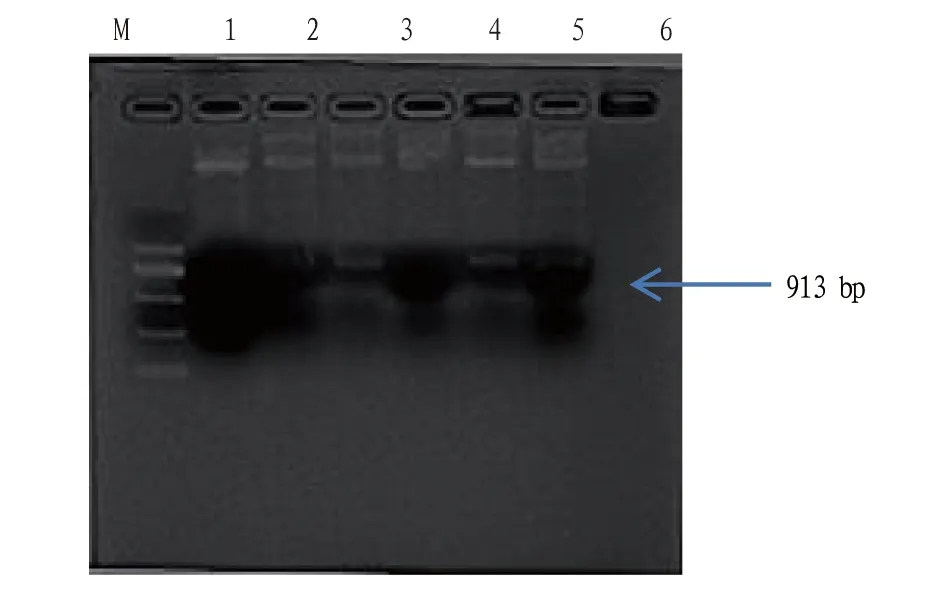
注:M.DL2000 Marker; 1~6.GPD 启动子Note:M.DL2000 Marker;1-6.GPD promoter图4 质粒 pCAMBIA1302上Nco I 和BamH I 双酶切验证Fig.4 The digestion verification of plasmid pCAMBIA1302 by Nco I and BamH I
2.2.3灵芝原生质体潮霉素抗性筛选。对灵芝原生质体再生培养基中的潮霉素抗性浓度进行筛选,结果表明灵芝原生质体在MYG再生培养基中,潮霉素的最低抑制筛选浓度为45 mg/mL(图5)。
2.3灵芝转化子的检测通过 PEG 转化法转化灵芝原生质体,并在带有潮霉素抗性的平板上培养,潮霉素抗性试验表明,潮霉素对灵芝原生质体的最低抑制质量浓度为45 mg/mL。将假定转化子转接于含40 μg/mL 潮霉素筛选培养基上继续筛选8 d,菌落能够在抗性平板上继续生长。随机提取2个转化子,用GFP片段进行PCR 检测(图6)。

图5 灵芝原生质体在带有潮霉素抗性培养基中的生长情况Fig.5 The growth of protoplast of G.lucidum in culture medium with hygromycin resistance
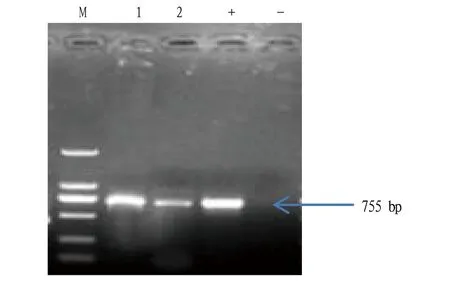
注:M.DL2000 Marker;1~2.灵芝转化子 Note:M.DL2000 Marker;1-2.G. lucidum transformants图6 灵芝转化子中GFP的PCR验证Fig.6 PCR detection of GFP in G.lucidum transformants
2.4荧光倒置显微镜观察转化的灵芝菌丝在荧光倒置显微镜下观察转化后GFP绿色荧光蛋白的灵芝转化子,可以看出部分灵芝菌丝在倒置荧光显微镜下呈现荧光色,由此表明,GFP绿色荧光蛋白在灵芝菌丝中有表达(图7)。
3 结论
利用TPS法提取平菇基因组,此方法简单易行,适用于小量提取基因组。该研究建立了由PEG介导的灵芝转化体系,首先将GPD启动子构建到带有GFP绿色荧光蛋白的pCAMBIA1302表达载体中,通过PEG介导的转化法转化灵芝原生质体,以及潮霉素的抗性筛选,获得了一批具有潮霉素抗性的灵芝转化子菌株,并通过PCR扩增GFP基因片段和荧光倒置显微镜试验证实外源基因片段GFP已成功转化进灵芝转化子的基因组中。食用菌等大型丝状真菌的转化效率较低,远远低于丝细菌和酵母的转化率,转化效率高低也许与物种本身有关。该研究建立了灵芝转化体系,使灵芝作为一种新的生物反应器,为今后分子生物学研究打下基础。

注:A.灵芝转化子;CK.未转化的灵芝菌丝Note:A.G.lucidum transformants;CK.Untransformed G.lucidum mycelia图7 在荧光倒置显微镜下观察灵芝菌丝Fig.7 The mycelium of G. lucidum was observed under a fluorescence inverted microscope
