响应面法优化弹簧糊精的酶解制备工艺
2018-09-18闵丹丹徐学明焦爱权潘小卫金征宇
闵丹丹, 徐学明, 焦爱权, 潘小卫, 金征宇
(食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
弹簧糊精是由葡萄糖单元由α-(1→4)糖苷键连接而成的线性,多分散性的多糖,因其柔性螺旋结构像弹簧一样具有可逆的拉伸和松弛特性而得名[1]。弹簧糊精的特殊结构,使其在淀粉抗老化,包埋活性物质以及手性分离方面展现了广阔的应用前景[1~5]。
弹簧糊精的制备方法主要有酶法合成和酶法分解。酶法合成反应成本高,反应工艺复杂,难以进行工业化生产。2012年,徐等[6]采用α-淀粉酶酶解直链淀粉制备弹簧糊精,在制备过程中,需要对支链淀粉和直链淀粉进行分离,这使得加工过程变得繁琐。并且由于α-淀粉酶作用位点随机,产物聚合度分布广,且产率较低。
Tokuya等[7]使用凝胶排阻层析法分析普鲁兰酶对支链淀粉的剪切方式,发现普鲁兰酶首先是从外侧水解支链淀粉,而普鲁兰酶水解物中只有聚合态支链淀粉和线性葡聚糖,即弹簧糊精。并且,普鲁兰酶专一水解α-(1→6)糖苷键。采用普鲁兰酶制备弹簧糊精的反应过程容易控制,产物聚合度较为集中。由于蜡质玉米淀粉几乎全部为支链淀粉,直链淀粉很少,选其为原料,可以省去繁琐的分离步骤。
1 材料与方法
1.1 材料与仪器
蜡质玉米淀粉:杭州普罗星淀粉有限公司产品;普鲁兰酶(1 000 U/mL):诺维信(中国)生物技术有限公司产品;配有多角度激光光散射仪检测器和示差检测器的凝胶色谱系统(HPSEC-MALLS-RI检测系统):美国Wyatt公司产品;DHG-9123A电热恒温鼓风干燥箱:上海柏欣仪器设备厂产品;Dionex ICS-5000高效阴离子交换色谱系统 (HPAECPAD):美国戴安公司产品。
1.2 实验方法
1.2.1 弹簧糊精的制备 准确称取5 g蜡质玉米淀粉,加入90 mL去离子水,在沸水浴中搅拌15 min,使其预糊化,再于121℃条件下高压处理15 min,使其彻底糊化,冷却至室温后,加入5 mL一定pH值的醋酸钠缓冲溶液,再加入一定体积的普鲁兰酶,然后放入一定温度的水浴锅中震荡一段时间;将完成上述酶解反应的溶液煮沸,冷却后在离心机中以5 000 r/min的速度离心10 min,除去变性酶,取上清液旋转蒸发浓缩后60℃度烘干,即得弹簧糊精粗品。
1.2.2 弹簧糊精相对分子质量信息的测定 使用HPSEC-MALLS-RI检测系统对弹簧糊精样品的平均相对分子质量和相对分子质量分布进行测定[8]。流动相为0.3 mol/L NaNO3溶液 (含有质量分数0.02%的NaN3),经0.45 μm的滤膜过滤后,超声 30 min;流动相流量0.5 mL/min,流动相折光指数为1.331,进样量 200 μL,柱温 50 ℃,折光指数增量(dn/dc)为0.147。采用Astra软件对激光散射信号和示差折光检测器信号进行采集、分析和计算。
取25~30 mg弹簧糊精粗品,溶解于3 mL流动相溶液中,经0.45 μm滤膜过滤后进样。
1.2.3 弹簧糊精聚合度分布的测定 使用配有ED-40型脉冲电流检测器的高效阴离子交换色谱(HPAEC-PAD)对弹簧糊精的链长分布进行检测[9-10]。色谱柱型号为戴安CarboPAC PA200。流动相:100 mmol/L NaOH(A),100 mmol/L NaOH+600 mmol/L NaAC(B)。采用线性梯度洗脱:0 min时为体积分数20%的洗脱液B,在60 min时为体积分数100%的洗脱液B。流量为1 mL/min,进样量25 μL。将弹簧糊精溶于去离子水后加热溶解,配成3 mg/mL的溶液,过0.25 μm的滤膜后进样。
1.2.4 弹簧糊精纯度的计算 图1为使用HPSECMALLS-RI检测系统所测出的普鲁兰酶酶解蜡质玉米淀粉不同时间所得到的酶解产物的相对分子质量分布。peak1和peak2是普鲁兰酶酶解蜡质玉米淀粉所得线性葡聚糖(即弹簧糊精)的相对分子质量分布(1 200~18 000),此结果与 Cai等[11]使用异淀粉酶酶解蜡质玉米淀粉所得线性葡聚糖的相对分子质量分布相近,peak3代表未被彻底酶解的聚合态支链淀粉。
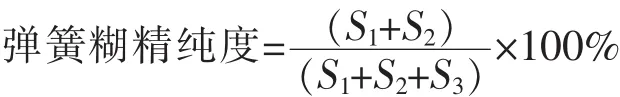
式中:S1为peak1的面积;S2为peak2的面积;S3为peak3的面积。
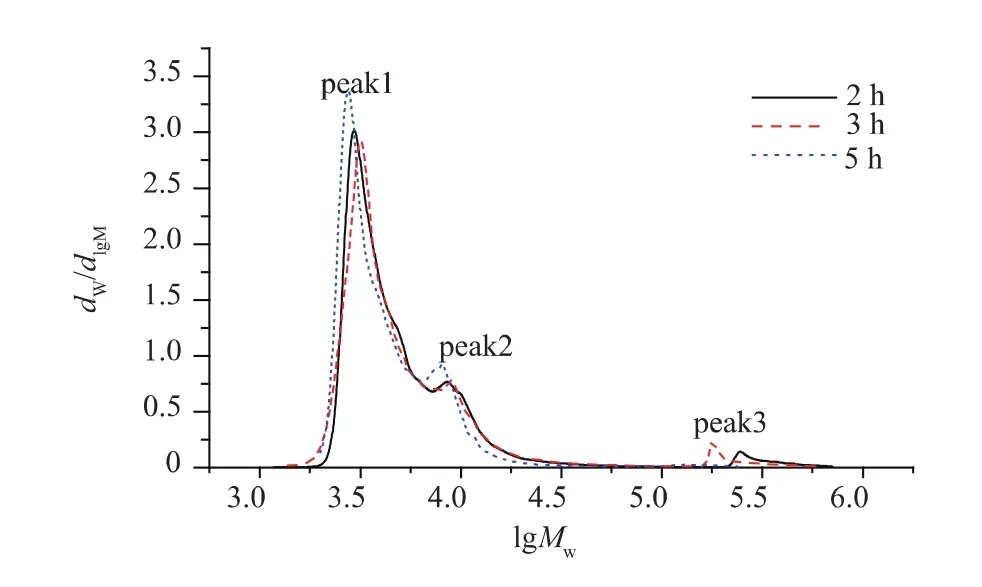
图1 普鲁兰酶酶解蜡质玉米淀粉不同时间所得产物的相对分子质量分布Fig.1 Mw distribution of products from waxy corn starch debranched by pullulanase at different times
1.2.5 响应面试验设计 根据单因素实验,采用Box-Behnken设计,以弹簧糊精纯度(Y)为响应值,对温度、pH、时间、酶用量进行优化,因素水平表见表1。
1.2.6 数据处理 采用Design-Expert v8.0.6.1软件进行实验数据处理、分析,采用Origin 8.5软件进行绘图。
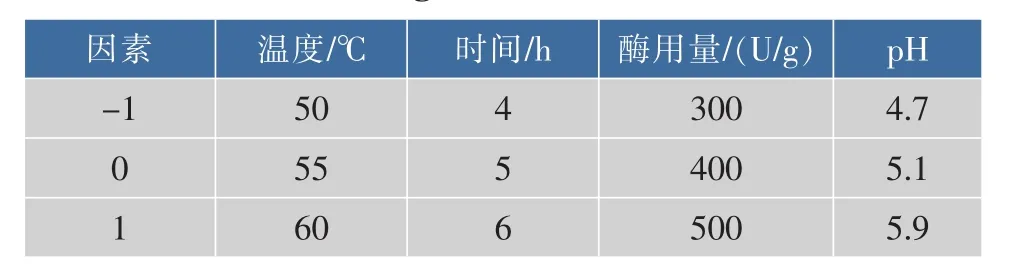
表1 响应面试验因素与水平表Table 1 Coded values of the variables for the Box-Behnken design
2 结果与讨论
2.1 单因素实验
2.1.1 温度对弹簧糊精纯度的影响 根据预实验,设定pH为5.1,酶添加量400 U/g,酶解时间5 h,研究温度分别为 45、50、55、60、65 ℃时, 温度对弹簧糊精纯度的影响,结果如图2所示。
由图2可知,当温度在45~55℃之间时,弹簧糊精的纯度随着温度的升高而增加。这主要是在温度低于55℃时,普鲁兰酶的活性随着温度的升高而逐渐增强,反应速度逐渐加快。当温度继续升高时,普鲁兰酶部分失活,弹簧糊精的纯度会有所下降。温度在50~60℃之间时,弹簧糊精的纯度均较高;温度为55℃时,弹簧糊精的纯度最高。所以50~60℃为普鲁兰酶作用的适宜温度范围,选则55℃作为最适反应温度。
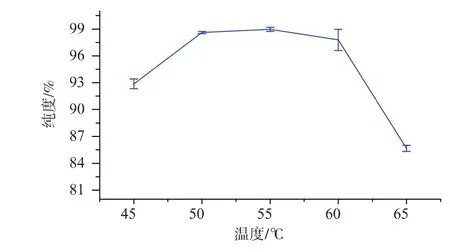
图2 温度对弹簧糊精纯度的影响Fig.2 Effect of temperature on purity of spring dextrin
2.1.2 pH对弹簧糊精纯度的影响 根据预实验,设定温度为55℃,酶添加量400 U/g,酶解时间5 h,研究 pH 分别为 4.3、4.7、5.1、5.5、5.9 时,pH 对弹簧糊精纯度的影响,结果如图3所示。
由图3可知,当pH小于4.7时,弹簧糊精的纯度会随着pH的提高而显著增加;当pH高于5.1时,弹簧糊精的纯度呈下降趋势。这说明普鲁兰酶的活性会受到pH的显著影响;普鲁兰酶在pH4.7~5.1时,能快速水解α-(1→6)糖苷键,产生较多的弹簧糊精。在pH 5.1时,弹簧糊精的纯度最高,故选择pH 5.1为最适反应pH。
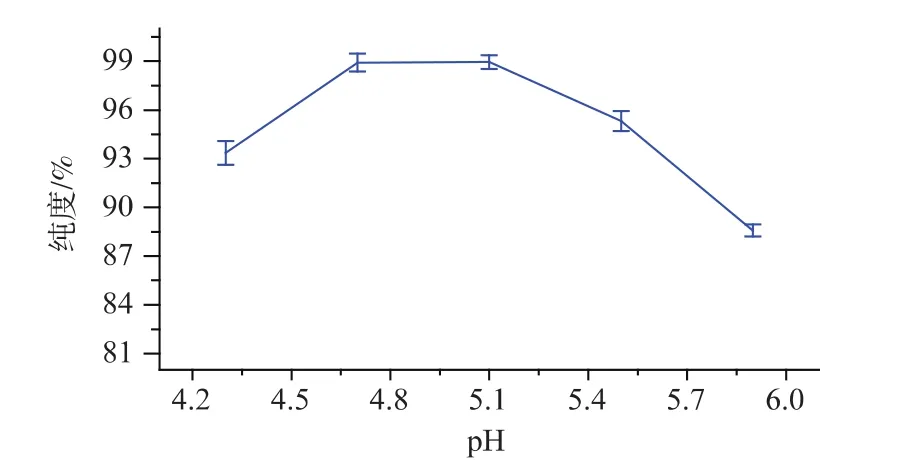
图3 pH对弹簧糊精纯度的影响Fig.3 Effect of pH on the purity of spring dextrin
2.1.3 酶用量对弹簧糊精纯度的影响 根据预实验,设定温度为55℃,pH 5.1,酶解时间5 h,研究酶用量分别为 50、200、300、400、500、600 U/g 时,酶用量对弹簧糊精纯度的影响,结果如图4所示。
由图4可知,当酶用量小于300 U/g时,随着酶添加量的增加,弹簧糊精的纯度逐渐增加,两者呈线性关系。这说明底物未被酶所饱和,反应速度主要取决于酶添加量。当酶用量大于400 U/g时,弹簧糊精的纯度随酶用量的增加而增长缓慢,从经济角度和弹簧糊精纯度综合考虑,作者选择的最佳酶用量为400 U/g。
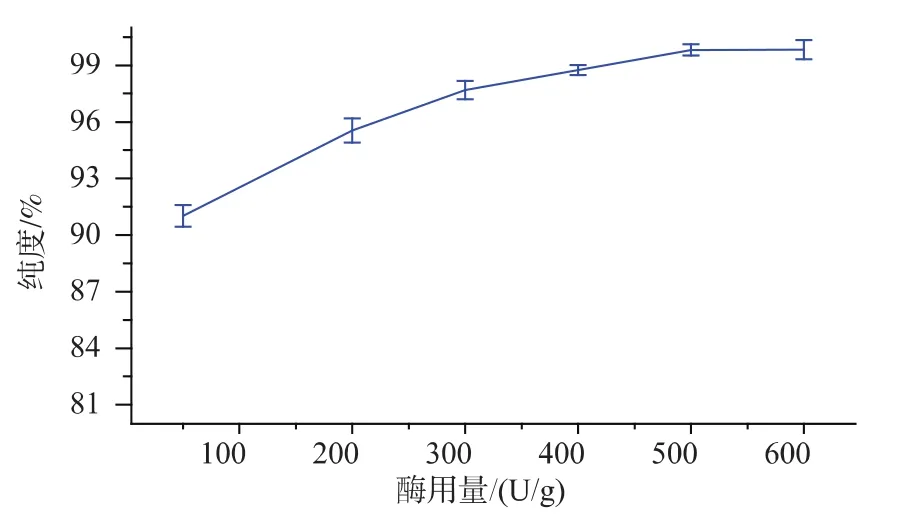
图4 酶用量对弹簧糊精纯度的影响Fig.4 Effect of enzyme concentration on the purity of spring dextrin
2.1.4 时间对弹簧糊精纯度的影响 根据预实验,设定温度为55℃,pH 5.1,酶用量 400 U/g,研究酶解时间分别为 1、2、3、4、5、6 h 时,酶解时间对弹簧糊精纯度的影响,结果如图5所示。
由图5可知,时间在5 h前,弹簧糊精的纯度随着时间的延长呈增加趋势;当时间继续延长,弹簧糊精的纯度增长缓慢,基本趋于稳定。这是因为支链淀粉具有不同长度的支链,普鲁兰酶能较快地水解以α-(1→6)糖苷键连接的短链葡聚糖;随着反应时间的延长,普鲁兰酶只能以极慢的速度水解还未被水解的长链葡聚糖[12]。因此,作者选择5 h为最佳酶解时间。
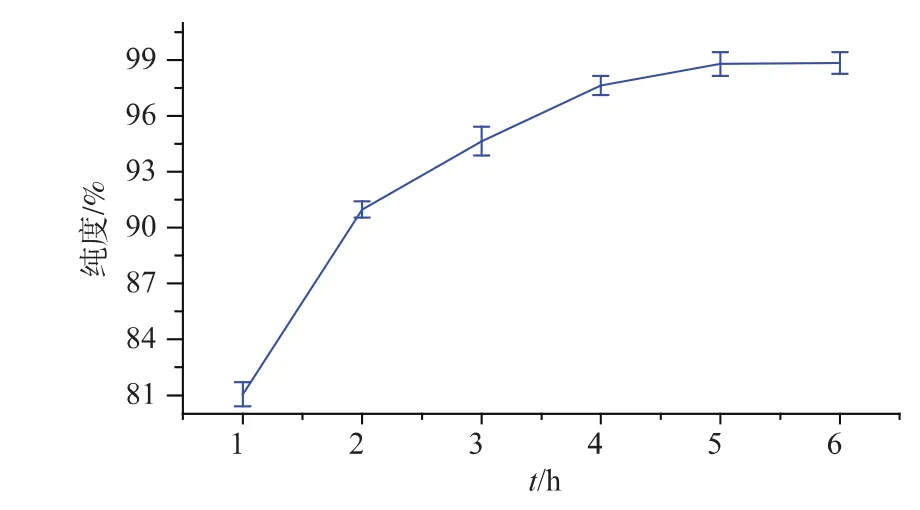
图5 时间对弹簧糊精纯度的影响Fig.5 Effect of time on the purity of spring dextrin
2.2 响应面试验
2.2.1 Box-Behnken试验设计及结果 Box-Behnken试验设计及结果如表2所示。
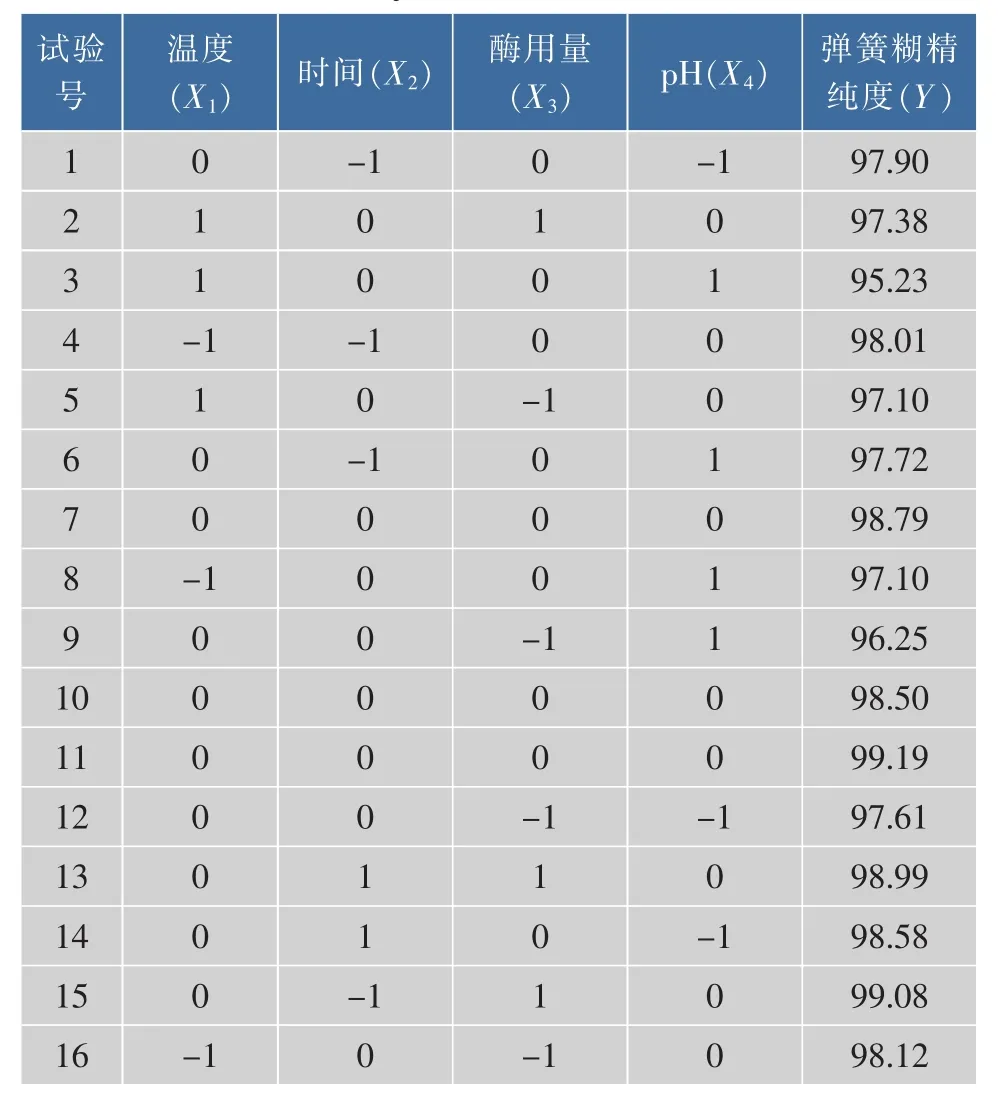
表2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
续表2
2.2.2 响应面模型的选择 由表3知,一阶线性模型和二因素交互关系模型的失拟项P值均小于0.01,为极显著,表示这两个模型出现失误的概率比较大,不适宜进行数据拟合;二阶模型和三阶模型的失拟项P值都大于0.05,但是三阶模型的序变模型P值大于0.05,为不显著,说明采用三阶模型容易出现混杂的模型[13]。二阶模型的R2=0.908 8,表示该模型能够解释90.88%的总变异,仅有9.12%的变异无法用该模型解释[14]。综上所述,采用二次模型进行弹簧糊精制备预测是切实可行的。
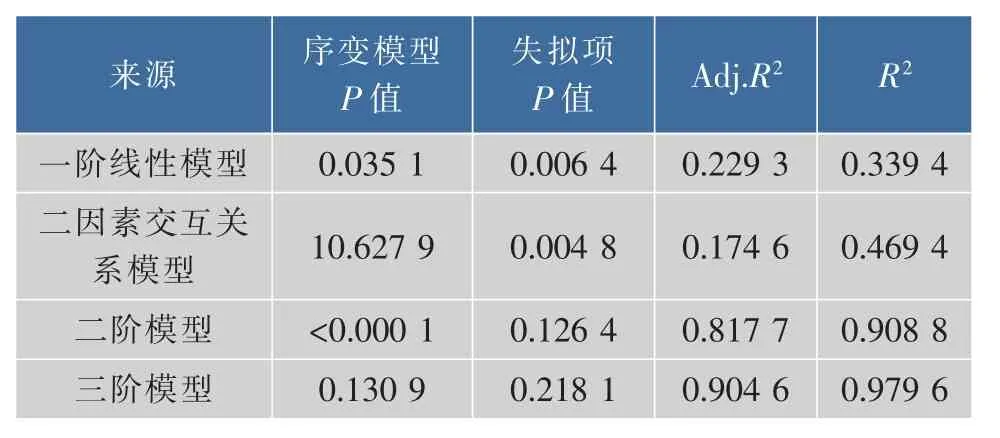
表3 模型拟合概要Table 3 Model fit summary
2.2.3 二次模型建立与显著性检验 对表2结果进行回归分析,拟合的温度(X1)、时间(X2)、酶用量(X3)、pH(X4)对弹簧糊精纯度(Y)影响的二次回归方程为:

响应值二次模型的方差分析及显著性如表4所示。由表4可以看出,模型P<0.000 1,模型达到极显著。失拟项P=0.050 5>0.05不显著,因此该二次模型拟合度良好。
其中一次项X1、X3、X4均显著,X2不显著; 二次项X1、X3、X4显著,其他不显著,交互项X1X4和X2X3显著,所以得出影响弹簧糊精纯度的因素依次:pH值>酶用量>温度>时间。
通过分析计算得到酶法制备弹簧糊精的最优条件为:酶解pH 4.96,酶解温度53.32℃,酶解时间6 h,酶用量420 U/g淀粉,弹簧糊精纯度预测值为99.4%,经验证试验,在该实验条件下得到的弹簧糊精纯度为99.2%。与预测值基本一致,说明该方程与实际情况相符合,拟合程度较好。
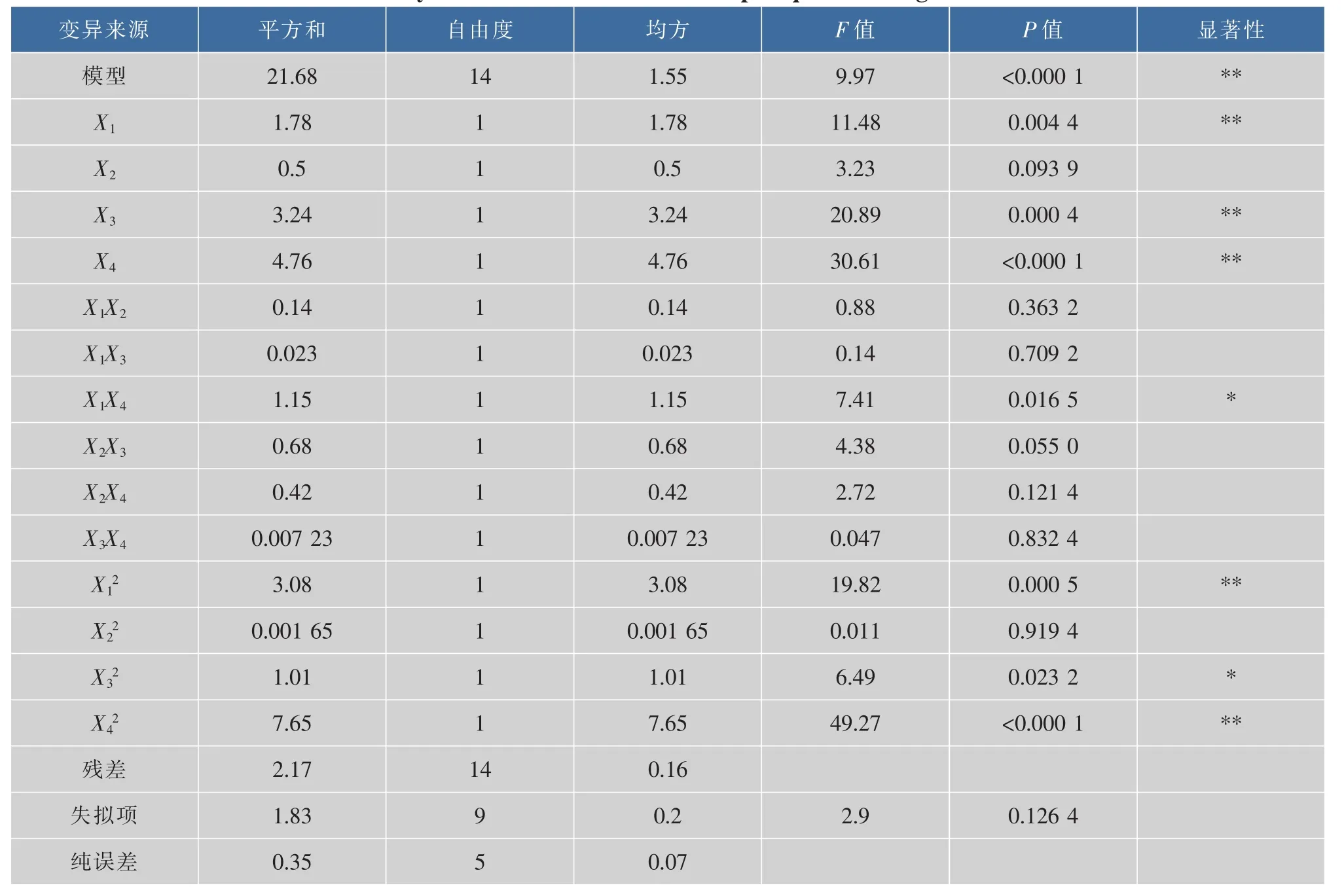
表4 响应值二次模型的方差分析Table 4 Analysis of variances for the developed quadratic regression model
2.3 弹簧糊精链长分布情况
图6是采用HPSEC-MALLS-RI检测系统所测出的弹簧糊精分子量信息,可知弹簧糊精的相对分子质量分布为1 200~18 000,其中相对分子质量小于 9 720(DP<60)的弹簧糊精占 95.5%。 HPAEC 可用来测定聚合度在6~60之间的葡聚糖[15],所以可采用HPAEC测定绝大部分弹簧糊精的聚合度分布,结果如图7所示。根据聚合度差异,将弹簧糊精分为 4 组[16],即DP 6~12,13~24,25~36,37~60,它们所占的比例分别为24.40%,45.08%,19.60%,10.92%。

图6 弹簧糊精的相对分子质量分布Fig.6 Molecular weight distribution of spring dextrin
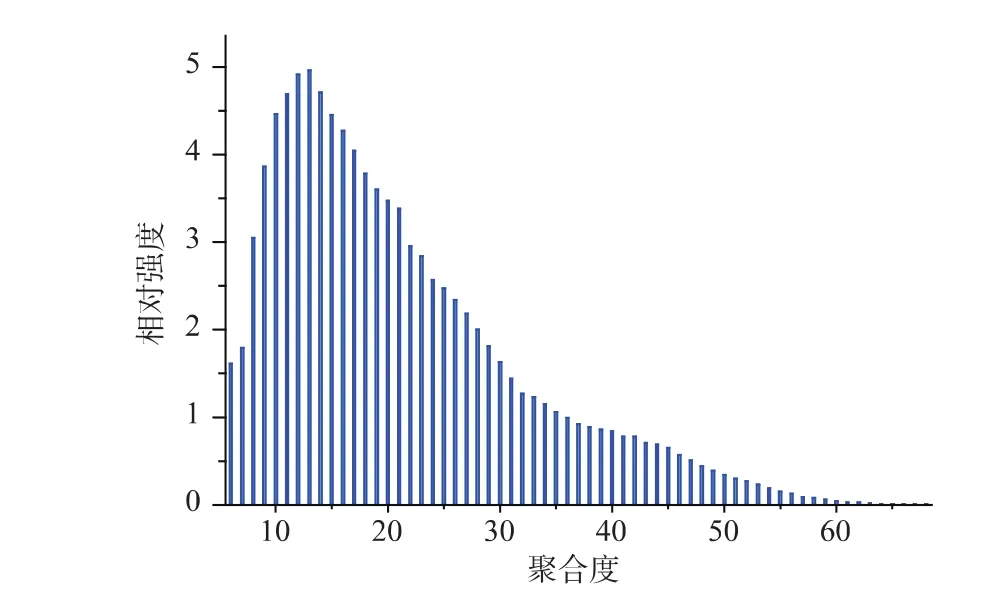
图7 弹簧糊精的聚合度分布Fig.7 Degree of polymerization distribution of spring dextrin
3 结语
作者通过响应面实验对酶解工艺参数进行优化,以期对蜡质玉米淀粉脱支完全,实现弹簧糊精的较高得率。
