多巴胺仿生修饰PVDF微滤膜的制备及性能
2018-09-18夏伟伟赵义平
冯 霞 ,夏伟伟 ,马 潇 ,赵义平 ,陈 莉
(1.天津工业大学材料科学与工程学院,天津 300387;2.天津工业大学省部共建分离膜与膜过程国家重点实验室,天津 300387)
目前,膜污染一般被定义为在处理废水的过程中,胶体离子、污泥絮体、溶解性的有机物、无机盐类、微生物等通过与膜之间发生复杂的物理化学或者机械作用沉积或者吸附在分离膜表面.随着操作时间的延长,这些污染物的聚集体增多,使膜孔径减小或者堵塞,使渗透阻力增加,进而使膜的水通量和分离性能产生不可逆的降低,使整个水处理的成本增加[1].目前所面临的膜污染机理大致可分为3种:吸附污染、沉积污染和生物污染[2-4].
PVDF已经成为备受关注的膜材料之一,相比于其他膜材料,它具有良好的化学稳定性、耐辐射、热稳性和机械性能等[5-7],且具有较好的成膜性,如平板膜、卷式膜和管式膜等.但是PVDF呈现疏水性,在实际应用于水处理过程中容易被污染,导致PVDF分离膜的分离性能和渗透性能下降,使其使用寿命缩短.目前,普遍认为提高分离膜的亲水性是提高膜抗污染性能的主要途径[8].从国内外研究情况来看,提高分离膜亲水性的方法主要有共混改性、表面化学改性、表面物理改性和共聚改性[9-11].
多巴胺仿生修饰是利用海洋贻贝类生物所分泌的足丝蛋白能够黏附在湿润的基体表面现象引发而来[12-14].因此本文选多巴胺作为改性剂,充分利用其超强的黏附性和富含大量的亲水基团的特点,采用表面沉积的方法对PVDF微滤膜进行表面修饰.该方法不仅提高PVDF微滤膜亲水性能,而且改性过程操作简单,条件温和可控,绿色环保.
1 实验部分
1.1 试剂与仪器
主要试剂:聚偏氟乙烯(PVDF,SOLEF 1010),Solva公司产品;聚乙二醇(PEG,Mn=6000)、N’N-二甲基甲酰胺(DMF)、氢氧化钠(NaOH),均为分析纯,天津科密欧化学试剂有限公司产品;三羟甲基氨基甲烷(Tris)、多巴胺盐酸盐(Dopamine hydrochloride),均为分析纯,天津希恩思生化科技有限公司产品;牛血清蛋白(BSA),Da=67000,IEP=4.7,分析纯,北京索莱宝科技有限公司产品.
主要仪器:Elcomet4340型全自动刮膜机,Elcometer公司产品;TENSOR 37型傅里叶变换红外光谱仪(FT-IR),Bruker公司产品;TU-1901型紫外-可见光分光光度计,北京谱博欣生物科技有限公司产品;Hitachi s-4800型场发射扫描电镜(SEM),日本日立公司产品;K-Alpha型X射线光电子能谱仪(XPS),美国Thermo Fisher公司产品;DSA100型接触角测试仪,德国Krüss GmbH公司产品;IV-9500 Auto Pore全自动压汞仪,美国Tektronix公司产品;膜通量测试装置,实验室自制.
1.2 PVDF微滤膜的制备
首先将14 g PVDF充分干燥的粉末加入到80 g DMF中,置于60℃恒温水浴,搅拌一定时间,再向上述混合体系中加入6 g PEG(Mn=6000),在60℃下搅拌9 h得均匀透明铸膜液,然后将铸膜液放置60℃的恒温水浴中静置过夜,获得均匀透明的铸膜液体系,在全自动刮膜机上用200 μm的刮膜刀刮膜,当初生膜形成后完全从玻璃板上脱落时,将初生膜放在凝固浴中几分钟后取出,置于去离子水中保存待用.
1.3 改性PVDF微滤膜的制备
多巴胺改性PVDF微滤膜的步骤参照文献 [15].首先,配制20 mmol/L的Tris-HCl缓冲液1000 mL,在用0.1 mol/L的盐酸调节Tris-HCl溶液的pH=8.5,将2 g多巴胺溶解在Tris-HCl溶液中,取一定大小的PVDF膜用去离子水冲洗0.5 h,放入配制好的多巴胺溶液中,放置于恒温(25℃)的摇床中,进行多巴胺涂覆改性,分别将涂覆改性3 h、6 h、9 h和12 h的改性PVDF 分离膜标记为 M-3、M-6、M-9 和 M-12,纯PVDF分离膜标记为M-0,取出改性膜后去离子水冲洗10 min,再进行超声清洗10 min.置于去离子水中待用.
1.4 PVDF微滤膜的表征与测试
1.4.1 全反射-傅里叶红外光谱表征(ATR-FTIR)
利用衰减全反射红外光谱仪对纯PVDF分离膜和改性膜(M-0、M-3、M-6、M-9和M-12)表面的化学结构进行表征,扫描范围为4500~400 cm-1.
1.4.2 场发射电子扫描显微镜表征(SEM)
将充分干燥的纯PVDF分离膜和改性膜分别制样,并在液氮环境下将膜进行脆断以制得到膜的断面,然后样品进行再次干燥后,喷金,用SEM进行形貌观察.
1.4.3 孔结构测试
用压汞仪对膜的孔结构进行测试,以空白样进行校正,经软件分析可得到不同膜的平均孔径、孔隙率.
1.4.4 纯水接触角的测试
用接触角型测试仪测定膜表面的纯水接触角.将干燥的膜剪成4 cm×1 cm长条形,用双面胶平整的粘贴固定在载玻片上,正面朝上.用测试仪的针尖在膜表面滴加2 μL的纯水,通过本仪器自带的软件计算出接触角数据,每张膜测试5个点,取平均值作为膜表面的水接触角.
1.4.5 渗透与分离性能测试
采用本实验室自制的通量测试装置,设定过滤介质的温度为25℃.每张膜先在0.2 MPa的压力下预压0.5 h,在0.1 MPa对膜进行实际的通量测试,然后以BSA溶液(Cf=1 g/L)为污染模型对膜进行截留性能测试,采用紫外-分光光度计在278 nm波长处测过滤液的吸光度.根据BSA溶液的标定曲线计算滤过液的BSA浓度Cp,膜的通量Jw和BSA截留率R利用公式(1)和(2)进行确定.

式中:V为渗透液的体积(L);A为膜的有效面积(m2);Δt为透过V体积的滤液所需时间(h);Cf为BSA溶液的初始质量浓度(g/L);Cp为过滤液中BSA的质量浓度(g/L).
1.4.6 动态蛋白质污染性能测试
将待测膜(M-0、M-3、M-6、M-9 和 M-12)分别剪成圆形膜片(1.385×10-3m2)放入膜池中,首先在0.2 MPa的压力下预压0.5 h,然后将压力降到0.1 MPa,测试膜片的纯水通量Jw,将过滤介质换成1 g/L的BSA溶液,仍然在压力为0.1 MPa下进行测试BSA通量JB,延长渗透时间至120 min;然后将BSA污染的分离膜取出,水洗0.5 h,继续在0.2 MPa下预压0.5 h后,在0.1 MPa下测试膜的纯水通量Jr.通量恢复率(FRR)由公式(3)可得:

用总污染指数Rt、可逆污染指数Rr和不可逆污染指数Rir来分别评价膜表面发生的总污染、可逆污染和不可逆污染,一般情况下,过滤BSA溶液后,经0.5 h清洗后,能够清除的污染被视为可逆污染Rr,不能除去的污染称为不可逆污染Rir[15-16],其计算公式如公式(4)、(5)、(6)所示:

2 结果与讨论
2.1 全反射-傅里叶红外光谱分析(ATR-FTIR)
图1为纯PVDF微滤膜和多巴胺改性PVDF微滤膜的ATR-FTIR.

图1 膜(M-0、M-3、M-6、M-9和 M-12)的ATR-FTIR 图谱Fig.1 ATR-FTIR spectra of membranes(M-0,M-3,M-6,M-9 and M-12)
由图 1 可见,M-0、M-3、M-6、M-9 和 M-12 的ATR-FTIR图谱均出现了PVDF膜的典型特征峰,在1180cm-1和1407 cm-1处分别为—CF2和—CH2伸缩振动峰,相比 M-0,M-3、M-6、M-9和 M-12图谱上均出现新的峰位,在1513 cm-1和1620 cm-1分别是来自于聚多巴胺上仲胺键—N—H弯曲振动峰和芳香环上的C=C伸缩振动峰[17],在3603~3173 cm-1处是—OH和—NH2伸缩振动峰,这是由于聚多巴胺含有的亲水基团—OH和—NH2造成的,且随着沉积时间的延长,聚多巴胺上的特征峰的峰强度呈现逐渐增大的趋势,说明延长多巴胺的沉积时间,可以增加多巴胺在PVDF膜表面的沉积量.
2.2 形貌分析
图2为纯PVDF微滤膜和改性PVDF微滤膜的表面和断面SEM图.

图2 PVDF膜的表面形态和断面形貌图Fig.2 Surface and cross-section morphologies of PVDF membranes
由图2可知:M-0表面呈现较多孔径不均匀的孔洞,膜表面较为光滑;M-3表面与M-0没有太大的区别,依然能看到独立,不均匀的膜孔,然而随着改性时间的延长,膜表面的形态有了较大的变化;M-6表面的膜孔相对于M-0有所减少,膜表面出现了少量的PDA颗粒,这是因为改性时间的延长,聚多巴胺颗粒在膜表面继续生长,沉积量增加,进而对表面膜孔有一定的覆盖;M-9表面膜孔明显减少,且出现了粒径较大的PDA聚集体;M-12表面的膜孔几乎被完全覆盖,且出现了较多的PDA颗粒,这是因为随着多巴胺沉积时间的增加,这些微小颗粒或者聚集体会通过共价键或者非共价键的作用生长在黏附在膜表面PDA薄层[18],但PDA的沉积对膜的断面结构没有明显的影响,膜孔结构参数如表1所示.从表1可以得出,随着多巴胺沉积时间的增加,膜的孔径和孔隙率也呈现降低的趋势.
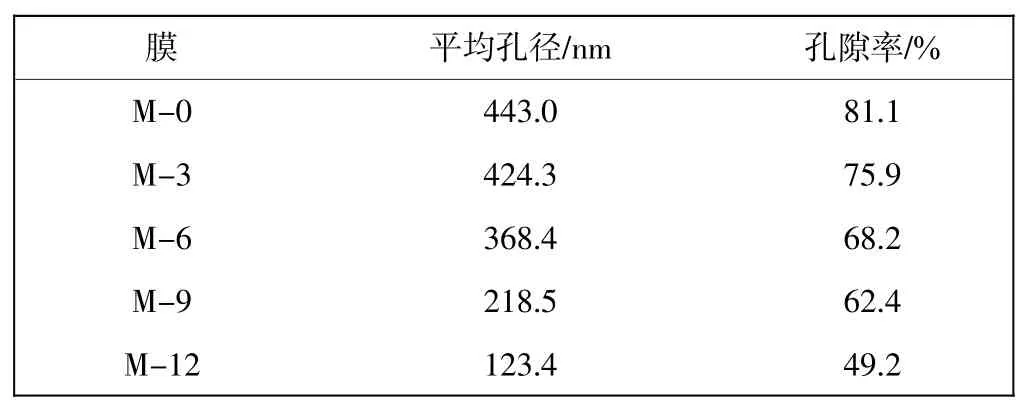
表1 膜孔结构参数Tab.1 Parameters of membranes pore structure
2.3 表面亲水性分析
图3为多巴胺沉积时间对PVDF微滤膜表面亲水性的影响.

图3 纯PVDF膜与改性PVDF膜的纯水接触角Fig.3 Pure water contact angle of pure PVDF membrane and modified PVDF membranes
从图3可知,M-0的表面静态接触角达到95°,多巴胺改性3 h后(M-3),改性膜的静态接触角下降到80°,说明改性膜表面的亲水性增加,且随着多巴胺改性时间的增加,膜表面的水接触角逐渐降低,说明延长PDA沉积时间能够赋予PVDF膜表面较好的亲水性.多巴胺对PVDF膜表面进行亲水改性时,多巴胺在Tris水溶液中很容易生成一些分子量比较低的多巴胺醌低聚物,然后部分多巴胺醌低聚物之间发生交联生成分子量较高的聚合物,最终多巴胺、多巴胺醌低聚物和高聚物在弱碱有氧的环境下通过共价键和非共价键(氢键、π-π共轭、电荷相互作用)自组装成聚多巴胺黏附在PVDF膜表面[12],这种物质含有大量—OH、—NH2、—NH—亲水性基团,这些基团的存在是赋予PVDF膜亲水性的主要因素.
2.4 渗透分离性能分析
图4为多巴胺沉积时间对PVDF微滤膜渗透和分离性能的影响.

图4 纯PVDF膜和改性PVDF膜水通量和BSA截留率Fig 4 Water flux and BSA rejection of pure and modified membranes
由图4可知,纯PVDF膜的纯水通量和BSA截留率分别78 L/(m2·h)和34%,改性膜的水通量呈现先增加后降低的趋势,改性6 h后(M-6)的纯水通量达到103.7 L/(m2·h).对BSA的截留率呈现出一直增加的趋势,当改性12 h后,改性膜的BSA截留率为最大值96.5%.从图4看出,当多巴胺沉积时间低于6 h,改性膜的BSA的截留率和渗透性能均得到了不同程度的增加,这种同时促进打破了传统的Trade-off效应,主要是因为通过多巴胺改性后,虽然膜表面的孔径减小,孔隙率降低(如表1),但是改性膜表面的亲水性增加,亲水性有利于增加通量.对于M-9和M-12,两者的纯水通量均下降,然而对BSA的截留率得到了较大的提高[18],对于M-9和M-12,两者的纯水通量均下降,然而对BSA的截留率得到了较大的提高,这是因为聚多巴胺层的增厚,增加了水分子渗透阻力,不利于水分子和BSA分子的通过,因此改性膜纯水通量下降,BSA截留率增加.
2.5 抗污染性能分析
图5为以BSA为过滤介质,未改性膜和改性膜的通量随时间的变化及通量衰减率.

图5 BSA通量随时间的变化和通量衰减率Fig.5 Time-dependent BSA fluxes of membranes and flux decline ratio
由图5可知,M-0的BSA通量衰减较大,这是由于纯PVDF膜表面是疏水性的,BSA分子很容易吸附在膜表面,随着过滤时间的推移,BSA分子沉积在膜表面的量逐渐增加,形成凝胶层,造成严重的膜污染,因此M-0的通量在相同时间内衰减较大,通量衰减率达到了58.7%.改性PVDF膜表面更容易形成水化层,这种水化层对于BSA沉积在膜表面是一个阻碍,因此衰减速率也降低.M-12的通量衰减率相对于M-9有所增加,当PVDF膜在多巴胺溶液中浸涂12 h后,膜的表面会沉积大量的PDA颗粒,使膜表面的粗糙度增加,可能是造成水通量的衰减增加的原因[19-21].
图6为膜被污染后的水通量恢复率,图7为未改性膜和改性膜的污染指数.
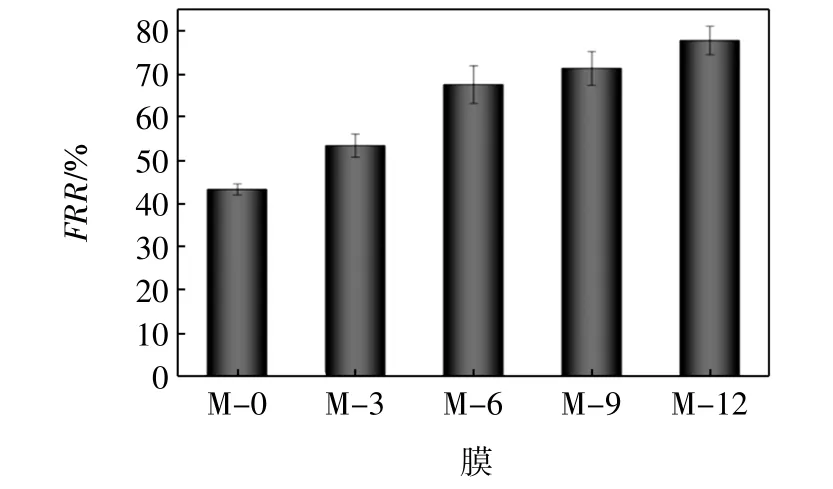
图6 膜(M-0、M-3、M-6、M-9和 M-12)的纯水通量恢复率Fig.6 Flux recovery ratio(FRR)of membranes(M-0,M-3,M-6,M-9 and M-12)

图7 膜(M-0、M-3、M-6、M-9 和 M-12)的抗污染指数Fig.7 Fouling resistance ratio of membranes(M-0,M-3,M-6,M-9 and M-12)
由图6可见,FRR的值呈现一个逐渐增加的趋势,M-0、M-3、M-6、M-9 和 M-12 的 FRR 值分别为43.26%、53.41%、67.54%、71.31%、77.73%.这是由于纯PVDF膜是疏水性的,BSA分子很容易吸附在PVDF膜表面,随着渗透时间的延长,会造成一定的不可逆污染,因此纯PVDF的FRR值较低.改性膜FRR值均高于纯PVDF膜,是因为经过多巴胺改性后,PVDF膜表面黏附了一层薄薄的PDA亲水层,当渗透含有BSA的溶液时,溶液中的水分子首先与亲水的PDA层接触,并通过氢键作用与PDA层之间作用形成水化层,水化层对污染物有一定的排斥作用,因此亲水性的表面能够降低有机污染物与亲水性膜表面的粘附力.由图7可见,M-0的Rir和Rr的值分别为57.93%和11.07%.经过改性后,Rir值降低至35.76%,Rr值增加至21.04%(M-12).这也证明经过多巴胺改性的PVDF分离膜具有较好的抗蛋白污染能力.
3 结论
通过多巴胺沉积的方法对PVDF微滤膜进行表面亲水改性,系统地研究不同沉积时间对PVDF微滤膜的抗蛋白污染性能影响.
(1)多巴胺改性膜表面的水接触角有较为明显的降低,最低达到约44°,PDA沉积时间为6 h时,PVDF微滤膜的渗透通量最大,为103.7 L/(m2·h),沉积时间大于6 h后渗透通量呈现降低的趋势,但是对BSA蛋白的分离效果逐渐增加,最大截留率可以达到96.5%.
(2)通过对PVDF微滤膜的动态抗蛋白污染测试,PVDF分离膜的FRR从未改性的43.26%增加到改性膜的77.73%(M-12),且PVDF微滤膜的Rir值从未改性的46.56%降低到23.76%.
