125I粒子支架联合局部灌注化疗治疗晚期食管癌的疗效分析
2018-09-18刘娟芳段旭华张文广陈鹏飞韩新巍
刘娟芳, 段旭华, 张文广, 陈鹏飞, 韩新巍
我国是食管癌高发的国家,也是世界上食管癌高死亡率的国家之一[1]。早期食管癌主要以手术切除为主,对于不能手术或者手术难度大的中晚期食管癌,放化疗是主要治疗方法。传统放化疗模式全身不良反应大、并发症较多。125I粒子支架是携带125I粒子的覆膜支架,能局部释放γ和X射线,兼具治疗肿瘤及缓解食管狭窄的功能。支架植入后再进行动脉导管局部灌注化疗,能较好控制肿瘤发展。我们应用125I粒子支架联合局部灌注化疗治疗晚期不能切除食管癌患者,效果良好,现报道如下。

图1 食管癌粒子支架释放图1A:63岁女性,食管造影显示肿瘤致食管中下段狭窄,狭窄段长4.8 cm;1B:为125I例子支架对准狭窄段后释放,两端越过狭窄段2 cm;1C:为支架释放后再次食管造影,通过顺畅
1 资料与方法
1.1 一般资料
郑州大学第一附属医院2013年1月至2016年10月收治晚期食管癌46例。其中男28例,女18例;年龄42.3~80.1岁,平均年龄61.2岁。经外科会诊后不能手术35例,手术难度较大且患者体质差,拒绝手术11例。鳞状细胞癌(鳞癌)39例,腺鳞癌4例,腺癌3例。高分化7例,中分化15例,低分化24例。临床Ⅲ期33例,Ⅳ期13例。卡氏评分,50分8例,60分25例,70分7例,80分6例。吞咽困难按Stooler分级法,1级3例,2级19例,3级20例,4级4例。
1.2 治疗方法
1.2.1 术前准备 术前通过食管造影、胃镜、CT明确病变部位、肿瘤直径及周围侵犯情况。将CT图像导入治疗计划系统(TPS),制定出粒子剂量、数量粒子仓层数及间距,并结合CT图像相应层面厚度及面积进行综合布源。模拟公式:颗粒数=(长度+宽度+厚度)×3/(粒子活度×120%)。应用南京微创医学科技股份有限公司生产的可携带125I核素粒子捆绑式覆膜支架,支架直径18~20 mm,长度6~18 cm。根据术前TPS计划系统指定粒子定位,由专业人员进行粒子槽安装。
1.2.2 支架置入方法 利多卡因麻醉咽喉部,置开口器,在血管剪影造影系统下,在泥鳅导丝配合下将5FKMP导管送入食管内,撤出导丝,在病变下端回撤导管造影,标记病变狭窄区并进行定位;导丝及导管配合下进入胃腔,退出导丝,交换泥鳅加硬导丝,退出5F导管。沿导丝缓慢插入支架置入器,在透视下确定位置,支架上、下缘标记分别超过狭窄段上下端2 cm,确定位置后再释放支架(狭窄严重者先行球囊扩张再行支架置入)。术后再次口服造影剂,在透视下观察支架释放是否通畅。观察有无125I粒子移位或丢失(图1)。支架上口留置安全线,将其外端缠绕于患者耳根并用胶布固定。
1.2.3 支架置入后处理 术后口服抗菌药物(头孢类)24~48 h,给与抑酸(奥美拉唑)、增强胃动力(多潘立酮)等药物对症治疗。术后2 h后可进食温水、流质,并逐步转为正常饮食,嘱患者坐位进食,进食后活动。禁止进食冷、硬、粗糙、黏稠食物,避免支架移位、滑脱或堵塞。术后48~72 h、1个月后分别复查食管造影,了解支架膨胀、贴壁情况,支架是否移位,必要时进行调整。
1.2.4 局部灌注化疗 支架置入术后5~7 d行局部灌注化疗,利用Seldinger技术行股动脉穿刺,插入导管,根据肿瘤所在位置,对可能的肿瘤供血血管进行选择性或超选择性插管造影。对肿瘤血管灌注化疗药物。本组均采用DFT方案:顺铂(DDP)80~100 mg/m2,氟尿嘧啶(FU)750~1 000 mg/m2,吡柔比星(THP)14~25 mg/m2,间隔4~6周行下一疗程灌注化疗,共行4次灌注化疗。
1.3 疗效评价
患者生存质量采用卡氏评分评估,吞咽困难采用Stooler分级评定,客观疗效评价参考世界卫生组织(WHO)实体肿瘤评价标准进行影像学评价。术后2个月行 CT 检查,把治疗前后CT 图像上 2 个相互垂直肿瘤最大直径乘积进行比较。疗效评价标准:① 完全缓解(CR):食管癌病灶或肿大淋巴结完全消失,影像学检查不能显示或仅有条索状影;② 部分缓解(PR):病灶缩小>50%;③ 稳定(SD):病灶缩小<50% 或增大<25%;④ 进展(PD):病灶或淋巴结增大≥25%,或出现新的转移性淋巴结。当有多个淋巴结同时治疗,以疗效最差者为准。客观有效率=(CR+PR)例数/总例数×100%,获益率=(CR+PR+SD)例数/总例数×100%。
1.4 统计学方法

2 结果
2.1 术前与术后2个月患者卡氏评分比较
术后2个月,患者的卡氏评分较术前提高,差异有统计学意义(P<0.05)(表1)。

表1 术前与术后2个月卡氏评分比较(例)
2.2 术前与术后1周和术后1个月患者吞咽困难分级比较
与术前相比,术后1周Stooler分级较术前降低,差异有统计学意义(Z=339.5,P<0.001);术后1个月Stooler分级较术前降低,差异有统计学意义(Z=78.0,P<0.001),与术后1周相比,差异也有统计学意义(Z=538.5,P<0.001),见表2。
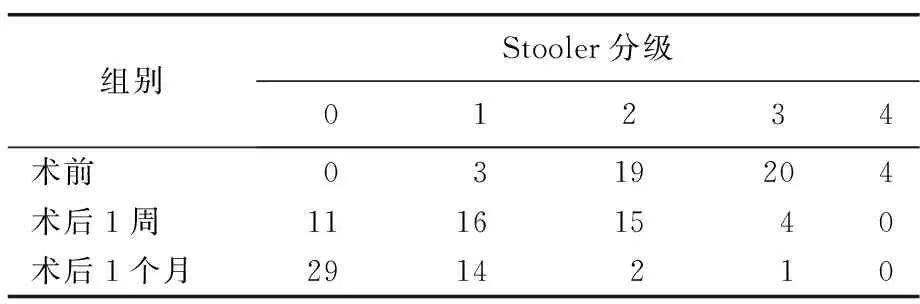
表2 Stooler吞咽困难分级比较(例)
2.3 客观疗效
本文46例患者中,CR 11例,PR 23例,SD 7例,PD 5例。客观有效率73.9%,获益率89.1%。
2.4 术后1年生存率
术后1年生存率71.7%(33例存活,13例死亡)。其中2例死于脑血管疾病,1例死于交通事故,8例死于全身多器官功能衰竭,2例死于心肌梗死。术后2年生存率尚在随访中。
2.5 并发症
本文患者无大出血,窒息,穿孔,瘘,支架移位,放射性肺炎,肺纤维化等不良反应发生。16例有胸骨后疼痛,5例出现咳嗽、咳痰,偶有血丝,8例自感存在异物感,均未予处理,1周后自行缓解。12例化疗后出现恶心、呕吐,腹胀,乏力,可耐受。6例出现Ⅲ度以上骨髓抑制,予粒细胞集落刺激因子治疗后好转。
3 讨论
食管癌是常见消化道肿瘤,尽管我国在食管癌手术治疗方面取得了较大进展,但由于食管癌缺乏早期症状,多数在确诊时已属中晚期,失去了根治手术的机会。中晚期食管癌患者多伴有吞咽困难、进食差,全身营养状况差,传统外放疗或全身化疗虽可达到减瘤荷而缓解进食困难,但是这两种方法不能立即改善患者吞咽困难,且由外放疗引起放射性肺炎、放射性食管炎、食管瘘、食管气管瘘等并发症较常见。且外放疗不能持续杀伤肿瘤。
食管支架的置入能有效解决患者进食问题,但无治疗作用。携带125I放射性粒子食管支架解决进食困难同时可行局部放疗[2-4]。125I粒子可发射较低能量γ射线,辐射半径为1.7 cm,半衰期为59.6 d。在距支架1 cm靶区可集中其放射性90%,其能量在较远距离衰减较重,距支架2 cm处剂量已减少至80%~93%[5]。郭金和等[6]研究发现,125I粒子支架对周围正常组织损伤非常小,无严重并发症出现。从放射生物学效应角度来讲,低剂量、较长期持续放射源更易杀灭肿瘤细胞[7]。在治疗肿瘤同时,覆膜支架能防止肿瘤向支架内生长而发生再狭窄,同时也可防治出现的食管-气管瘘。本研究结果显示,携带放射性125I 粒子食管内照射支架联合介入化疗能立即改善晚期食管癌患者的进食,降低Stooler吞咽困难分级,3~4级吞咽困难从术前24例降低为术后1周4例、术后1个月1例,极大程度改善患者进食情况,进而生存质量的卡氏评分得以提高。
放疗可提高肿瘤局部控制,化疗在增加放射敏感性同时,可一定程度控制潜在转移病灶。行肿瘤供血动脉内灌注化疗药物,要依据肿瘤供血动脉数目及供血多少酌情分配药物剂量[8-10]。局部用药既可提高进入瘤体内有效药物量和浓度,以增加疗效,又可减少或避免可能发生的全身的毒副反应[11]。肖高社等[12]研究表明,食管癌动脉灌注化疗次数与治疗效果有相关性。证实了≥2次治疗患者的近期有效率为96.6%,较单次治疗近期有效率58.8%提高。因此,本文患者均行4次灌注化疗。部分病例出现恶心、呕吐、腹胀、乏力,多可耐受。少部分病例出现Ⅲ度以上骨髓抑制,无1例出现严重肝肾功能损害。
食管癌治疗需要多学科相互协作,综合治疗[13-15]。125I放射性粒子支架可局部高效治疗肿瘤,同时明显改善患者进食状态,提高卡氏评分,为后续动脉灌注化疗提供支持[16]。灌注化疗则能对血液的癌细胞进行清洗和杀灭[17]。我们对46例确诊为食管癌晚期患者应用装有125I 粒子食管支架进行治疗,以达到杀灭局部肿瘤的目的,同时局部灌注化疗,两者优势互补、增加疗效。术后2个月,患者肿瘤治疗客观有效率73.9%,1年生存率71.7%。
综上所述,携带放射性125I 粒子食管内照射支架联合介入动脉灌注化疗对于晚期食管癌是安全、有效的治疗方法。由于本研究病例随访时间不长,其远期疗效及不良反应仍需大样本、多中心临床试验来证实。
