例谈无机工艺流程题中离子的除杂和分离
2018-09-17韩万中
韩万中


摘要: 基于离子性质的多样性及特殊性,通过实例的方式对无机工艺流程题中的离子分离和消除方法进行总结,除了常见的沉淀法、氧化还原转化法外,还有调节溶液的pH法、加入难溶电解质法、离子交换树脂法、萃取和反萃取法、电渗析法等,说明了上述各方法的特点,阐述了其中的化学原理。
关键词: 无机工艺流程题; 离子的除杂和分离; 解题思路
文章编号: 1005-6629(2018)6-0082-06 中图分类号: G633.8 文献标识码: B
在无机制备、资源回收、选矿和提取稀有金属等实验或实际生产中,分离除去杂质离子是提纯工艺流程中的重要环节。不同的离子性质不同,即使是同种离子在不同的物理或化学环境中表现出来的性质往往也不尽相同,这样的差异性或其特殊反应,必然决定了离子除杂或分离的复杂性和独特性。选用合适的试剂与杂质离子反应直接形成沉淀或通过氧化还原反应转化为需保留的离子是学生最容易接受和理解的方法,如使用NaF沉淀Li+,使用氧化剂将Fe2+转化为Fe3+等。但沉淀法、氧化还原转化法不是万能的,由于离子的“个性”,加之运用一定的技术手段,因此,在实际生产工艺中还有其他“高招”。本文欲通过例题方式,整合和迁移分散在教材中的各种分离除杂方法,突破简单思维和思维定势,以期提高学生乃至教师的工程素养。
1 调节溶液的pH法除杂质离子
利用不同金属离子水解程度的不同及金属氢氧化物的Ksp的差异,通过加入适当物质,升高溶液的pH使之处于某范围内,促进溶液中某些金属离子水解生成氢氧化物沉淀除去。同理,对于部分弱酸根离子,可降低溶液pH至一定的范围,促使杂质阴离子水解而沉降除去,并确保所需要的离子依旧存留在溶液中。
例1 (2015全国课标Ⅱ, 26改编) 酸性锌锰干电池是一种一次性电池,外壳为金属锌。有关数据如下表所示:
用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是: 加入稀硫酸和双氧水,溶解,铁变为 ,加碱调节pH为 ,铁刚好完全沉淀(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全)。继续加碱调节pH为 ,锌开始沉淀(假定Zn2+浓度为0.1mol·L-1)。若上述过程不加双氧水的后果是 ,原因是 。
分析: 酸性条件下铁被双氧水氧化为Fe3+,根据溶度积原理,通过调节溶液的pH可使铁锌两元素以Fe(OH)3和Zn(OH)2形式分离开来,若不加双氧水,其Fe(OH)2和Zn(OH)2的Ksp非常接近,无法达到分离的目的。
当Fe3+完全以Fe(OH)3沉淀时,溶液中c(OH)-=310-3910-5=1×10-11.3mol·L-1,其pH=2.7;当Zn(OH)2开始沉淀时,溶液中c(OH-)=10-170.1=1×10-8mol·L-1,其pH=6。
答案: Fe3+; 2.7; 6; Zn2+和Fe2+分离不开;Fe(OH)2和Zn(OH)2的Ksp相近。
总结: 以M(OH)n为通式,则Ksp=c(Mn+)·cn(OH-), c(OH-)=nKsp/c(Mn+)。设开始沉淀时金属离子浓度为0.1mol·L-1,完全沉淀时金属离子浓度为1×10-5mol·L-1,代入上式pH(开始沉淀)=14+1nlgKsp0.01, pH(完全沉淀)=14+1nlgKsp10-5。
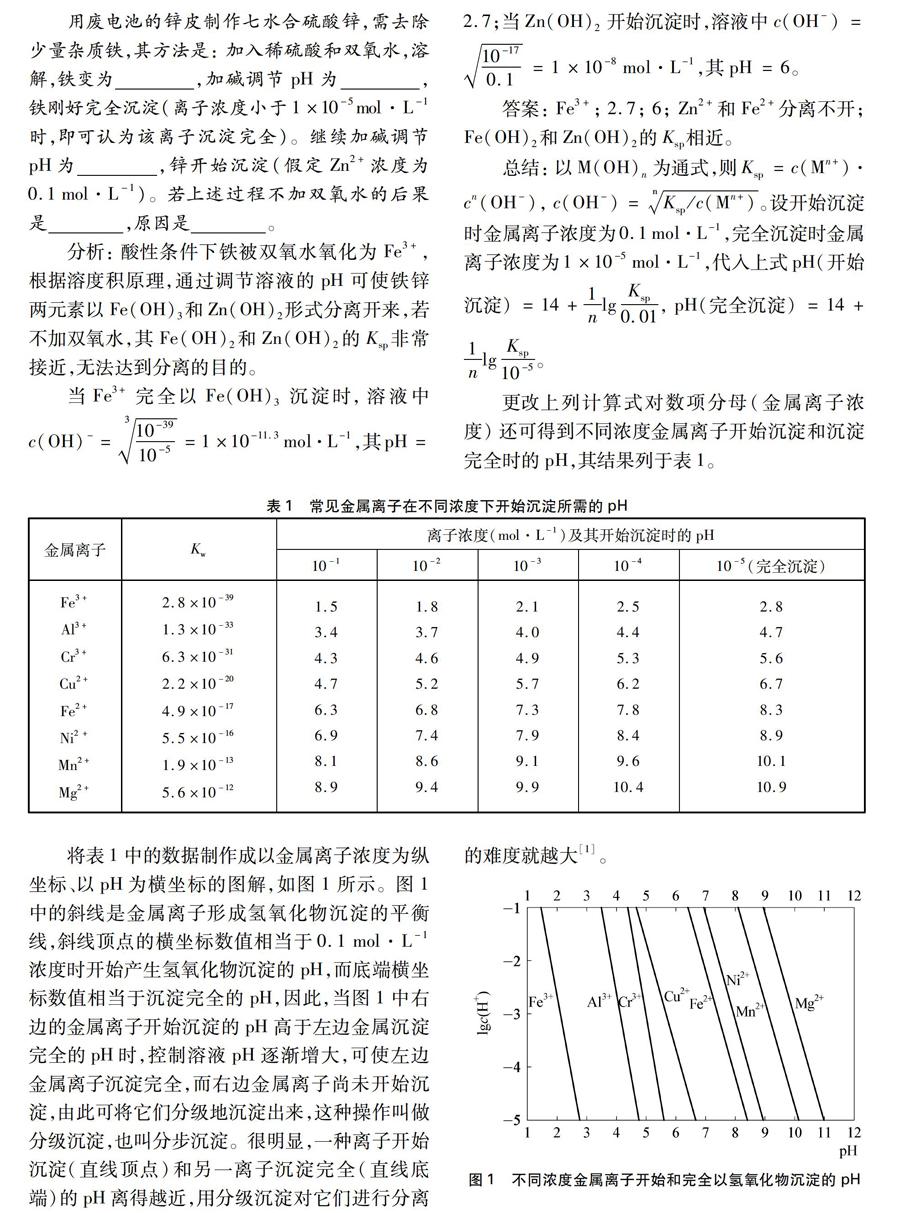
更改上列计算式对数项分母(金属离子浓度)还可得到不同浓度金属离子开始沉淀和沉淀完全时的pH,其结果列于表1。
将表1中的数据制作成以金属离子浓度为纵坐标、以pH为横坐标的图解,如图1所示。图1中的斜线是金属离子形成氢氧化物沉淀的平衡线,斜线顶点的横坐标数值相当于0.1mol·L-1浓度时开始产生氢氧化物沉淀的pH,而底端横坐标数值相当于沉淀完全的pH,因此,当图1中右边的金属离子开始沉淀的pH高于左边金属沉淀完全的pH时,控制溶液pH逐渐增大,可使左边金属离子沉淀完全,而右边金属离子尚未开始沉淀,由此可将它们分级地沉淀出来,这种操作叫做分级沉淀,也叫分步沉淀。很明显,一种离子开始沉淀(直线顶点)和另一离子沉淀完全(直线底端)的pH离得越近,用分级沉淀对它们进行分离的难度就越大[1]。
调节溶液的pH方法很多,可根据需调节pH的范围选择合适的试剂,如逐步加入金属氧化物、强碱弱酸盐、强碱等均可使溶液pH升高,但升高的程度不同,对溶液中离子组成的影响也不同。例如,去除酸性ZnSO4溶液中的Fe3+,可加入ZnO使溶液pH约升高到3即可使Fe3+完全形成Fe(OH)3沉淀而除去,且不引入杂质离子。
至此,个别学生还可能有一点不解: Fe3+、 Cu2+怎么能在酸性溶液中形成氢氧化物沉淀呢?在水溶液中,OH-是客观存在的,且c(OH-)×c(H+)=Kw。只要OH-与金属阳离子的溶度积大于其氢氧化物的Ksp即可发生沉淀,由于一些金属氢氧化物的Ksp较小,所以它们开始沉淀甚至完全沉淀时,溶液可能仍然处于酸性条件范围内。
2 利用难溶电解质的溶解平衡原理除去某些离子
例2 高纯MnCO3是制备高性能磁性材料的主要原料。某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中(见下图)通入过量混合气进行“浸锰”操作,主要反应原理为: SO2+H2OH2SO3; MnO2+H2SO3MnSO4+H2O(錳浸出后,过量的SO2会将Fe3+还原为Fe2+)。
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰。请回答:
(2) ③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4溶液。用平衡移动原理解释加入MnS的作用 。
分析: 对于第(2)问,题目中肯定了难溶电解质MnS可除去Cu2+,暗指Ksp(MnS)>Ksp(CuS),也就是说难溶性沉淀向着更难溶的沉淀方向转化。在人教版选修4第65页给出了CuS的溶度积数值6.3×10-36,上课的时候,教师一般告诉学生CuS是硫化物中最难溶的物质之一。从溶解平衡移动的角度分析,难溶的MnS在水溶液中存在溶解平衡MnS(s)Mn2+(aq)+S2-(aq),溶解出来的S2-与滤液中的Cu2+结合成更难溶的CuS,由于c(S2-)的减小,促使MnS溶解平衡向溶解出S2-的方向移动,直至将Cu2+除尽。
答案: (1) 将Fe2+氧化为Fe3+,将过量的SO2氧化除去; MnO2+2Fe2++4H+2Fe3++Mn2++2H2O, MnO2+SO2Mn2++SO2-4; Fe(OH)3。(2)略(参照“分析”)。
总结: 例2涉及了沉淀的转化,相同类型的难溶电解质沉淀,Ksp大的向着Ksp小的转化。向含Cu2+的溶液中加入难溶物MnS,体系中同时存在两个沉淀溶解平衡:
其一,由于K值远远大于1×105,反应向右进行的程度很大,这说明用难溶物MnS除去Cu2+是彻底的;其二,达到平衡时,c(Mn2+)c(Cu2+)=4.0×1022,这表明只要溶液中c(Cu2+)大于2.5×10-23倍的c(Mn2+),杂质Cu2+就能够被MnS轉化,这样的浓度要求已经是再低不过了,所以说使用MnS除去Cu2+是具有实际意义的。
3 离子交换树脂法除去杂质离子
离子交换树脂是一类带有化学活性基团、具有网状结构、不溶于水的有机高分子电解质,具有较高的负载、较好的动力学表现和应用范围广等 优点[2]。有关离子交换树脂的内容仅在人教版化学选修2《化学与技术》的第27页出现了一次,并例举了钠型和氢型两种阳离子交换树脂在水质的软化中的应用原理: 2NaR+Ca2+CaR2+2Na+、 2NaR+Mg2+MgR2+2Na+。我们从中可以发现离子交换树脂法的本质是同性离子的等价交换,遵循溶液电中性原理,如NaR中2mol的Na+可交换硬水中的1mol Ca2+或Mg2+。
离子交换树脂使用一段时间后由于达到平衡状态而失去交换能力,可进行再生处理,即用化学药品使离子交换反应以相反方向进行,使树脂的活性基团恢复到原来状态。
例3 某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、 Ca2+、 Fe3+、 Al3+、 Cu2+、 Mg2+):
分析: 伴随着杂质离子不断除去的过程便完成了Cr元素的回收与再利用。工艺流程中“调pH”的沉铁过程,用化学方程式可表示为
2Fe2++H2O2+2H+2Fe3++2H2O;
Fe2(SO4)3+4H2O2FeO(OH)+3H2SO4;“氧化”是将目标Cr3+转化为Cr2O2-7,这与后续过程的“还原”遥相呼应;加NaOH“调pH=8”是除去Cu2+和Al3+,这一点同Fe3+的除杂原理相似,利用的是其氢氧化物Ksp较小的特性,更直观的是题目给出的表格信息“常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH”,从中一望而知。“钠离子交换树脂”是一种阳离子交换树脂,被交换出来的是树脂中的Na+,被树脂吸附的离子则为Ksp较大难以运用溶度积原理除去的Mg2+、 Ca2+。
答案: Al3+、 Cu2+; Mg2+、 Ca2+。
4 运用萃取和反萃取法分离离子
人教版《化学1》第一章第一节第8页就以从实验走进化学世界的思想,介绍了萃取的概念、仪器以及操作方法和步骤,《化学2》中也有萃取应用的零星涉及;选修5第一章第四节又进行了萃取的再学习,至此,大多数学生应该能够很好地理解萃取的原理、类型和应用。
萃取的逆过程就是反萃取。萃取剂一般是有机溶剂,反萃(取)剂则为无机溶液。反萃取就是用反萃取剂使被萃取物从负载有机相返回水相的过程。反萃取剂主要起破坏有机相中被萃组分结构的作用(如用NaOH溶液反萃取CCl4中的I2,就是使I2转化为I-和IO -3),使被萃组分生成易溶于水的化合物,或生成既不溶于水也不溶于有机相的沉淀,经过反萃取及所得反萃液经过进一步处理后,便得到被分离物的成品[3]。反萃取后经洗涤不含或少含萃取物的有机相称再生有机相,可继续循环使用。
萃取和反萃取既然是一种分离提纯工艺,也可以用于某些离子的除杂。
例4 工业上设计将VOSO4中的K2SO4、 SiO2杂质除去并回收得到V2O5的流程如下:
步骤②、 ③的变化过程可简化为(下式R表示VO2+, HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)2RAn(有机层)+nH2SO4(水层)
(1) ②中萃取时必须加入适量碱,其原因是 ;③中X试剂为 。
(2) 该工艺流程中,可以循环利用的物质有氨和 。
分析: 观察工艺流程图,②中VO2+通过萃取分离进入有机相中,③通过反萃取VO2+重新进入水相,从而将杂质K+淘汰出局。
在本题中,给出了萃取和反萃取变化过程的简化式: R2(SO4)n(水层)+2nHA(有机层)2RAn(有机层)+nH2SO4(水层),从本质上看这是一种化学平衡。对第(1)问,加入碱中和上述平衡体系中的硫酸,使平衡向正反应方向移动,提高钒的萃取率;加入X试剂的目的是得到有机萃取剂HA,这就需要使上述平衡逆向移动,且不能引入新的杂质,因此X为硫酸。
对(2)问: 图中萃取步骤消耗有机萃取剂,反萃取步骤生成有机萃取剂,因此有机萃取剂HA可以循环利用。
答案: (1)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率;H2SO4;(2)有机萃取剂。
总结: 萃取和反萃取是分离除杂工艺中的重要手段。2013年全国Ⅰ卷27题有关废旧锂离子电池回收利用工艺流程中,在呈现的信息中出现了有机相、水相以及反萃取这样的名词,虽没有考查反萃取的原理和具体操作,但提高了学生思维的要求以及探究的欲望。其实,仔细阅读流程图,不难看出: 萃取操作使Li+进入水相,Co2+进入有机相,通过反萃取再使Co2+重新返回水相,其中离子分离关系非常清晰,好似游离于教材之外,但处于高考考生的理解范围之内。2015年浙江卷第29题也涉及到了萃取和反萃取工艺操作。
5 利用电渗析技术将离子分离
例5 (2017天津,7节选)某混合物浆液含有Al(OH)3、 MnO2和少量Na2CrO4。考慮到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见下图),使浆液分离成固体混合物和含铬元素溶液。
用惰性电极电解时,CrO2-4能从浆液中分离出来的原因是 ,分离后含铬元素的粒子是 ;阴极室生成的物质为 (写化学式)。
分析: 上图中右室为阳极区,Na2SO4溶液中H2O电离出的OH-放电,电极方程式为2H2O+4e-O2↑+4H+,由于“多”出了阳离子,为维持溶液电中性,混合物浆液中的CrO2-4在电场力的作用下克服胶体吸附的力量,穿透阴离子交换膜迁移到阳极室,由于溶液酸性的增强使得2CrO2-4+2H+Cr2O2-7+H2O(很多学生忽视该转化过程,它出现在人教版选修4第26页)平衡向右移动,分离后含铬元素的粒子有CrO2-4和Cr2O2-7两种;阴极室分析与阳极室类同,阴极室生成的物质为NaOH和H2。
答案: 在直流电场作用下,CrO2-4通过阴离子交换膜向阳极室移动,脱离浆液;CrO2-4和Cr2O2-7; NaOH和H2。
总结: 胶体具有很高的比表面积,因而具有很强的吸附能力,以降低其表面能。该混合浆液具有胶体的性质,其吸附作用使CrO2-4不易完全被水浸出,这个从实践中遭遇到的“坑”是命制本题的背景和出发点。如何使离子从胶体的“怀抱”中脱出,问题转向借助电化学的力量,同时利用现代科技产品离子交换膜的选择透过性,这不仅告诉我们电渗析技术是一种离子分离的手段[4],同时还向我们展示了化工技术的不断进步和创新。
综上所述,杂质离子的分离或除去不只限于传统的化学沉淀法、氧化还原转化法,还有调节溶液pH法、离子交换法、萃取和反萃取法、电渗析法等等,在具体实践操作中,我们需要根据离子所处的物理化学环境,选择简便易行、经济有效、绿色环保的方法才是科学和正确的。
参考文献:
[1]北京师范大学、华中师范大学、南京师范大学无机化学教研室. 无机化学(上册)(第四版)[M]. 北京: 高等教育出版社, 2002: 343~344.
[2]李兵兵. 离子交换树脂的结构特点及应用[J]. 黑龙江科技信息, 2015, (11): 127.
[3]张大力, 卢立柱, 柯家骏. 金属离子反萃取[J]. 湿法冶金, 1995, (3): 1~3.
[4]李媛, 王立国. 电渗析技术的原理及应用[J]. 城镇供水, 2015, (5): 16~22.
