miR-148b-3p在前列腺癌细胞增殖和迁移中的作用机制
2018-09-14周治军
龚 化,周治军,卢 童,徐 康,鲁 文
(1.湖北省天门市第一人民医院 泌尿外科,湖北 天门 431700;2.湖北省天门市第一人民医院 神经内科,湖北 天门 431700)
前列腺癌的发病率逐年升高,是男性泌尿、生殖系统最常见的恶性肿瘤之一[1]。转移是前列腺癌重要的生物学特性,多数患者确诊时已有远处转移,然而其转移的分子机制尚不清楚[2]。调节前列腺癌增殖、迁移相关基因的表达,抑制细胞的增殖和迁移,是前列腺癌靶向治疗研究的热点[3]。微小RNA(miRNA)是一类存在于真核生物体细胞中的内源性非编码RNA,可在转录水平抑制基因的表达,起着癌基因或抑癌基因的作用[4-5]。miR-148b-3p在多种肿瘤中呈低表达,发挥抑癌作用[6]。然而我们通过qPCR检测发现miR-148b-3p在多种前列腺癌细胞株中的表达均明显升高,miR-148b-3p在前列腺癌中的作用值得研究。本文通过将miR-148b-3p inhibitor转染至前列腺癌细胞PC-3,检测低表达miR-148b-3p对前列腺癌细胞PC-3增殖和迁移能力的影响,并探讨在基因及蛋白水平的作用机制,为前列腺癌的miRNA分子靶向治疗提供新的实验基础。
1 材料与方法
1.1 细胞株和主要试剂 RPMI-1640培养液、KSFM培养液和胎牛血清购自美国HyClone公司;前列腺癌细胞株LNCap、22RV1、DU-145、PC-3和人正常前列腺上皮细胞RWPE-1购自上海拜力生物科技有限公司;荧光实时定量PCR试剂盒购自日本TaKaRa公司;miR-148b-3p 抑制物(inhibitor)、阴性对照miR-NC、miR-148b-3p模拟物、野生型PTEN 3’UTR-荧光素酶载体(PTEN-Wt)和突变型PTEN 3’UTR-荧光素酶报告载体(PTEN-Mut)及PCR引物由上海捷瑞生物工程有限公司合成构建;Lipofectamine 2000购自美国Invitrogen公司;CCK8试剂盒购自武汉博士德生物工程有限公司;Transwell小室购自美国Corning公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;一抗PTEN、CDK6、Cyclin D2、Claudin-1、Vimentin、GAPDH和二抗均购于美国CST公司。
1.2 细胞培养和转染 用含10%胎牛血清的RPMI-1640培养液培养前列腺癌细胞LNCap、22RV1、DU-145和PC-3,用含10%FBS的KSFM培养液培养人正常前列腺上皮细胞RWPE-1,置于37℃、5%CO2、饱和湿度的培养箱内常规培养。转染步骤参考Lipofectamine 2000说明书,以对数生长期的PC-3细胞进行转染操作,分别瞬时转染miR-NC(对照组)和miR-148b-3p inhibitor(实验组)。
1.3 qPCR检测miR-148b-3p和PTEN mRNA表达 用qPCR法检测前列腺癌细胞株(5株)及转染操作后两组细胞中miR-148b-3p和PTEN mRNA表达。用TRIzol法提取细胞总RNA,并使用反转录试剂盒反转录为cDNA。qPCR扩增条件为:95℃ 3min;95℃ 15s、58.8℃ 30s、72℃ 30s,35个循环,采用荧光实时定量PCR试剂盒进行qPCR检测,以GAPDH为内参,qPCR阈值Ct值以2-ΔΔCt分析处理。miR-148b-3p引物上游5’- GGATGTCAGTGCATCACAGAAC -3’,下游5’-CAGTGCGTGTCGTGGAGT-3’。PTEN引物上游5’-TGGATTCGACTTAGACTTGACCT -3’,下游5’- GGTGGGTTATGGTCTTCAAAAGG -3’。GAPDH引物上游5’-ACAACTTTGGTATCGTGGAAGG-3’,下游5’- GCCATCACGCCACAGTTTC -3’。
1.4 CCK8法检测细胞增殖活性 转染48 h后,消化收集两组PC-3细胞,调整细胞密度,每孔以4×103个接种于96孔板。分别培养1、2、3、4、5 d后加入10 μL/孔 CCK8溶液,培养箱中孵育4 h,弃去培养液,加入150 μL/孔二甲基亚砜,振荡15 min,酶标仪测定每孔在490 nm波长的吸光度(OD值),每组四个复孔。
1.5 Transwell 检测细胞迁移能力 转染48 h后,消化收集两组PC-3细胞,用无血清培养液制成单细胞悬液,上室中每孔接种细胞4×104个;下室加入含完全培养液,培养24 h。取出上室,棉签拭去未穿过膜的细胞,甲醇固定10 min,0.1%的结晶紫染色20 min,镜下观察,每孔取四个视野计细胞数,取平均值。
1.6 miR-148b-3p靶标基因预测及双荧光素酶报告基因检测实验验证 通过在线miRNA靶基因预测工具microRNA.org - Targets and Expression预测 miR-148b-3p的潜在靶点。分别将荧光素酶报告载体与miR-148b-3p模拟物或miR-NC按LipofectamineTM 2000说明书共转染至PC-3细胞。实验分组为PTEN-Wt+miR-NC、PTEN-Wt+miR-148b-3p、PTEN-Mut+miR-NC和PTEN-Mut+miR-148b-3p。转染4 h后换液,培养箱中培养48 h后收集细胞。按双荧光素酶报告基因检测试剂盒说明书,使用酶标仪仪检测细胞荧光素酶活性。相对荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.7 Western blot检测PTEN蛋白及相关蛋白表达 转染48 h后,消化收集两组PC-3细胞,使用细胞裂解液提取细胞总蛋白,每组取50 μg蛋白经SDS-PAGE凝胶电泳后,转移至PVDF膜,5%脱脂牛奶室温下封闭2 h,配制一抗PTEN(1∶1 000稀释)、CDK6(1∶2 000稀释)、Cyclin D2(1∶1 000稀释)、Claudin-1(1∶2 000稀释)、Vimentin(1∶1 500稀释)和GAPDH(1∶1 500稀释),4 ℃下与一抗孵育过夜,室温下与二抗摇床上孵育2 h,ECL显影液曝光显影。

2 结果
2.1 前列腺癌细胞株中miR-148b-3p的表达 qPCR结果显示,前列腺癌细胞株LNCap、22RV1、DU-145、PC-3和人正常前列腺上皮细胞RWPE-1中miR-148b-3p的表达分别为3.29±0.24、2.35±0.20、4.35±0.19、6.03±0.57和1.05±0.19,各前列腺癌细胞株中miR-148b-3p的表达均高于正常前列腺上皮细胞,差异有统计学意义(P<0.01),PC-3细胞中miR-148b-3p的表达最高(P<0.05,见图1)。
2.2 两组PC-3细胞中miR-148b-3p的表达 对照组和实验组PC-3细胞中miR-148b-3p相对表达量分别为1.02±0.12和0.37±0.11,实验组显著低于对照组(P<0.01)。
2.3 低表达miR-148b-3p对前列腺癌细胞增殖活性的影响 CCK8法结果显示:第3天,对照组和实验组PC-3细胞的吸光度OD值分别为1.12±0.10和0.81±0.05(P<0.05);第4天,分别为1.75±0.09和1.18±0.09(P<0.01);第5天,分别为2.53±0.19和1.57±0.13(P<0.01)。实验组明显低于对照组,差异有统计学意义(P<0.05,见图2)。
2.4 低表达miR-148b-3p对前列腺癌细胞迁移能力的影响 Transwell 实验结果显示(见图3),对照组和实验组PC-3细胞穿过多孔膜的细胞数分别为220.90±18.91和107.50±9.14,低表达miR-148b-3p的前列腺癌细胞穿膜能力明显低于对照组,差异有统计学意义(P<0.01)。低表达miR-148b-3p的PC-3细胞的迁移能力受到抑制。
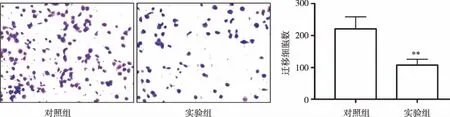
与对照组比较,**P<0.01。
2.5 生物信息学软件和双荧光素酶报告基因检测实验预测并验证PTEN是miR-148b-3p的靶基因 通过使用microRNA.org - Targets and Expression预测PTEN是miR-148b-3p的靶基因,miR-148b-3p的种子区域序列与PTEN3’端非编码区域(3’UTR)互补,结果如图4。miR-148b-3p模拟物明显抑制野生型PTEN-Wt报告载体的荧光素酶活性,与miR-NC相比下调66.26%(P<0.01);而miR-148b-3p模拟物对突变型PTEN-Mut载体的荧光素酶活性无明显抑制作用(见图5)。实验结果表明,与生物信息学软件预测结果一致,miR-148b-3p能和PTEN的 3’UTR端结合。
2.6 两组PC-3细胞中PTEN mRNA的表达 qPCR结果显示,对照组和实验组PC-3细胞中PTEN mRNA相对表达量分别为1.03±0.13和4.10±1.15(P<0.01)。实验组PC-3细胞中PTEN mRNA的相对表达量显著高于对照组。
2.7 低表达miR-148b-3p对前列腺癌细胞PTEN蛋白及相关蛋白表达的影响 Western blott结果显示(见图6),与对照组相比,实验组中PTEN和Claudin-1蛋白表达升高,CDK6、Cyclin D2和Vimentin蛋白表达降低,表明低表达miR-148b-3p具有诱导PTEN蛋白表达的作用。
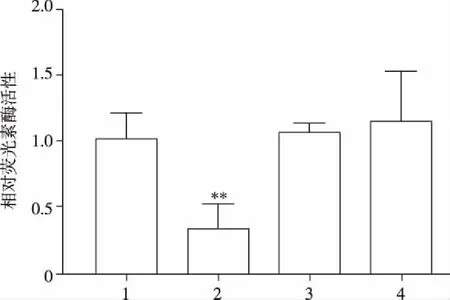
1:PTEN-Wt+miR-NC;2:PTEN-Wt+miR-148b-3p;3:PTEN-Mut+miR-NC;4:PTEN-Mut+miR-148b-3p;与1相比,**P<0.01。
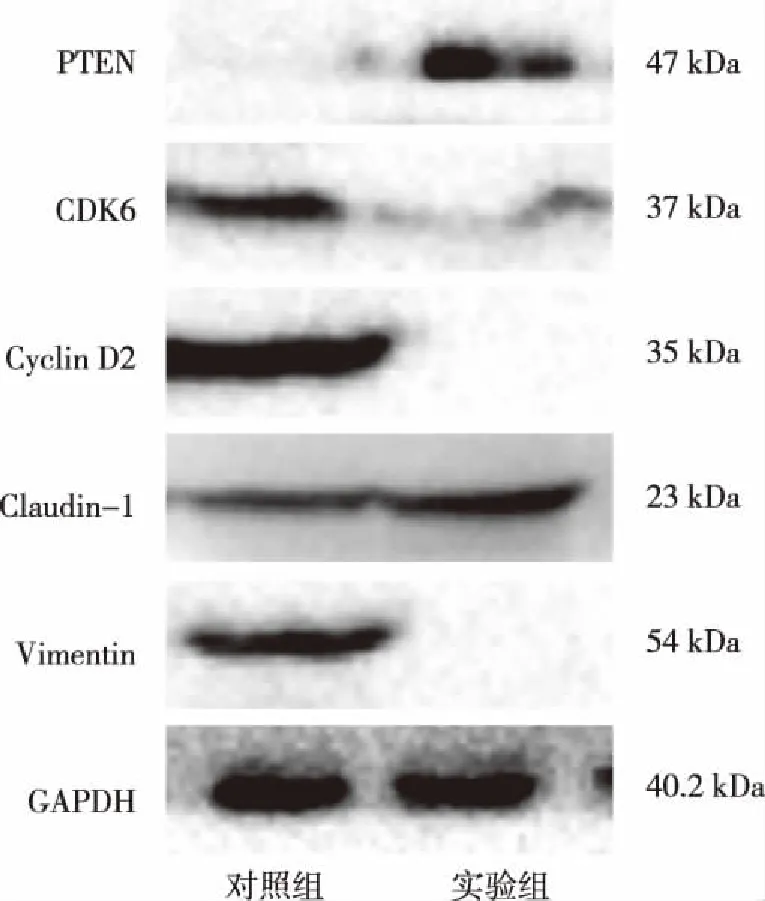
图6 Western blotting检测PTEN及相关蛋白表达情况
3 讨论
微小RNA(miRNA)通过在转录后水平降解或者干扰靶基因mRNA的翻译,抑制靶基因的表达,发挥调节肿瘤进展的作用,已成为近年来肿瘤研究的热点[7-9]。已有研究发现,miRNA 的表达异常与前列腺癌的进展密切相关[10],如miR-33a、miR-331-3p、miR-129等具有抑制前列腺癌细胞增殖、转移的作用,表现为抑癌效应[11-13];miR-210-3p、miR-20b等在前列腺癌组织中表达升高,发挥癌基因效应[14-16]。miR-148b-3p在多种肿瘤中呈现为低表达,负向调控肿瘤的生长和转移[6,17-18],在前列腺癌中的作用及具体机制尚处于研究阶段。
本研究发现,miR-148b-3p在前列腺癌细胞株中的表达量高于人正常前列腺上皮细胞,尤其在PC-3细胞中较为突出,提示miR-148b-3p的高表达可能参与前列腺癌的进展;低表达miR-148b-3p的前列腺癌细胞其增殖和迁移能力降低,提示miR-148b-3p具有或参与抑制前列腺癌细胞增殖和迁移。PTEN是一种新发现的抑癌基因,位于10q23.3,具有磷酸酶活性,通过去磷酸化作用负向调控肿瘤细胞的恶性生物学行为[19],在前列腺癌组织中呈低表达,与前列腺癌的恶性生物学行为呈负相关[20]。促进PTEN基因的表达,可能会抑制前列腺癌细胞的增殖和转移。通过生物信息学技术和双荧光素酶报告基因预测并验证了PTEN为miR-148b-3p的潜在靶基因,低表达miR-148b-3p可明显促进PTEN基因的表达, miR-148b-3p可能具有抑制PTEN基因表达的作用。Western blot实验进一步显示,低表达miR-148b-3p后,PTEN和Claudin-1蛋白的表达增加,CDK6、Cyclin D2和Vimentin蛋白的表达水平降低。Cyclin D2和CDK6均是细胞周期调控蛋白,二者通过形成复合物参与调控细胞周期的进展,诱导细胞DNA的合成,促进细胞的增殖[21]。低表达miR-148b-3p后,Cyclin D2-CDK6 复合物的形成减少,阻滞细胞周期,进而抑制PC-3细胞增殖。上皮间质转化(EMT)是前列腺癌细胞获得转移能力的重要机制,表现为上皮细胞表型如Claudin-1蛋白表达降低,间质表型Vimentin蛋白表达升高,细胞黏附力下降,细胞转移能力增强[22-23]。低表达miR-148b-3p后,Claudin-1蛋白的表达增加,Vimentin蛋白的表达降低,PC-3细胞的EMT被抑制,迁移能力降低。
总之,本研究表明miR-148b-3p在前列腺癌细胞株中呈高表达,低表达miR-148b-3p可抑制前列腺癌PC-3细胞的增殖和迁移能力,作用机制可能为miR-148b-3p的低表达导致PTEN的表达抑制被解除,最终抑制前列腺癌细胞的增殖和迁移。
