剪切应力对晚期内皮祖细胞细胞骨架蛋白表达及分布的影响
2018-09-14黄厚今
张 怡,王 信,成 敏,黄厚今
(1.遵义医学院 公共卫生学院卫生毒理学教研室,贵州 遵义 563099;2.遵义医学院附属医院 骨科,贵州 遵义 563099;3.潍坊医学院 医学研究实验中心,山东 潍坊 261053)
动脉粥样硬化(atherosclerosis,AS) 等心脑血管疾病的发生往往是由于血管内皮损伤和修复失衡引起的[1]。而内皮祖细胞(EPCs) 在某些药物刺激、血管损伤以及缺血的情况下,能从骨髓动员至外周血,分化为成熟的内皮细胞,从而参与到血管内皮损伤的修复[2-3]。因此促进EPCs向内皮细胞分化,加速对受损血管内皮的修复是一种新的有效防治AS的重要策略。
本课题组前期研究表明,剪切应力(12 dyne/cm2)可有效促进EPCs分化,特别是作用3 h时,能显著上调内皮分化标志分子CD31、vWF mRNA的表达,加速颈动脉损伤模型大鼠受损内皮的修复[4]。并且在这一过程中细胞骨架蛋白起到了重要的信号转导作用,然而剪切应力是否直接调控EPCs细胞骨架蛋白的表达及分布,迄今未见报道。
1 材料与方法
1.1 材料与试剂 血管内皮生长因子(VEGF)及碱性成纤维细胞生长因子(bFGF)(Invitrogen);梯度离心液(Histopaque®-1083,Sigma);纤维粘连蛋白(fibronectin,Fn,Roche);M199(Gibco);胎牛血清(杭州四季青);Dil-ac-LDL(Molecular Probe);FITC-UEA-1 (Sigma);FAK的兔抗大鼠一抗(Abcam);talin及paxillin的小鼠抗大鼠一抗、HRP标记的羊抗兔IgG、β-action的兔抗大鼠单抗IgG和HRP标记的羊抗小鼠IgG (Santa cruz);多聚甲醛(天津科密欧);150~175 g雄性SD大鼠购自解放军第八十九医院实验动物中心。
1.2 实验仪器 超净台(AIRTECH,Haier);CO2孵箱和离心机(Heraeus);倒置荧光显微镜(DMI4000B,Leica);倒置相差显微镜(Olympus);流室系统装置包括蠕动泵及管道(Cole-parmer)、储液瓶及流槽(由四川大学华西医学院生物医学工程实验室提供);全波长酶标仪(BioTek);电泳仪(北京君意);半干转仪及湿转仪(Amersham biosciences)。
1.3 EPCs的分离、培养与鉴定 按本课题组建立的方法[5],采用梯度离心法分离大鼠骨髓单核细胞,用完全M199(含15%胎牛血清、1%双抗、10 ng/mL VEGF、5 ng/mL bFGF)制成细胞悬液,种植于FN打底的玻璃培养瓶,静置培养于5%CO2、37 ℃恒温孵箱,一周后换液。采用预热的PBS轻轻将未贴壁的细胞洗干净,换入新鲜预热的完全M199培养基。随后每隔3 d换一次完全培养基,待培养瓶底部铺满细胞时进行传代,在2代细胞长满瓶底约80%时进行细胞鉴定。在细胞培养液中加入10 μg/mL 的Dil-ac-LDL,避光孵育1 h后采用2%多聚甲醛固定15 min,再采用PBS浸洗,随后再避光加入10 μg/mL 的FITC-UEA-1孵育1 h,最后PBS浸洗干净后在倒置荧光显微镜下观察。
1.4 实验分组 实验分为两组:①剪切应力干预组:模拟生理状态下大动脉系统所受层流剪切应力大小,给予12 dyne/cm2的力学负荷[6],处理时间为3 h;②静止对照组:将细胞爬片放入同一细胞培养箱中,不加任何其他处理。
1.5 Western Blot检测FAK、paxillin和talin细胞骨架蛋白表达量 取剪切应力干预组和静止对照组细胞,提取总蛋白,BCA法测定蛋白浓度。取等量预处理的蛋白样品进行SDS-PAGE电泳。湿转(400 mA、2 h),一抗(1∶200)4 ℃孵育过夜,二抗(1∶500)室温孵育1 h, ECL显色,曝光。将胶片用扫描仪进行扫描,用Kodak Digital Science 1D定量条带灰度值,以自身β-action作为内参。
1.6 细胞免疫荧光实验 取剪切应力干预组和静止对照组爬片,用新鲜过滤的4%多聚甲醛室温固定20 min,0.05%吐温20室温破膜5 min×3次,封闭液(含10%羊血清、1%BSA)室温封闭30 min。FAK实验条件:一抗(1∶50)湿盒4 ℃过夜,PE标记羊抗兔IgG(1∶50)37 ℃避光孵育1 h。Talin及Paxillin实验条件:一抗(1∶40)湿盒4 ℃过夜,FITC标记羊抗小鼠IgG(1∶100)37 ℃避光孵育1 h。最后抗淬灭封片剂封片,荧光倒置显微镜下观察。

2 结果
2.1 EPCs的培养与鉴定 从大鼠骨髓中分离出来的单个核细胞呈圆形,1周内大多贴壁,逐渐开始伸展成梭形。2周开始形成细胞集落,中间有圆形细胞群,而周边则不断生成梭形细胞,生长为集簇样结构(见图1A)。3周左右,细胞可铺满瓶底的80%,此时多以梭形细胞为主,也有少量多角形细胞(见图1B)。细胞进行FITC-UEA-1(见图1C)及Dil-ac-LDL(见图1D)染色鉴定,(89.3±6.2)%的细胞为双染阳性(见图1E)。
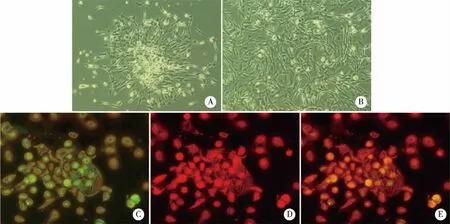
A:培养2周后的细胞集落;B:第3周细胞形态;C-E:同一视野下双吞噬的EPCs。

**:shear stress干预组与static对照组相比较,P<0.01。
2.3 流体剪切应力对FAK、talin和paxillin细胞骨架蛋白胞内分布的影响 静止状态时,FAK、talin和paxillin三种细胞骨架蛋白表达丰富,散在分布于胞浆中。12 dyne/cm2剪切应力作用3 h以后,talin和paxillin蛋白的荧光强度变弱,但FAK的荧光强度增强,沿剪切应力作用方向聚集成束状延伸至细胞边缘(见图3)。
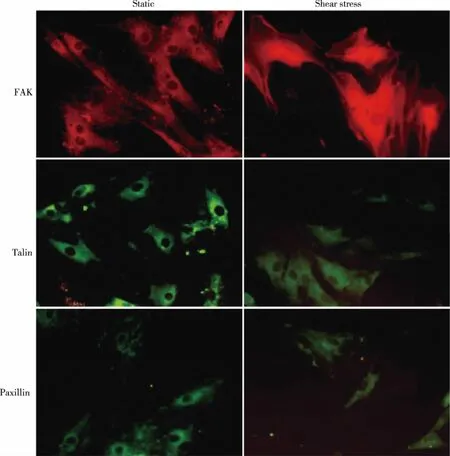
图3 剪切应力对FAK,talin和 paxillin在EPCs内分布的影响(×400)
3 讨论
鉴于EPC具有修复内皮损伤的功能,找到理想的方法上调其活性,对于以EPC为基础的细胞疗法修复AS等疾病的内皮损伤意义重大。目前国内外多关注于采用功能基因转染、生长因子VEGF等刺激以及药物干预等方法[7-8],增强EPCs的功能活性,但由此产生的药物价格高昂,并且副作用较大,使得临床应用受到一定的限制。
由于内皮祖细胞在体内所处的特殊位置,很明显它还受到流体力学因素的影响。中山大学陶军课题组就曾经提出“体外切应力处理及通过运动提高在体血流切应力,可作为增强EPC修复内皮损伤的重要手段”[9]。Yamamoto等[10]的研究也表明,组织液或血液流动产生的切应力可加速EPC的分化和增殖,从而促进毛细血管管腔样结构的形成。但剪切应力这种“力学刺激”是如何调控EPC分化的,即其跨膜的信号转导途径尚不十分明确。
细胞对外力的应答,涉及到复杂的信号转导过程。在此过程中,切应力这种胞外力学的物理信号首先需要被转化成化学信号,继而开启后续的胞内信号转导途径。FAK、talin及paxillin是ECM-整合素-CSK系统中很重要的信号分子,黏着斑激酶(FAK)集中了ECM信号和可溶性细胞因子信号,是其重要的交汇点,且其是一种非受体型酪氨酸激酶,在整合素、细胞骨架和细胞因子受体信号的链接中发挥着非常重要的作用[11]。整合素介导的细胞黏附和细胞因子受体的刺激均可以激活黏着斑激酶,继而调控细胞增生、存活、分化、移行以及细胞骨架的重组[12]。有实验结果证实,剪切应力可以通过PI3K介导的细胞内信号转导途径对内皮祖细胞产生作用[13],而来自其他细胞模型的研究表明,PI3K的激活需要FAK的活化[14]。FAK的激活又依赖于粘着斑的形成,而粘着斑蛋白包括两组:调节蛋白(paxillin等)和结构蛋白(talin等)[15]。本实验在剪切应力促使EPC向内皮分化的过程中,观察到FAK、talin和paxillin蛋白表达量发生变化,且FAK蛋白的表达位置也发生改变,实验提示,FAK引导的信号途径与EPC内皮分化紧密相连。故将FAK作为内皮损伤的治疗靶点也将存在巨大潜力。
本课题揭示12 dyne/cm2的剪切应力可以促进大鼠骨髓来源的EPCs向内皮分化,且在此过程中,FAK、talin和paxillin三个蛋白的表达量和表达位置有所改变。据此提出,细胞骨架蛋白FAK、paxillin和talin很可能是内皮祖细胞感知细胞外的力学信号并将其转化为细胞内的生物化学信号的桥梁,剪切应力有可能就是通过该桥梁从而实现跨膜的信号转导,调控EPCs分化。此为EPC应用于临床及血管损伤的修复提供了新的实验依据,但其详细机制尚需进一步探索。
