鹅去氧胆酸对小鼠肝灌流及原代肝细胞胆汁酸代谢通路相关基因表达的影响
2018-09-14鲁艳柳杨艳萍杜艺玫何芋岐陆远富
鲁艳柳,杨艳萍,杜艺玫,何芋岐,陆远富
(1.遵义医学院 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099;2.遵义医学院 药学院药学实验室,贵州 遵义 563099)
胆汁酸是胆汁的主要成分,能够促进肠道对脂类和维生素的吸收,同时也是调节营养平衡与能量消耗的关键信号分子[1-2],与肝脏、肠道和心脏系统的多种疾病密切相关[3],因此,对胆汁酸代谢通路影响的研究备受关注。胆汁酸主要在肝脏中,由CYP7A1、CYP8B1和CYP27A1等酶催化胆固醇生成[4-5],通过胆盐输出泵(bile salt export pump,BSEP)、多药耐药性相关蛋白2(multidrug resistance-associated protein 2,MRP2)从肝细胞内泵入胆小管[6],汇入并储存于胆囊。当受到刺激后,胆汁酸被排入十二指肠,在回肠通过胆汁酸转运体(apical sodium-bile acid transporter,ASBT)主动重吸收,进入小肠黏膜细胞,之后再由胆酸转运蛋白(organic solute transporter α/β,OSTα/β)、牛磺胆酸钠协同转运肽(Na+-taurocholate cotransporting polypeptide,NTCP)和有机阴离子转运肽(organic-anion-transporting polypeptide,OATP),重新摄入肝细胞参与形成胆汁,完成肝肠循环[7]。胆汁酸的合成与转运,均受到核受体法尼基衍生物X受体(farnesoid X receptor,FXR)的调控,而其本身又是FXR的配体[8-10]。
鹅去氧胆酸(chenodeoxycholic acid,CDCA)是已知的最丰富的亲水性初级胆汁酸[11],也被认为是激动FXR活性最好的配体[12]。目前,研究CDCA对胆汁酸通路作用的报道已成为热点,但主要局限于体外细胞模型上的研究,对整体动物的作用研究较少[13],而在离体肝灌流模型上的作用尚未见报道。因此,本研究将建立小鼠原代肝细胞和离体肝灌流的模型,结合整体动物实验,通过比较Cyp7a1、Cyp8b1、Fxr、Shp、Bsep、Ostβ等基因表达的水平,探讨比较CDCA对胆汁酸代谢通路的影响,为其进一步开发与研究提供参考。
1 材料与方法
1.1 药物与试剂 鹅去氧胆酸(CDCA,批号:120316),购自长沙昂诺生物科技有限公司,质量分数≥98%。D-HANK'S液、HANK'S液、氢链霉素混合液、鼠尾胶原、胎牛血清购自北京索莱宝科技有限公司;胰岛素、地塞米松、乙二胺四乙酸(EDTA)购自美国Sigma公司;Ⅳ型胶原酶购自美国Gibco公司。逆转录试剂盒购自宝日医生物技术有限公司;SYBR Green Supermix购自美国Bio-rad公司。应用Primer 5.0软件设计实时定量PCR引物,由上海捷瑞生物工程有限公司代为合成。其余试剂均购自成都科龙化工试剂厂。
1.2 仪器 JJ-CJ-2F超净工作台(苏州市金净净化设备科技有限公司);IX53+DP26倒置显微镜(日本Olympus公司);371高压灭菌二氧化碳培养箱(美国Thermo公司);BT100-2J 蠕动泵(重庆杰恒蠕动泵有限公司);Sc-3610低速离心机(安徽中科中佳科学仪器有限公司);FA2004N电子天平(上海菁海仪器有限公司);Y10型超细匀浆机(上海翼控机电有限公司);NANO DROP 2000超微量分光光度计(美国Thermo公司);VICTOR3 V型多功能酶标仪(美国Perkin Elmer公司);Dura 12型超纯水机[泽拉布仪器科技(上海)有限公司];逆转录用多功能PCR仪(德国Eppendorf公司);实时定量PCR仪(美国Bio-rad公司);-80 ℃超低温冰箱(中国海尔公司)。
1.3 实验动物 SPF级C57BL/6J雄性小鼠,体重20~24 g,由北京华阜康生物科技股份有限公司提供(许可证号:SCXK[京]2014-0004),自由进食及饮水,湿度50%~60%,室温约22 ℃,适应性喂养1周后进行实验。
1.4 实验方法
1.4.1 小鼠原代肝细胞的提取与培养 采用改良的Seglen胶原酶原位两步灌流法[14]提取小鼠原代肝细胞,灌流液I为含有0.02%EDTA的D-HANK'S液,灌流液II为含有0.05%IV型胶原酶的 HANK'S溶液。灌流结束后,依次以100×g、80×g、50×g离心3 min进行纯化,以台盼蓝拒染法检查细胞存活率[15],取存活率在90%以上的细胞用于下一步实验。获得的原代肝细胞,以1×106个/孔的细胞密度,接种在包被有鼠尾胶原的6孔培养板内。在5% CO2、37 ℃的孵箱中培养4 h后,将培养基吸出,洗去死细胞和未贴壁细胞,更换培养基,继续培养至24 h[16]。
1.4.2 小鼠离体肝灌流模型制备 建立一过型离体肝灌流模型。腹腔注射水合氯醛(20 g/0.15 mL)麻醉小鼠,暴露下腔静脉及门静脉,门静脉插管并固定。用37 ℃生理盐水进行快速灌注至肝脏膨胀时,剪断下腔静脉,待肝脏残血冲洗干净后,更换正式灌流液。
1.4.3 分组及给药 精密称取CDCA 39.26 mg,以1 mL DMSO溶解,微孔滤膜过滤,制得100 mmol/L CDCA的储备液。取储备液7 μL,加培养基补足至7 mL,制得含100 μmol/L CDCA的培养基,备用。取出培养的原代肝细胞,分为空白组(Control)和CDCA组(CDCA),吸除原培养基,PBS清洗,再分别加入不含药的培养基和含药培养基,置孵箱中继续培养24 h。每组3孔,重复6次。
取100 mmol/L CDCA储备液0.5 mL,以生理盐水定容至500 mL,制得含100 μmol/L CDCA的灌流液,备用。设空白组(Control)和CDCA组(CDCA),每组6只,分别用不含药的灌流液和含药的灌流液进行小鼠离体肝灌流。灌流液37 ℃预温,灌注60 min(流速约为0.5 mL/min),取肝脏去胆囊,液氮速冻后,-80 ℃冰箱保存。
小鼠随机分为空白组和CDCA组,每组6只,分别灌胃给予空白溶剂和CDCA(50 mg/kg,0.1%羧甲基纤维素钠助悬)7 d,取肝脏去胆囊,液氮速冻后,-80 ℃冰箱保存。
1.4.4 胆汁酸代谢相关基因mRNA表达水平检测 将培养的原代肝细胞置于冰上,弃去培养基,PBS洗2次,每孔加1 mL 4 ℃的Trizol,刮下细胞,加入200 μL氯仿,混合均匀,室温孵育10 min,4 ℃12 000 rpm离心10 min。上清液用500 μL异丙醇沉淀RNA。75%乙醇(DEPC水配制)洗涤沉淀,离心,沉淀在室温下挥干后,加DEPC水复溶,超微量分光光度计检测RNA浓度及质量。
称取肝脏约20 mg,在1 mL Trizol中解冻,冰上匀浆,室温孵育5 min,加入200 μL氯仿,混合均匀,室温孵育10 min,4 ℃12 000 rpm离心10 min。上清液用500 μL异丙醇沉淀RNA。75%乙醇(DEPC水配制)洗涤沉淀,离心,沉淀在室温下挥干后,加DEPC水复溶,超微量分光光度计检测RNA浓度及质量。
RNA经逆转录试剂盒反转录为cDNA,逆转录条件:25 ℃预热10 min,37 ℃逆转录2 h,85 ℃加热5 min逆转录酶失活。cDNA用于实时荧光定量PCR分析,引物序列如表1所示。扩增条件:95 ℃预变性3 min,95 ℃变性10 s,60 ℃延伸45 s,共40个循环。结果以Gapdh表达值为内参进行校正。

表1 RT-PCR引物序列

2 结果
2.1 CDCA对胆汁酸合成基因的影响 CDCA对胆汁酸合成基因的影响,在不同模型上存在着明显差异。如图1所示,相对于空白对照组,CDCA作用于原代肝细胞,能够抑制Cyp7a1、Cyp8b1的基因表达(P<0.05),而作用于离体肝灌流模型和整体实验动物时,Cyp7a1、Cyp8b1的基因表达均无统计学意义(P>0.05)。
2.2 CDCA对胆汁酸转运基因的影响 CDCA对胆汁酸转运基因的影响,在不同模型上同样存在着明显差异。如图2所示,相对于空白对照组,CDCA作用于原代肝细胞,能够抑制Bsep的基因表达(P<0.05),同时诱导Ostβ的基因表达(P<0.05)。相对于空白对照组,CDCA作用于离体肝灌流模型时,能诱导Ostβ的基因表达(P<0.05),而作用于整体实验动物时,抑制Bsep的基因表达(P<0.05)。
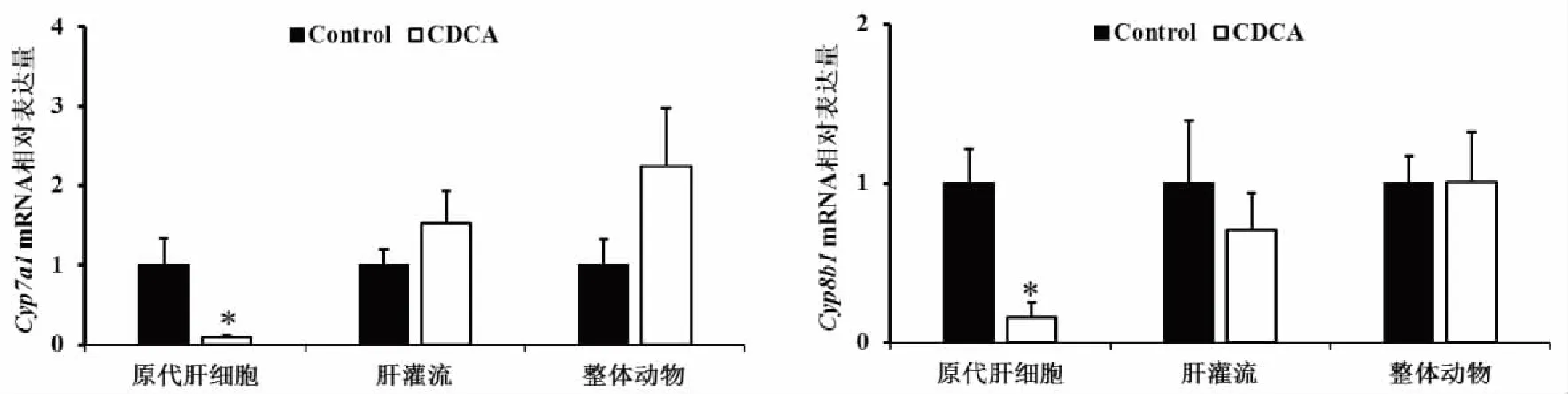
*:与空白组比较,P<0.05;n=6。
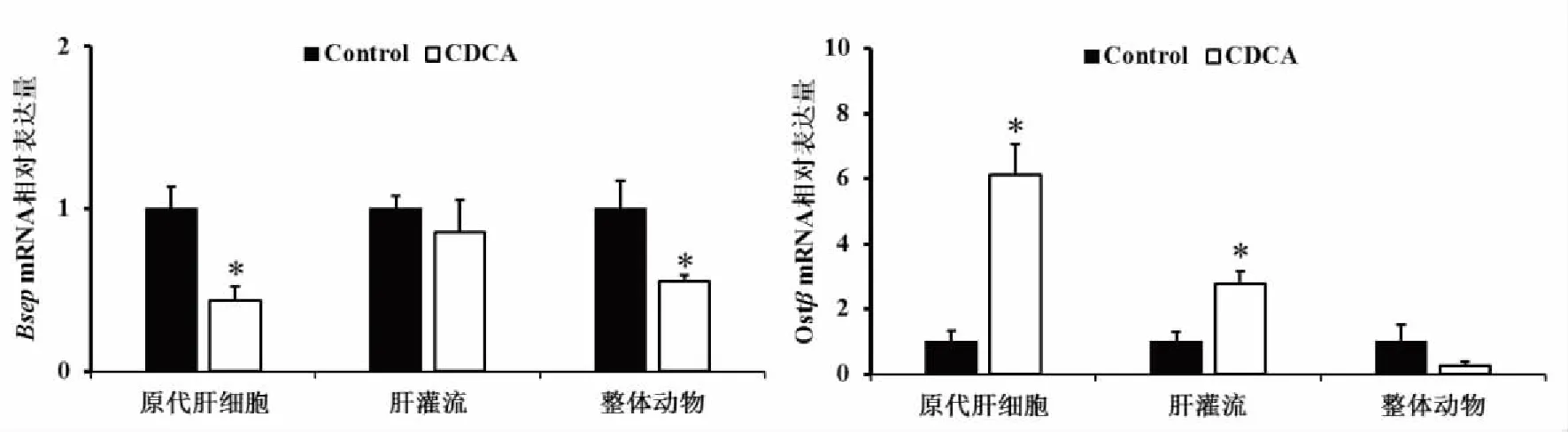
*:与空白组比较,P<0.05;n=6。
2.3 CDCA对胆汁酸代谢调控基因的影响 CDCA对胆汁酸代谢调控基因的影响,在不同模型上也存在着明显差异。如图3所示,相对于空白对照组,CDCA作用于原代肝细胞,能够诱导Shp的基因表达(P<0.05),对Fxr的基因表达影响无统计学意义(P>0.05)。相对于空白对照组,CDCA作用于离体肝灌流模型和整体实验动物时,对Fxr、Shp基因表达的影响均无统计学意义(P>0.05)。

*:与空白组比较,P<0.05;n=6。
3 讨论
根据文献[17],选择小鼠灌胃CDCA的剂量为50 mg/kg,即每只小鼠约给予1.0 mg的CDCA,由此折算出灌流液浓度约为100 μmol/L,因此确定原代肝细胞的给药浓度亦为100 μmol/L。
由原代肝细胞的实验结果可知,虽然CDCA对Fxr基因表达的影响不显著,但是对其靶基因Shp的表达呈现上调作用(P<0.05),进而明显抑制胆汁酸重要合成基因Cyp7a1、Cyp8b1的表达(P<0.05),提示能够减少胆汁酸合成。同时,诱导Ostβ的基因表达(P<0.05),提示能够促进胆汁酸的外排。虽然CDCA抑制Bsep的基因表达(P<0.05),但不意味着在蛋白水平也会有抑制作用,有文献报道,胆汁酸对BSEP基因和蛋白表达的调控存在不一致[18]。因此,本实验验证了在体外原代肝细胞模型中,CDCA能够调节胆汁酸代谢通路。
同等剂量下,CDCA经肝灌流给药后,能显著诱导Ostβ的基因表达(P<0.05),提示能够促进肝细胞排出多余的胆汁酸,与细胞实验结果一致,但对其它基因的影响均不明显。同样,由整体动物实验结果可知,CDCA对Bsep基因的表达产生明显抑制(P<0.05),与细胞实验结果一致,但对其它基因的影响不明显。综上可知,在原代肝细胞中CDCA对胆汁酸代谢通路的调节作用明显,而在离体肝灌流和整体动物实验中,CDCA对胆汁酸代谢通路的调节作用仅表现在对胆汁酸转运体基因表达的影响。分析造成这种差异的原因,可能是在整体动物和离体肝灌流模型中,转运CDCA及其它胆汁酸的能力较强,可以将CDCA及其它胆汁酸转至胆管内或其它组织脏器。而在原代肝细胞模型中,虽然CDCA能通过诱导转运基因的表达,促进肝细胞中胆汁酸的外排,但排出的胆汁酸仍然存在于体系中,持续刺激肝细胞,进而造成CDCA对胆汁酸代谢通路的调节作用,相对于整体动物和离体肝灌流模型,产生差异明显。
由实验结果可知,在肝灌流及原代肝细胞中,CDCA对胆汁酸代谢通路的影响不同,在离体肝灌流模型与整体动物上的影响较一致。所以,在CDCA进一步的开发与研究中,不能仅仅局限于体外细胞模型,而需要在整体动物上进行验证。
