果胶酶处理对甜玉米芯 可溶性糖含量的影响
2018-09-13黎晨晨吴媛媛谢静南马永强
王 鑫,黎晨晨,吴媛媛,谢静南,马永强
(哈尔滨商业大学,食品工程学院省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
甜玉米又被称为蔬菜玉米,为禾本科,玉米属,因其营养丰富,味道香甜、鲜脆爽嫩,含大量人体所必需的氨基酸、蛋白质、糖类以及维生素而受到消费者的青睐[1]。玉米芯是指玉米果穗脱去子粒后剩余的部分,又称玉米穗轴,一般可占玉米穗20%~30%左右[2],玉米芯除了小部分用作糠醛[3]、发酵底料、木糖醇[4]等产品的原料外,大部分作为农家燃料被烧掉,对甜玉米芯的利用更是微乎其微,造成很大的浪费,现阶段玉米芯多用于制糖。其中的果胶质(C6H16O5)n广泛存在于高等植物中,其直链状,由D-半乳糖醛酸以α-1,4-糖苷键连接而成,是植物细胞质的组成物质,能够促使邻近的细胞壁相连[5]。主要包括原果胶(Protopectin)、果胶酸(Pectic acid)、果胶酯酸(Pectinic acid)、果胶(Pectin)。果胶酶是指能够催化果胶质分解的多种酶的总称[6],通过裂解或消去作用切断果胶质中的糖苷键,使果胶质裂解为多聚半乳糖醛酸。果胶的水解度即果胶水解后得到的D-半乳糖醛酸的含量与水解前甜玉米芯中果胶含量的比值。水解是木质纤维素资源开发利用的关键步骤之一[7-8],按其过程可分为酸水解和酶水解两种。
目前关于玉米芯可溶性糖提取的研究常见的预处理方法有物理机械法、碱法、酸法、酶法以及蒸汽爆破法,使甜玉米芯内部结构变得疏松、削弱木质纤维素的结构。黄仁亮等[9]采用氨水方法进行玉米芯的预处理,但结果仅有部分的木质素溶在氨水中,效果并不好;郭长慧等[10]采用稀酸-蒸煮预处理,木糖得率较高,说明能很好地破坏木质素-纤维素结构,使其变得疏松,有利于提取。王琼等[11]用高温液态水预处理与超马来酸水解相结合的方法提高了玉米芯的水解率。Bender等[12]认为,蒸汽喷爆法是从植物原料中提取半纤维素的最佳方法,而目前关于玉米芯可溶性糖含量的研究较少。
本实验以酸处理玉米芯对其内部结构进行了破坏,并结合果胶酶处理进一步提高总可溶性糖的产率。探讨甜玉米芯经酸预处理后的果胶酶最佳处理条件,对甜玉米芯具有一定的实际价值与意义。
1 材料与方法
1.1 材料与仪器
美国脆王甜玉米 黑龙江盛昌农产品加工有限公司;D-半乳糖醛酸 色谱纯,日本和光纯药工业株式会社;3,5-二硝基水杨酸 化学纯,河南致胜化工有限公司;果胶酶 苏柯汉生物制剂有限公司;果胶粉 三门峡富元果胶工业有限公司;浓硫酸、葡萄糖 中国医药上海化学试剂公司;硫代硫酸钠 天津市巴斯夫化工有限公司;硼酸、石油醚 天津市天新精细化工开发中心;柠檬酸、柠檬酸钠 哈尔滨市新春化工厂;蒽酮 济南中泽化工有限公司;碘化钾 天津市大茂化学试剂厂,均为分析纯;DNS试剂 实验室自制。
DHG-9123A型电热恒温鼓风干燥箱 上海一恒科技有限公司;TGL-16G-B型台式高速离心机 闽南星科科学仪器有限公司;H198/28型pH计测试笔 北京海星顺达经销公司;HYP-1008型消化炉 上海纤检仪器有限公司;721E型紫外可见分光光度计 上海光谱仪器有限公司;TGL-16G-B型离心机 星科离心机;FW177型中草药粉碎机 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 甜玉米芯的预处理 将甜玉米芯切割成边长为1.5~2.0 cm方块状,60 ℃干燥后粉粹过120目筛,得到甜玉米芯粉未进行后续实验。
1.2.2 果胶含量的测定 果胶的含量采用重量法进行测定[14]。准确称取2.50 g粉碎后甜玉米芯粉于100 mL的烧杯中,加入30 mL,2% Na2CO3溶液(用0.16% NaOH为溶剂进行配制),于50 ℃的恒温水浴锅中水浴加热20 min,水浴过程中不断搅拌,水浴结束后放入离心机,以5000 r/min的转速离心20 min,分离上清液,将上清液倒入烧杯中,再往有沉淀的离心管中加入10 mL蒸馏水,混匀并再次离心,条件同上,重复2次,将全部上清液合并到烧杯中,进行果胶酸沉淀。向盛有上清液的烧杯中加入1 mL冰醋酸酸化溶液,再加入2 mL的25% CaCl2溶液,混匀,放置电炉上加热至沸腾并不断搅拌,沸腾后取下溶液冷却至室温,10 min后,以5000 r/min的转速离心20 min,倒掉上清液收集沉淀,将沉淀用10 mL的0.1%醋酸冲洗并再次离心(同上),反复5次。将所得到的沉淀放入烘干箱中烘干(105 ℃)至恒重,称量,同时作3组平行样品测定,计算果胶含量。
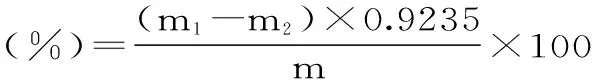
式(1)
式中:m1-果胶酸钙及培养皿的质量(g);m-甜玉米芯的质量(g);m2-培养皿的质量(g);0.9235-由果胶酸钙换算为果胶的系数。
1.2.3 果胶酶酶活的测定 按照《果胶酶制剂酶活测定》(QB 1502-1992)进行测定[15]。
1.2.4 甜玉米芯处理液的制备 称取甜玉米芯粉末5.00 g于250 mL碘量瓶中,加入蒸馏水150 mL,5 mol/L盐酸100 mL,于110 ℃水浴下提取35 min,进行酸水解,冷却至室温,备用。
1.2.5 单因素实验
1.2.5.1 添加量对果胶水解度的影响 分别取9 mL pH3.5的甜玉米芯处理液至试管中,向其加入50、63、76、89、102、115 U/g的果胶酶液在50 ℃水浴120 min后10 min灭酶,冷却、离心(3000 r/min,5 min),测定溶液中D-半乳糖醛酸的含量,计算果胶水解度。
1.2.5.2 温度对果胶水解度的影响 分别取9 mL pH3.5的甜玉米芯处理液至试管中,加入量为89 U/g的果胶酶,在45、50、55、60、65、70 ℃中处理120 min后10 min灭酶,冷却、离心(3000 r/min,5 min),测定溶液中D-半乳糖醛酸的含量,计算果胶水解度。
1.2.5.3 pH对果胶酶水解度的影响 分别取9 mL pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0甜玉米芯处理液至试管中,果胶酶的添加量为89 U/g,在50 ℃中处理120 min后10 min灭酶,冷却、离心(3000 r/min,5 min),测定溶液中D-半乳糖醛酸的含量,计算果胶水解度。
1.2.5.4 处理时间对果胶酶水解度的影响 分别取9 mL pH3.5的甜玉米芯处理液至试管中,添加果胶酶,在50 ℃水浴中分别处理30、60、90、120、150、180 min,10 min灭酶后,冷却、离心(3000 r/min,5 min),测定溶液中D-半乳糖醛酸的含量,计算果胶水解度。
1.2.5.5 果胶水解度测定方法 以3,5-二硝基水杨酸(DNS)法[13]测定的D-半乳糖醛酸量记为m1(mg),得到的回归方程为y=0.5414x-0.072,R2=0.9991。采用重量法[14]测定的果胶量记为A(%),计算一定量玉米芯m2(g)中的果胶水解度。
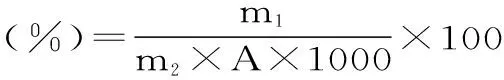
式(2)
1.2.6 响应曲面优化试验 根据果胶酶处理甜玉米芯的单因素实验结果,选择主要因素和适宜的水平进行响应面实验设计[12],见表1。

表1 Box-Behnken实验设计因素水平及编码Table 1 Factor levels and coding of Box-Behnken experimental design
1.2.7 果胶酶处理前后可溶性糖含量的测定
1.2.7.1 未用果胶酶处理甜玉米芯其可溶性糖含量的测定 称取经过预处理的甜玉米芯0.50 g于50 mL三角瓶中,加水15 mL,5 mol/L盐酸10 mL后在110 ℃条件下蒸煮处理一定的时间,冷却后用35% NaOH溶液中和,然后用蒸馏水定容至100 mL,过滤,取滤液10 mL,再用蒸馏水定容100 mL,成稀释1000倍的总糖水解液。以葡萄糖为标准品,用蒽酮比色法测量吸光度值,得到的标准曲线回归方程为y=0.2857x+0.0086,R2=0.9954,由公式(3)计算总可溶性糖的含量,作3组平行样品测定。
式(3)
式中:m1-蒸煮后溶液中可溶性糖的含量(mg);m2-称取的甜玉米芯的质量(g)。
1.2.7.2 果胶酶法处理甜玉米芯其可溶性糖含量的测定 称取经过预处理的甜玉米芯0.50 g于50 mL三角瓶中,加水15 mL,5 mol/L盐酸10 mL后在110 ℃条件下蒸煮处理一定的时间,冷却后,吸取9 mL pH=5.0的甜玉米芯处理液至比色管中,向其加入89 U/g的果胶酶液1 mL,在60 ℃水浴锅中水浴90 min后于沸水中灭酶10 min,冷却至室温,再用冷却后用35% NaOH溶液中和,然后用蒸馏水定容至100 mL,过滤,取滤液10 mL,再用蒸馏水定容100 mL,成稀释1000倍的总糖水解液,用蒽酮比色法测量吸光度值,由公式(4)计算总可溶性糖的含量。作3组平行样品测定[8]。
式(4)
式中:m3-果胶酶处理后溶液中总可溶性糖的含量(g);m4-甜玉米芯的质量(g)。
1.3 数据处理
2 结果与分析
2.1 果胶含量及果胶酶活力的测定
由平行实验数据可知,甜玉米芯中的果胶含量为3.69%±0.78%,酶活为(5940.75±198.03) U/g。
2.2 单因素实验
2.2.1 酶添加量对甜玉米芯果胶水解度的影响 从图1看出,酶添加量为50~89 U/g时,随着酶添加量的增加,D-半乳糖醛酸溶出量也随之增加,但由于底物的浓度不变,当酶添加量提高到89 U/g之后,D-半乳糖醛酸溶出量呈下降趋势。这可能是由于过低的酶添加量使果胶分解不完全,而过高的酶添加量使溶液中的半纤维素含量升高,粘度增大,从而使D-半乳糖醛酸溶出,传质过程减慢,导致溶出量的下降[17-18]。所以酶添加量在89 U/g左右比较适宜。

图1 酶添加量对甜玉米芯果胶水解度的影响Fig.1 Effect of enzyme addition on pectin hydrolysis degree of sweet corncob
2.2.2 温度对甜玉米芯果胶水解度的影响 从图2看出,在45~60 ℃之间,随着温度的升高,D-半乳糖醛酸随着增加,温度达到60 ℃后,D-半乳糖醛酸反而降低。可能是由于果胶酶酶结构遭到破坏,影响其水解效果;温度过低时,果胶酶酶活受抑制,水解不充分[19],同时,当温度超过65 ℃时可能使果胶酶失活,而且可能会引起果胶絮凝沉淀,所以湿度为60 ℃较适合。
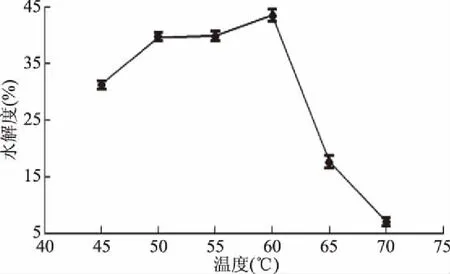
图2 温度对甜玉米芯果胶水解度的影响Fig.2 Effect of temperature on pectin hydrolysis degree of sweet corncob
2.2.3 pH对甜玉米芯果胶水解度的影响 从图3中所知,果胶酶在3.5~5.5的pH范围内,酶分子具有较高活性,且不溶性果胶能够最大限度的分解。过高或者过低,可能是对果胶的稳定性会产生一定的影响[19],所以选择pH为5.0时为适宜。
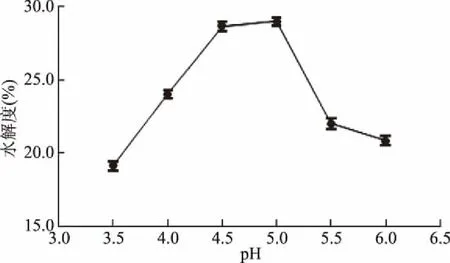
图3 pH对甜玉米芯果胶水解度的影响Fig.3 Effect of pH on pectin hydrolysis degree of sweet corncob
2.2.4 时间对甜玉米芯果胶水解度的影响 由图4可知,时间与果胶酶水解效果呈同步上升趋势,在时间达到90 min时,果胶酶水解充分,之后趋于稳定状态。由于处理液底物不变,酶添加量不变,理论上时间延长,产物得率应趋于平衡状态,但是在试验过程中,当时间越长,D-半乳糖醛酸的量呈缓慢下降趋势,参考杨书艳等[20]采用酸法提取玉米芯的预处理试验,可知酶解时间越长,酶活降低越快[21],D-半乳糖醛酸还原,90 min后果胶的水解度变化不大,所以果胶酶的水解时间设定为90 min。
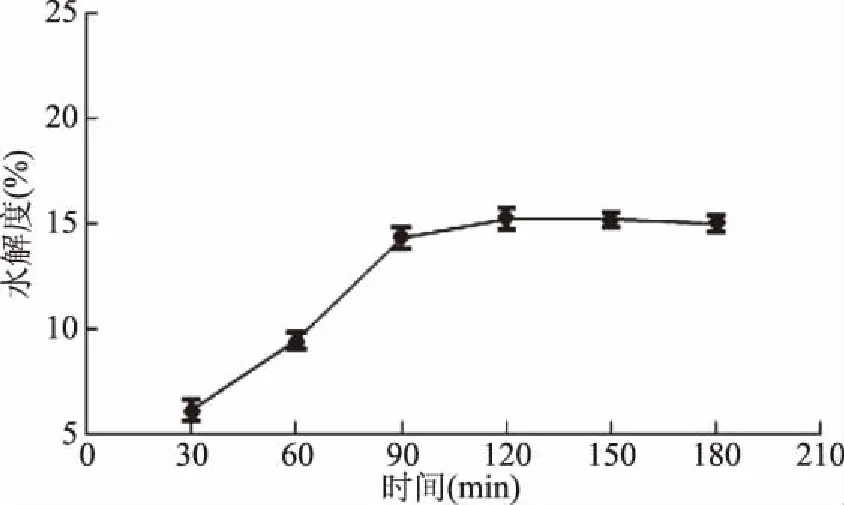
图4 时间对甜玉米芯果胶水解度的影响Fig.4 Effect of time on pectin hydrolysis degree of sweet corncob
2.3 响应曲面优化试验
依据Design Expert软件设计的29组方案进行试验,结果见表2。经数据分析得到果胶水解度的多元二次回归方程模型为:
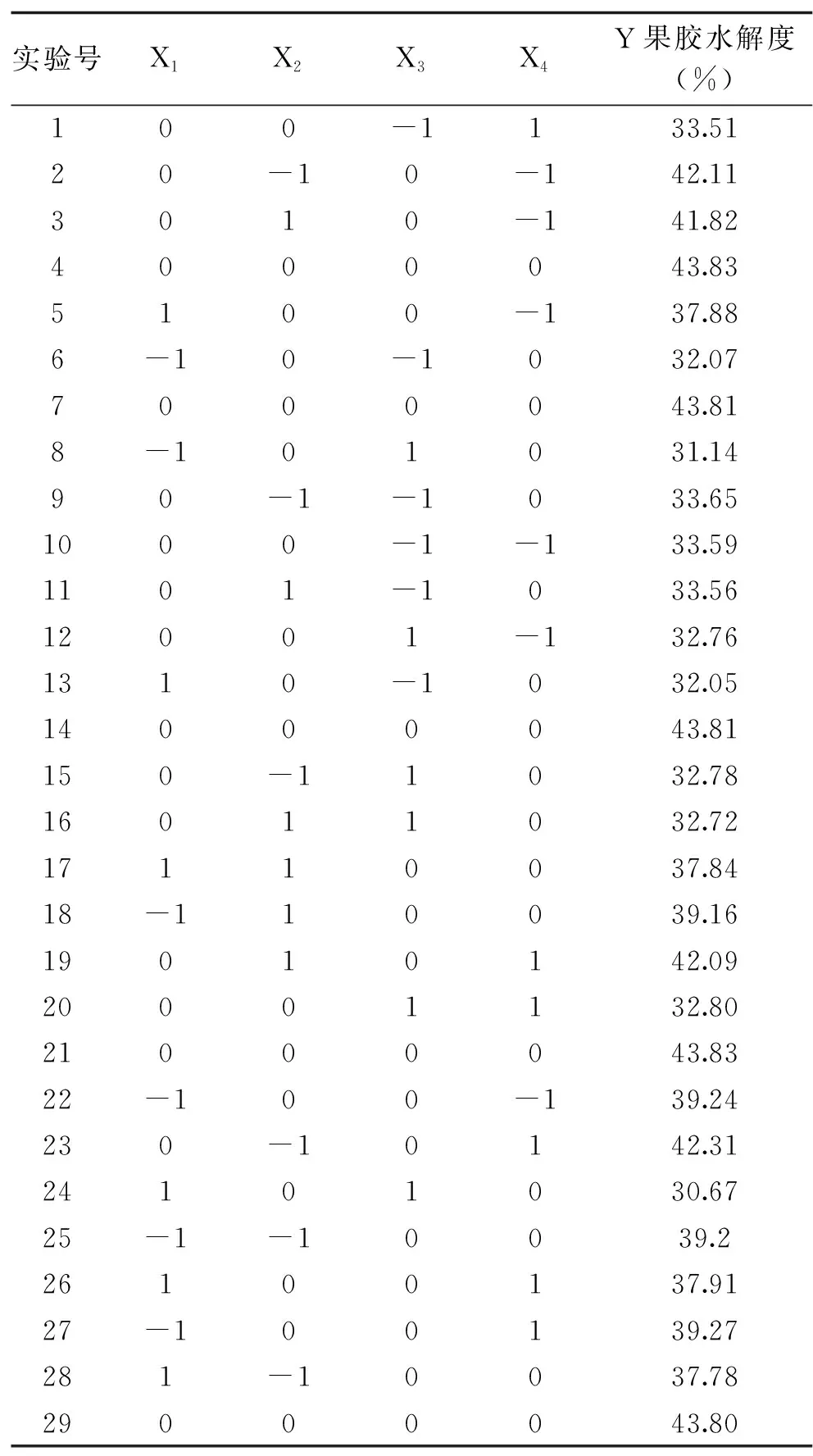
表2 实验设计与结果表Table 2 Experimental design and results

表3 响应面模型方差分析表Table 3 Response surface model variance analysis

表4 回归方程系数显著性检验Table 4 Significance test of regression equation
2.4 响应曲面分析
响应曲面图和等高线图可以直观地反映出各因素之间的交互作用,从而确定其对响应值的影响。曲面越呈现陡峭,表明该因素对相应值的影响越显著[22]。由图5~图10可知,加酶量、温度、pH、时间对果胶水解度的交互影响效应,曲面呈现山丘状有最佳值,均存在极值。等高线呈椭圆形,且椭圆的轴线与坐标轴之间的有较大的角度,各因素之间有一定的交互作用但不显著,所以优化方程时可去除相应交互项[23]。从三维空间点到底面的投影可得到椭圆形等高线图,试验最优条件处在圆心处。在酶添加量87.98 U/g,温度为59.80 ℃时,酶解时间为98.87 min,pH为4.99时,陡峭程度高,达到最高点[24-26]。经过响应曲面优化试验,得理论上水解度达最大值的条件:酶添加量87.98 U/g,酶解温度59.80 ℃,pH4.99,酶解时间98.87 min,此时果胶水解度的预测值为43.84%±0.01%。

图5 酶添加量和温度对果胶水解度的等高线图和响应曲面Fig.5 Interactive effect between enzyme addition and temperature on pectin hydrolysis degree
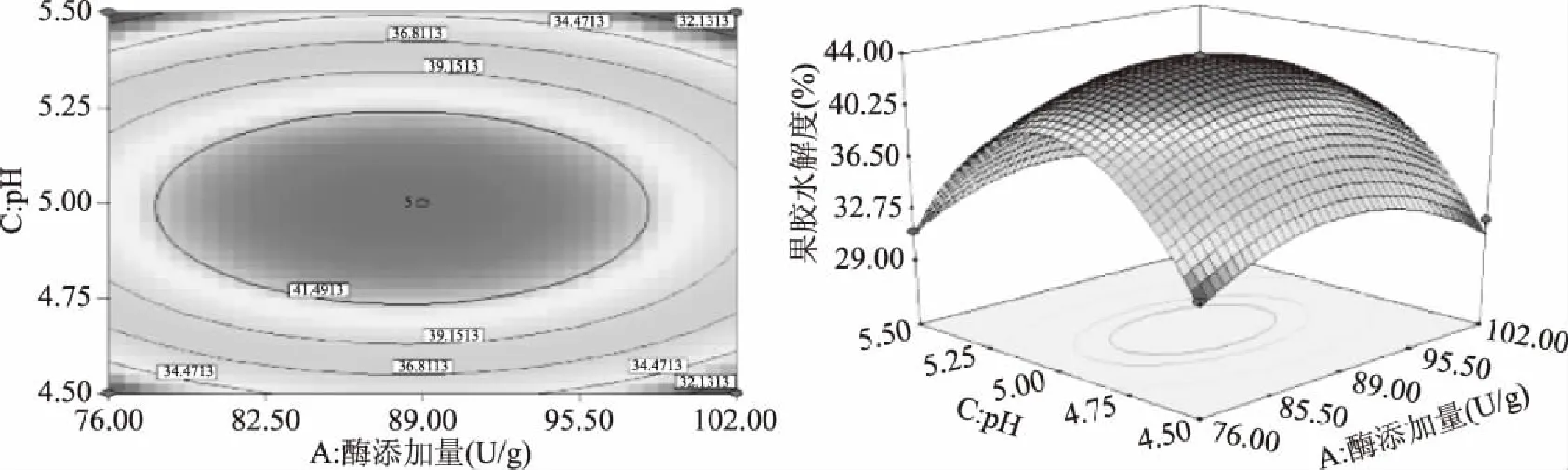
图6 酶添加量和pH对果胶水解度的等高线图和响应曲面Fig.6 Interactive effect between enzyme addition and pH on pectin hydrolysis degree
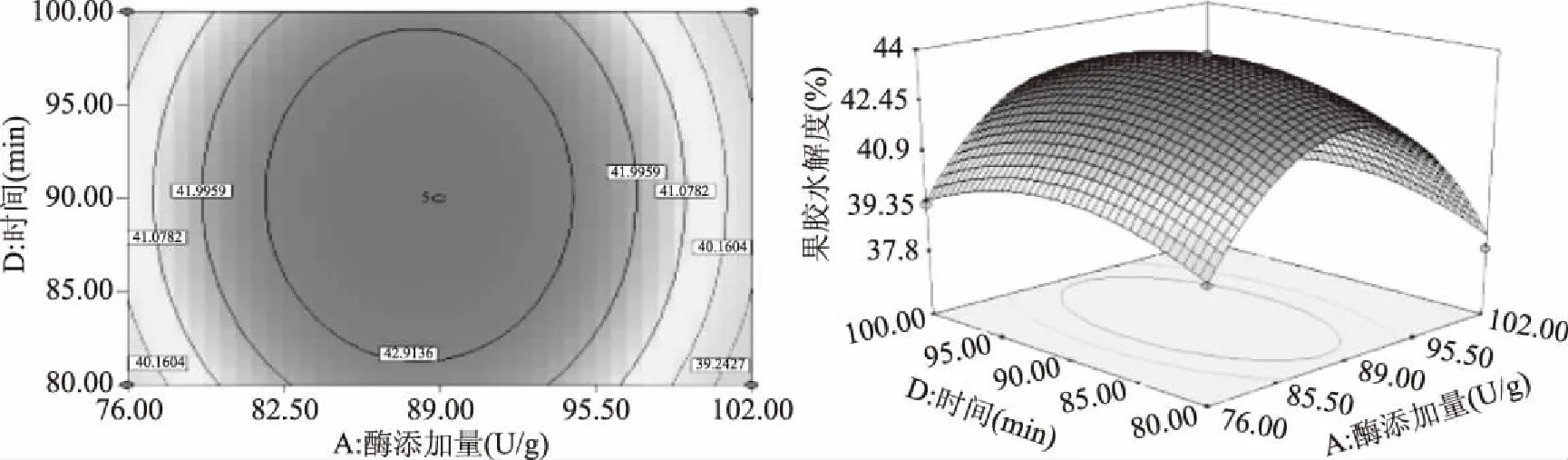
图7 酶添加量和时间对果胶水解度的等高线图和响应曲面Fig.7 Interactive effect between enzyme addition and time on pectin hydrolysis degree
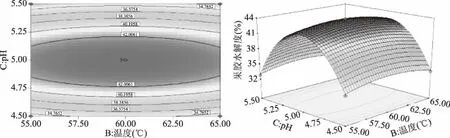
图8 温度和pH对果胶水解度的等高线图和响应曲面Fig.8 Interactive effect between temperature and pH on pectin hydrolysis degree
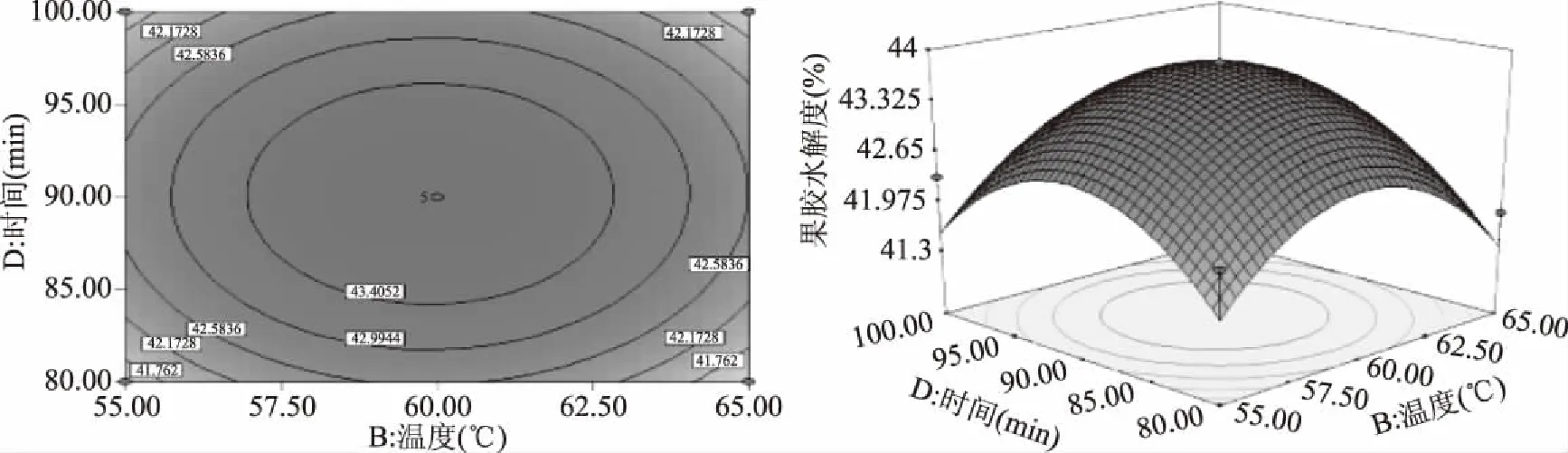
图9 温度和时间对果胶水解度的等高线图和响应曲面Fig.9 Interactive effect between temperature and time on pectin hydrolysis degree
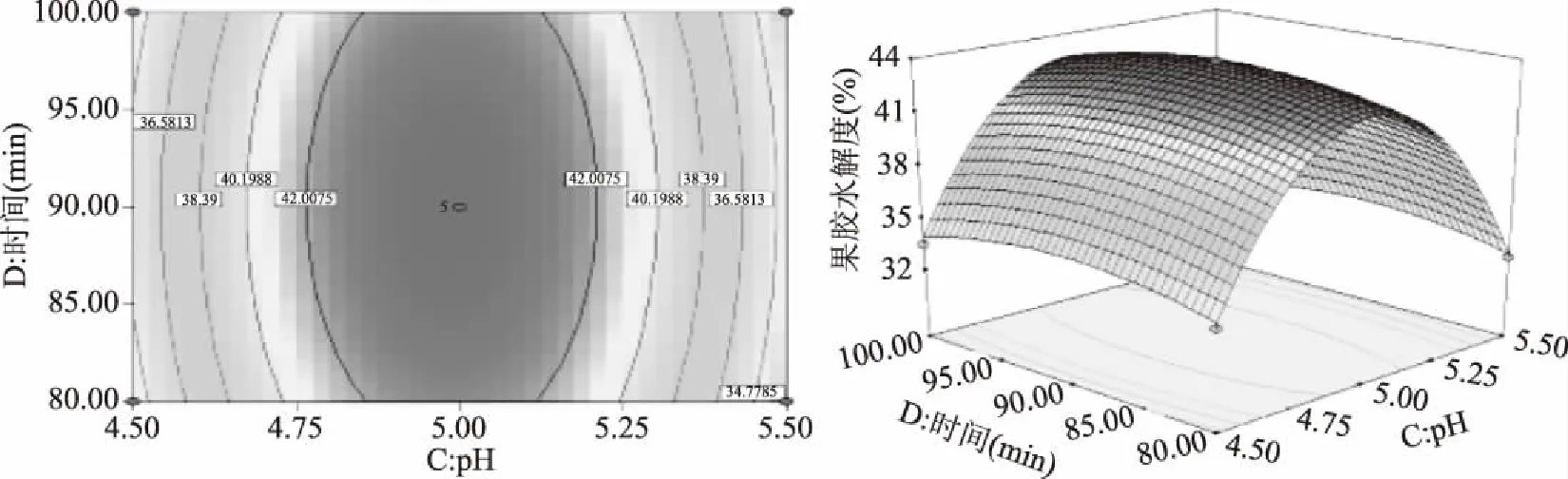
图10 时间和pH对果胶水解度的等高线图和响应曲面Fig.10 Interactive effect between time and pH on pectin hydrolysis degree
2.5 验证实验
根据响应曲面的优化结果结合实际条件,得到优化后的最佳实验条件酶添加量88 U/g,温度60 ℃,pH5.0,酶解时间90 min,进行验证试验。平行实验3组,得到果胶水解度为43.82%±0.02%,与果胶水解度预测值相差较小,表明响应曲面优化的工艺条件可行。
2.6 果胶酶处理甜玉米芯前后对其可溶性糖含量测定的结果与分析
通过果胶酶处理,甜玉米芯中的可溶性糖含量提高,由53.16%±0.02%提高到62.89%±0.03%,提高了9.73%。
3 结论
通过果胶酶处理甜玉米芯的单因素实验以及响应曲面优化试验,确定最终优化条件为酶添加量88 U/g,酶解温度60 ℃,pH5.0,酶解时间90 min。此时果胶的水解度可以达到最大值43.82%±0.02%。采用酸加果胶酶处理甜玉米芯的可溶性糖产率较单一酸处理的53.16%±0.02%提高了9.73%,达到62.89%±0.03%,此结果为提高可溶性糖含量的实验方法做出一定理论依据。
