植物来源谷氨酰胺转氨酶的研究进展
2018-09-13李洪波张天琪李红娟于景华
李洪波,李 金,张天琪,李红娟,于景华
(天津科技大学食品工程与生物技术学院,天津 300457)
谷氨酰胺转氨酶(Transglutaminase,TGase,EC 2.3.2.13)是一种催化酰基转移反应的酶,它能通过谷氨酰胺残基的γ-羧酰胺基(氨基受体)和赖氨酸残基的ε-氨基或其它伯胺基(氨基供体)之间的酰基转移反应形成ε-(γ-谷氨基)赖氨酸异肽键,从而实现蛋白质分子内、分子间的交联[1]。TGase的交联作用可以改善蛋白质的理化性质,进而影响其功能特性。TGase在食品、生物医学、纺织等方面有着广阔的应用前景,其中食品行业的应用最受关注,这也进一步增加了对廉价、有效和安全TGase的需求[2-3]。根据其来源不同,谷氨酰胺转氨酶大致分为以下三类:动物来源的谷氨酰胺转氨酶、植物来源的谷氨酰胺转氨酶和微生物来源的谷氨酰胺转氨酶(MTG)。动物来源TGase的研究最早、最为深入,从动物组织(如豚鼠)肝脏中提取出来的TGase热稳定性差,不适宜较高温度的生产;同时具有Ca2+依赖性,容易产生色素堆积,影响外观,从而限制了其在食品工业中的应用。MTG属于胞外酶,可直接分泌到培养基中,分离纯化较动植物来源的TGase容易,并且微生物发酵原料廉价、产酶周期短[4],MTG的催化活性不依赖Ca2+,底物特异性低,受到研究者的青睐。目前,MTG是商业酶的主要来源。植物来源TGase的研究较少,目前主要集中在不同植物来源TGase的理化特性及其在植物中的分布和功能。该酶的分离纯化困难,产量较低,所以对其进行微生物异源表达以提高产量,从而进行催化性质及应用性质的研究。
1 植物来源TGase的研究历程
1987年,Iceckson和Apelbaum[5]通过对转氨酶活性分析发现豌豆顶芽分生组织中的转氨酶活性,并利用动物来源TGase作为抗体首次证实了该酶为TGase。随后研究者陆续对拟南芥、紫苜蓿、甜菜、向日葵、大豆和玉米等低等或高等植物组织中的TGase进行了研究。1991年Kuehn等[6]在苜蓿的花芽细胞中发现了TGase活性。同年Signorini等[7]在甜菜叶子中检测到TGase的存在。1994年,Del等[8]在向日葵的叶绿体中发现不同分子量的TGase。1996年,Kang等[9]在大豆的叶和幼苗中检测到分子量为80 kDa的TGase。1999年,Bernet等[10]在玉米愈伤组织和叶绿体中检测到黏玉米来源TGase(TGZ)的存在。随后,利用纯化的叶绿体TGZ制备了多克隆抗体,检测了TGZ在不同玉米细胞中的亚细胞定位。研究表明,在成熟的叶子中,该酶主要分布在接受光照的叶肉组织细胞的叶绿体类囊体中,并分散到叶绿体的维管束鞘细胞,并且该酶的活性受光照影响[11]。随后在多种低等和高等植物的细胞质、细胞壁、叶绿体和线粒体中发现了TGase的存在,并发现其参与植物组织中的能量转移及细胞骨架的形成等多种生理活动。对其性质研究发现,植物来源TGase与动物来源TGase有相同的免疫原性和相似的反应最适pH,但是对Ca2+依赖性因物种而异[12]。目前,对植物来源TGase的功能性质、催化机制及在乳制品和其它食品蛋白改性等方面的研究未见报道。
2 TGase在各植物中的分布及功能特性
2.1 植物TGase的生化特性
植物来源TGase在理化性质、分子量大小及交联活性等方面与其它来源TGase有很大不同,表1[6-9,13-22]总结了高等植物和藻类中TGase的分布及其生化特性。
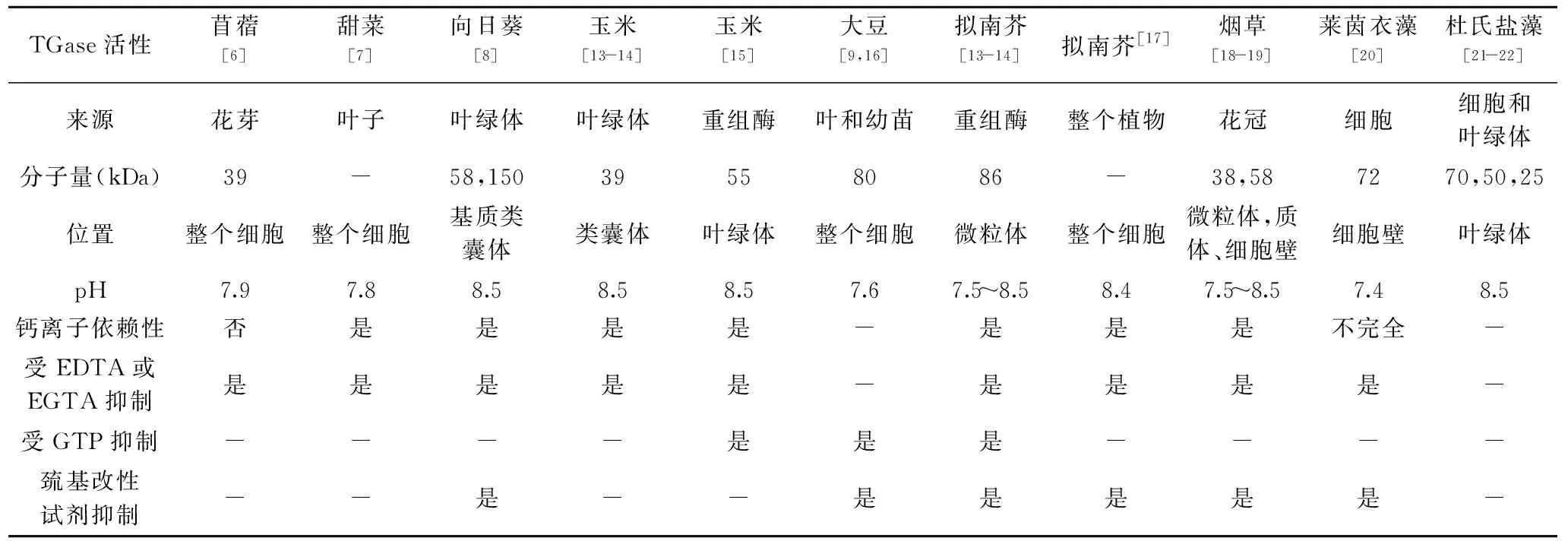
表1 高等植物和藻类中谷氨酰胺转氨酶的分布及其生化特征Table 1 Distribution and biochemical characteristics of TGase in higher plants and algae
对植物来源TGase粗提物的研究表明,TGase的活性不需要Ca2+的激活[7,20]。进一步的研究发现植物来源TGase对Ca2+的依赖性因物种而异,低浓度Ca2+对其有促进作用,而高浓度Ca2+对其有抑制作用。对豌豆根部和叶子中TGase的研究表明,Ca2+浓度影响TGase的交联,同时其活性受到乙二醇双(2-氨基乙基醚)四乙酸(EGTA)的抑制,表明其有Ca2+依赖性[12]。Ca2+的添加有助于玉米TGase的折叠,从而恢复其功能结构;当Ca2+的浓度达到0.6 mmol/L,玉米TGase的活性最高[13-14,23]。在梨花粉管细胞溶质中,TGase在与肌动蛋白结合时显示出Ca2+依赖性[24]。γ-谷氨酰衍生物的生物化学分析显示AtPng1p基因通过牛血清白蛋白的聚合检测,产物具有Ca2+和鸟苷三磷酸(GTP)依赖性的转酰胺酶活性[13]。
植物源TGase的分子量大小不一,同一种植物不同组织中TGase的分子量也不尽相同。目前报道分子量最小的为烟草花冠中的TGase,大小为38 kDa[18-19];在拟南芥中,已经在膜片段中检测到86 kDa的蛋白质,而在可溶性样品中检测到48至73 kDa的数个条带[13-14];在苜蓿的花芽中发现了39 kDa的TGase[6];莱茵衣藻则分泌细胞外72 kDa的TGase[20];在光照条件下体外培养的向日葵枝条组织中[8]观察到58 kDa的蛋白质条带,而向日葵叶绿体中TGase的分子量则高达150 kDa[12]。
高等植物细胞内TGase的最适反应pH与动物来源TGase相似,在7.5~8.5,这可能与植物光合作用引起的pH变化和氧化还原反应有关。但是细胞壁中TGase的最适反应pH呈中性或偏酸性,这可能与其分布和功能相关。巯基改性试剂的抑制作用表明植物来源TGase含有巯基基团。还原剂二硫苏糖醇可以增加大豆叶子、拟南芥中TGase的活性,但对其它植物提取物中的TGase有抑制作用[12]。
2.2 植物TGase的分布及功能特性
谷氨酰胺转氨酶是所有植物器官和细胞室中普遍存在的酶。它们催化多胺与不同蛋白质靶标(如细胞骨架)的翻译后缀合。进一步的研究发现,TGase广泛分布于植物叶子、块茎、花蕾、根部等组织和器官中,在植物生长发育过程中起着重要作用[25]。
细胞质和细胞壁中的TGase在细胞骨架重排、维持细胞壁肽聚糖的完整性、细胞间的粘附和细胞迁移过程中起着主要作用。它能通过细胞骨架的重排、细胞壁的扩张及改变种子中的蛋白质结构来促进花粉管和幼苗的快速生长[26]。如在梨花粉管中,细胞质TGase可能参与到伯胺与谷氨酰胺残基的结合,而细胞壁相关的TGase酶被认为调节花粉管生长[25]。TGase也分泌在细胞外基质中,参与花粉管细胞壁的组装和加固。在花粉受精期间,花粉管与细胞外基质之间相互作用时TGase活性不明显,但是在自交不亲和反应期间,该酶的活性增强,进而导致形成交联产物(包括微管蛋白和肌动蛋白的聚集体)[26]。因此,TGase被认为是细胞骨架动力学的调节剂。TGase也存在于植物的叶绿体和线粒体等亚细胞室中,保护和稳定二磷酸核酮糖羧化酶和光合体系中天线复合体的脱辅基蛋白,从而影响二磷酸核酮糖羧化酶的催化活性和能量转移效率[27]。在细胞溶质中,TGase修饰细胞骨架蛋白,初步研究表明参与细胞壁的构建,而且似乎还与受精,非生物和生物胁迫,衰老和程序性细胞死亡以及过敏反应有关[28]。
3 植物源TGase的分离纯化及异源表达
植物来源TGase的分离纯化工艺复杂,同时数据库中缺少相应的氨基酸和基因序列信息,这些共同阻碍了植物来源TGase的研究。目前已获得拟南芥、黏玉米、菊芋、稻子、梨及苹果TGase的基因序列,研究发现菊芋TGase序列与稻子和拟南芥有较高的同源性,而梨TGase序列与拟南芥仅有76%的同源性,与苹果的同源性确高达99%[12]。
研究者已陆续将拟南芥和黏玉米TGase进行异源表达。大肠杆菌E.coli表达系统是细菌表达系统的代表,自上世纪70年代以来,E.coli一直是基因工程中应用最为广泛的表达系统。与其它系统相比,E.coli表达系统具有遗传背景清楚,操作简便,可以大规模发酵培养的优点[29]。Della等[13]首次将拟南芥中编码TGase的基因AtPng1p在大肠杆菌中进行表达,并通过动物TGase抗体对重组蛋白进行检测,检测到86 kDa大小的TGase。进一步研究发现,该酶含有一个催化三联体Cys-His-Asp,其中半胱氨酸残基是活性中心的主要亲核体。对其性质研究表明,该重组酶具有Ca2+依赖性和GTP依赖性,可以催化腐胺、精胺、尸胺等底物。Villalobos等[24]在黏玉米愈伤组织和叶绿体中检测到TGase的活性,并通过多克隆抗体的制备对其进行定位,发现其主要存在于叶绿体类囊体中,并分散到叶绿体的维管束鞘细胞。2004年Villalobos等[30]通过分子克隆从黏玉米叶绿体中分离出两个TGase基因,TGZ15和TGZ21,Northern印迹分析显示,TGase的表达主要发生在幼叶和分化的玉米愈伤组织中,且表达量受光照时间的影响。同时,使用两种酶活测定法在过表达的细菌提取物中检测到这两种TGase的活性;2007年通过免疫定位TGZ和酶底物捕光复合物LHCII确定植物TGZ存在的位置,并进一步证明该酶是光依赖型。两个编码TGZ的cDNA,TGZ15和TGZ21克隆至pET28载体,并在大肠杆菌中表达,免疫分析表明,该酶以包涵体形式存在[31]。2010年Carvajal等[23]使用TritonX-100作为非变性洗涤剂将TGZ包涵复性,该过程不需要重折叠,同时复性后TGZ的活性与重折叠TGZ的活性相似,表明这是一种更有价值的快速获得活性TGZ的方法。2014年,本课题组将含有TGZ基因的重组ArcticExpressE.coli菌株,于37 ℃在LB培养基中培养至OD600约为0.4时,加入0.2 mmol/L的IPTG,于16 ℃低温诱导16 h后获得TGZ的最大表达。诱导表达后,用8 mol/L尿素溶解包涵体,复性后用亲和层析法进行分离纯化,纯化后TGZ活性为0.34 U/mg,产量达到1.41 mg/L[32]。由于大肠杆菌表达系统在表达真核蛋白时翻译后修饰不足,可能导致包涵体的形成、蛋白质的错误折叠和非功能性蛋白质的产量。作为真核表达系统,巴斯德毕赤酵母具有许多优点,如简单的遗传操作,翻译后修饰和容易放大的发酵,使得人们将目光转向了特性优良的巴斯德毕赤酵母表达系统。目前,已有多种蛋白质在巴斯德毕赤酵母中成功表达。
为了获得可溶性的活性TGZ,本课题组根据巴斯德毕赤酵母密码子的偏好性优化黏玉米TGase基因序列,并用重叠区扩增基因拼接法(SOEing-PCR)合成该基因。随后,比较了TGZ和优化后TGZ(TGZo)在毕赤酵母中的表达情况:将两种重组载体单酶切后通过电击转化入毕赤酵母GS115感受态细胞,经表型、G418 抗性及菌落PCR法筛选出His+Mut+表型的高拷贝重组菌株G-tgz和G-tgzo。将两种重组菌株分别进行甲醇诱导表达,其中G-tgz通过凝胶过滤层析和离子交换树脂进行分离纯化,纯化后TGZ的比活达到0.32 U/mg,产量达到 1.44 mg/L。G-tgzo则通过亲和层析法进行分离纯化,纯化后TGZo的比活达到 0.89 U/mg,产量达到4.4 mg/L[33-34]。结果表明,优化后的基因通过电击转化,成功的整合到毕赤酵母GS115的基因组中。通过对重组菌株发酵条件的优化,最终优化后TGase(TGZo)产量为4.4 mg/L,活性为0.889 U/mg[35]。但是重组TGZ的产量和活性均低于MTG,因此寻找更加有效的表达方法和增强重组TGase活性都有待进一步研究。
4 展望
目前,TGase在世界范围内的食品加工中作为食品加工基料的需求与日俱增,TGase的应用范围也将持续增加。但是对植物来源TGase的功能性质、催化机制及在食品蛋白改性等方面的研究未见报道。鉴于植物TGase分离纯化困难、产率低的缺点,将其进行异源表达是解决这一问题的有效途径。获得高产的工业化应用菌株成为植物来源TGase能够大规模生产的关键性前提。综观TGZ的发展史,应在加大对植物来源TGase以应用为研究目标的同时,把获得高产菌株作为主要出发点,积极探索以食品级微生物作为表达系统,表达异源蛋白;同时利用定点突变等基因工程或其他新兴技术改造植物源TGase,提高酶催化性质,延长酶的稳定性是今后研究的重点和方向。
