动态监测降钙素原在颅脑术后患者发生医院感染的临床意义
2018-09-13黄俊红叶党华孟玉丽桂志勇谭占国
黄俊红 叶党华 孟玉丽 桂志勇 谭占国
漯河医学高等专科学校第一附属医院 1)神经外二科 2)肝病科,河南 漯河 462000
尽管神经外科手术技术不断进步、无菌观念的要求不断提高,各种基础护理措施不断加强,但医院感染在颅脑术后还是时常发生。常见的医院感染有呼吸系统感染、泌尿系感染、中枢神经系统感染、血液系统感染等。如治疗不及时将会影响手术的疗效和患者的预后,同时会增加患者的住院时间和经济负担,因此医院感染的早期诊断在临床工作中显得尤为重要。通常用于感染识别的传统指标,如体温、血象、脑膜刺激征、咽喉红肿等均会受手术创伤、血性脑脊液刺激、气管插管损伤等影响,缺乏特异性及敏感性,微生物学培养耗时、采集标本要求严格、且存在假阴性及假阳性,影像学检查在早期受多种因素制约等,如何在术后早期预测医院感染是临床医生关注的重要问题。本研究探讨动态监测血清PCT水平变化颅脑术后发生医院感染的作用。
1 资料与方法
1.1纳入标准病例的纳入标准如下:年龄16~72岁;无甲状腺功能疾病;无肝脏疾病及入院时肝功能异常;无血液系统疾病;术后随访6个月无死亡;1个月内无细菌感染史;未使用免疫抑制剂;入住重症医学科不超过72 h。
1.2一般资料选取2013-01—2014-01神经外科符合入选标准的颅脑手术患者176例,男98例,女68例;年龄16~72(39.2±7.6)岁;其中脑肿瘤手术24例,脑积水脑室腹腔分流术15例,脑积水腰大池腹腔分流5例,颅骨缺损修补术43例,面肌痉挛及三叉神经痛微血管减压术13例,脑出血钻孔外引流术24例,脑出血开颅血肿清除加去骨瓣减压术22例;颅脑损伤手术30例;最终诊断医院感染38例,未发生医院感染138例。选取同期健康体检者50例作为对照组,男28例,女22例;年龄35~54(40.2±5.3)岁。
1.3医院感染诊断标准符合中华人民共和国卫生部颁发的医院感染诊断标准:有明确的感染灶,且病原微生物学检查阳性;病原微生物学检查阴性,但是有典型的感染症状及体征,抗生素治疗有效。
1.4标本采集在颅脑手术患者术后第1、3、5、7天分别抽取5 mL静脉血,健康体检者于清晨空腹抽取5 mL静脉血。若样本不能及时检测,则须离心后取血清于-20 ℃冷冻保存。
1.5检测方法PCT检测采用半定量的免疫色谱检测法测定血清中的PCT浓度,试剂盒由德国BRAHM.S公司提供,操作方法严格按照说明书进行。CRP测定采用i-CHROMA比浊仪测定,试剂由韩国BODITECH MED INC.生产,操作方法严格按照说明书进行。血常规分析采用全自动血细胞分析仪XT-1800,时间由希森美康公司提供,操作方法严格按照说明书进行。正常参考值:PCT≤0.05 ng/mL;CRP 0~8 mg/L;WBC 4~10×109/L。

2 结果
2.1颅脑手术后第1天与对照组血清炎症指标测定结果的比较颅脑手术后第1天的血清PCT水平显著高于对照组,而血清CRP水平及白细胞计数和对照组比较差异无统计学意义(P>0.05)。见表1。
2.2感染组与非感染组各时段PCT水平比较感染组各时段PCT水平显著高于非感染组各相应时段,差异有统计学意义(P<0.05)。其中感染组血清PCT在术后第1天开始升高,于第3天达峰,之后持续下降。见表2。
2.3感染组与非感染组各时段CRP水平比较感染组于术后第3、5天明显高于非感染组,差异有统计学意义(P<0.05);术后第1、7天时相比于非感染组,差异无统计学意义(P>0.05)。见表3。
2.4感染组与非感染组各时段CRP水平比较感染组于术后第3天明显高于非感染组,差异有统计学意义(P<0.05);术后第1、5、7天时相比于非感染组,差异无统计学意义(P>0.05)。见表4。
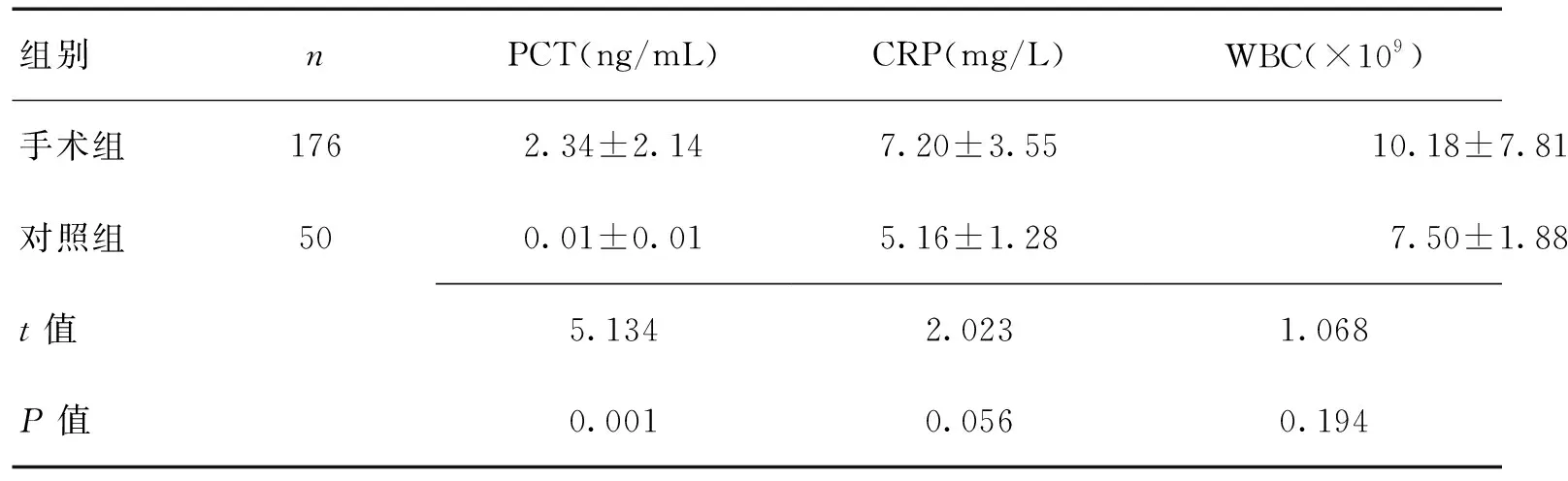
表1 术后第1天与对照组炎症指标测定结果比较
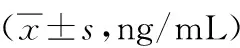
表2 感染组和非感染组各时段PCT浓度变化比较

表3 感染组和非感染组各时段CRP浓度的变化
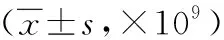
表4 感染组和非感染组各时段WBC计数的变化
3 讨论
PCT是由116个氨基酸组成,相对分子量为13 KD的糖蛋白,不具有激素活性,为降钙素(calcitonin,CT)的前体物质,是11号染色体(11p15.4)上的Calci基因的编码产物。在生理情况下人体甲状腺滤泡旁细胞(C细胞)内转录生成Calci m RNA后,翻译成PCT前体,经糖基化和特异性酶切除后生成PCT。血浆中的PCT非常稳定,收集标本24 h后其浓度在室温下大约降解12%,在摄氏4度时下降6%,在人体循环中的半衰期是25~30 h,肾功能异常的患者其清除半衰期无显著延长[1]。1993年ASSICOT等[2]首次报道PCT可作为细菌感染早期的标志物。在健康人的血清PCT水平通常检测不到(<0.1 ng/mL),但在有细菌感染时PCT会升高,且升高程度可反应感染的严重程度。PCT是一种继发性炎症介质,本身不能启动炎症反应,但是可以放大炎症反应[3]。大量研究表明[4-7],PCT可作为机体早期(2 h)感染的敏感指标。同时多项研究表明[8-10],PCT的动态变化和全身性感染的病情演变一致,且成正相关性。本研究结果表明,颅脑术后第1天PCT水平显著高于对照组,提示可能存在感染,有助于临床早期做出判断并采取措施。此时应该动态监测PCT的变化。在术后1、3、5、7天的动态监测中,感染组PCT水平始终明显高于非感染组。国内袁慧峰[11]研究表明,降钙素原的测定有利于早期诊断急性颅脑损伤疾病患者医院感染。张翼等[12]认为,PCT对颅内感染临床早期诊断具有重要意义,而且认为是鉴别细菌和病毒感染最具敏感性及特异性的标志物。因此动态监测PCT水平可以作为早期预测颅脑术后患者发生医院感染的血清学指标。
CRP是1930年TILLETT等[13]首次在急性大叶性肺炎患者的血清中发现的一种能在Ca2+存在时和肺炎链球菌细胞壁中的C-多糖发生特异性沉淀反应的物质。MACLEOD等[14]证实它是一种蛋白质,故称为CRP。CRP是一种由肝细胞合成并分泌的急性正时相反应蛋白[15],由5个相同的亚单位以非共价键结合而成的环状五聚体,是炎症早期(12 h)的指标之一[16]。除细菌感染可引起CRP升高外,严重创伤、手术都可引起其升高,因此作为感染性疾病的检测指标缺乏特异性。本研究表明,CRP在术后第1天患者和健康体检者无统计学差异;感染组于术后第3、5天明显高于非感染组,差异有统计学意义;但是感染组于术后第1、7天时相比于非感染组,差异无统计学意义[18-20]。因此CRP可作为颅脑术后患者发生医院感染的辅助检测指标。
WBC计数是临床上最常用的一种炎性标志物,它的升高在判断感染性疾病方面起着非常重要作用,一般而言,细菌感染时血液中WBC计数常常升高,病毒感染时一般不升高或下降,但是易受年龄、生理、应激、创伤、自身免疫体系等多因素影响,WBC不能够精准反应疾病的状态,同时在严重感染时,WBC计数可能下降[17,23]。全身感染既可以引起其升高,且多种炎性因子均可引起WBC计数的改变[24-25]。WBC计数可提示存在细菌感染,但是其诊断的特异性和敏感性较差,因为WBC计数升高提示炎症反应,而非感染的特异性表现[26-28]。本研究提示,WBC在术后第1天患者和健康体检者无统计学差异;感染组于术后第3天明显高于非感染组,差异有统计学意义;但感染组于术后第1、5、7天时相比于非感染组,差异无统计学意义。因此WBC可作为颅脑术后患者发生医院感染的辅助检测指标。
综上所述,动态监测PCT水平可作为早期预测颅脑术后患者发生医院感染的敏感及特异性指标。但仍需结合患者的症状、体征、影像学检查、病原微生物学检查等综合判断,尽早对医院感染做出诊断,以便合理使用抗生素、提高临床疗效、缩短住院时间、降低医疗费用。
