2型糖尿病与压力负荷对心肌运动模式的交互作用
2018-09-12郑孝飞张世军常娣居胜红
郑孝飞,张世军,常娣,居胜红
东南大学附属中大医院医学影像科,江苏南京 210009;
心血管疾病是糖尿病患者死亡的主要原因。糖尿病患者心血管并发症的危险性较高,包括心肌梗死和心力衰竭,20年病死率高达11%[1]。血压升高导致心脏的压力负荷增加,并且是促进糖尿病患者发生心血管疾病的重要原因。在糖尿病合并高血压患者中,心血管事件的发生率明显高于单纯糖尿病或单纯高血压人群[2-3]。导致这种高风险的机制尚未完全阐明。本研究使用心血管磁共振(cardiac magnetic resonance,CMR)定量评估糖尿病伴发高血压患者的心肌功能,了解糖尿病患者伴发高血压时心肌运动模式的改变,从而识别心脏发生心力衰竭前这一阶段心脏的变化。
1 资料与方法
1.1 研究对象 前瞻性收集 2013年 1月-2016年12月东南大学附属中大医院88例受试者。其中疾病组分为单纯高血压37例、单纯糖尿病22例、糖尿病伴高血压14例;同期纳入年龄相匹配的健康志愿者15例作为对照组。所有受检者一般资料见表1。
表1 各组研究对象一般资料比较( ±s)
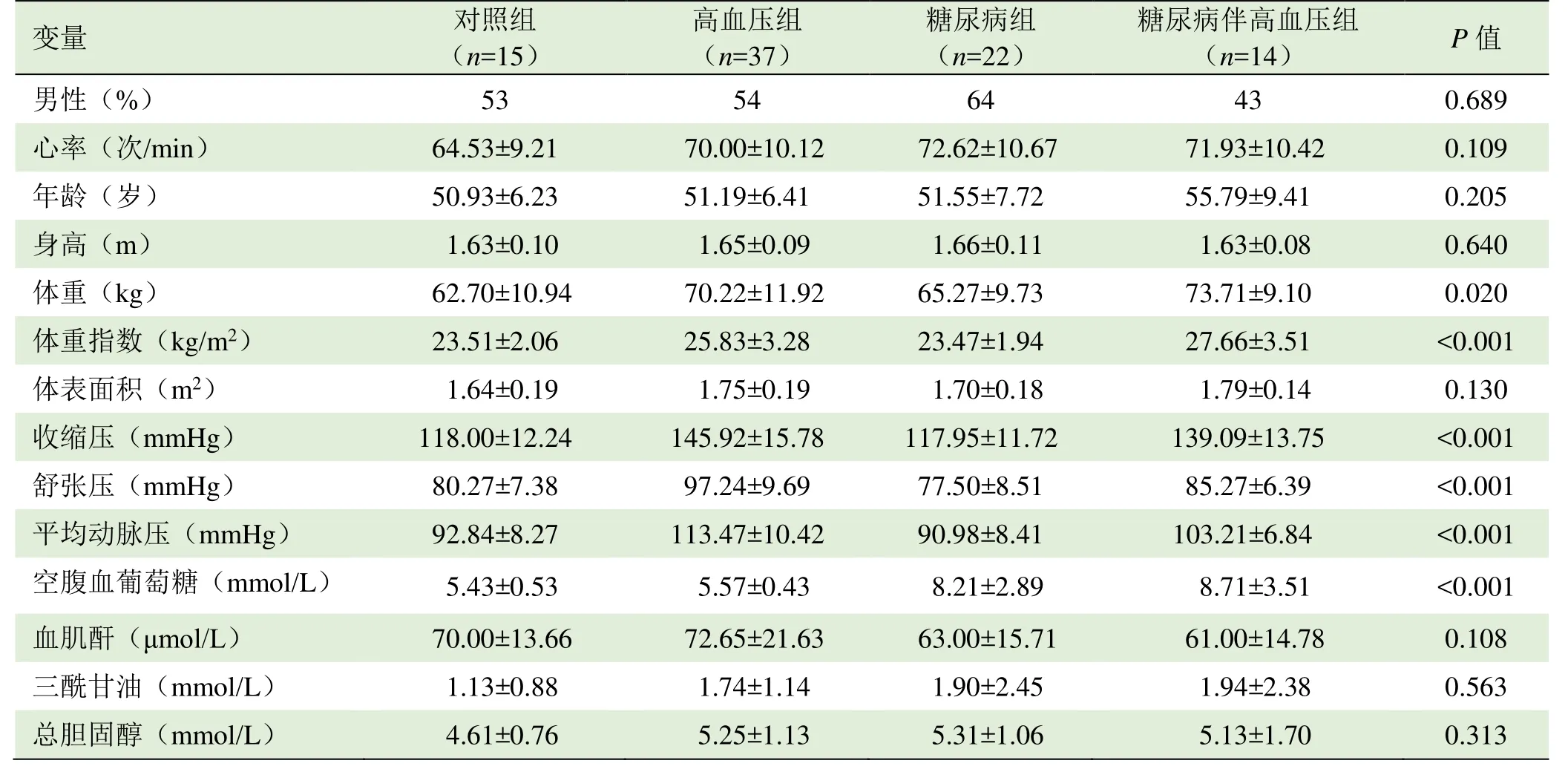
表1 各组研究对象一般资料比较( ±s)
年龄(岁) 50.93±6.23 51.19±6.41 51.55±7.72 55.79±9.41 0.205身高(m)1.63±0.101.65±0.091.66±0.111.63±0.080.640体重(kg) 62.70±10.94 70.22±11.92 65.27±9.73 73.71±9.10 0.020体重指数(kg/m2)23.51±2.0625.83±3.2823.47±1.9427.66±3.51<0.001体表面积(m2) 1.64±0.19 1.75±0.19 1.70±0.18 1.79±0.14 0.130收缩压(mmHg)118.00±12.24145.92±15.78117.95±11.72139.09±13.75<0.001舒张压(mmHg) 80.27±7.38 97.24±9.69 77.50±8.51 85.27±6.39 <0.001平均动脉压(mmHg)92.84±8.27113.47±10.4290.98±8.41103.21±6.84<0.001空腹血葡萄糖(mmol/L) 5.43±0.53 5.57±0.43 8.21±2.89 8.71±3.51 <0.001血肌酐(μmol/L)70.00±13.6672.65±21.6363.00±15.7161.00±14.780.108三酰甘油(mmol/L) 1.13±0.88 1.74±1.14 1.90±2.45 1.94±2.38 0.563总胆固醇(mmol/L)4.61±0.765.25±1.135.31±1.065.13±1.700.313
1.2 纳入及排除标准 纳入标准:①糖尿病及高血压患者均为我院收治并确诊3~5年的患者;②糖尿病患者均接受正规降血糖药物治疗,且无糖尿病肾病并发症;③高血压患者在未使用降压药物的情况下,非同日3次测量血压,收缩压>140 mmHg和(或)舒张压>90 mmHg,或正在使用降压药物;④糖尿病伴高血压患者同时满足上述高血压和糖尿病的条件;⑤所有患者于检查当日进行血生化及血压检测。排除标准:①心肌梗死、冠心病、心脏瓣膜病及肥厚型心肌病等非缺血性心肌病;②肾小球滤过率<45 ml/min;③MRI检查相关禁忌证。本研究遵守赫尔辛基宣言并得到本单位伦理委员会的批准,所有拟入选的受试者在参加试验前均签署知情同意书。
1.3 图像获取 采用 3.0T MR(MagnetomVerio;Siemens),检查序列包括左心室短轴、四腔心及二腔心长轴快速亮血梯度回波电影序列和通过平面内的过二尖瓣血流速度相位对比流速编码梯度回波电影序列。快速亮血梯度回波序列扫描参数:TR 55.20 ms,TE 2.54 ms,激励角35°,层厚6 mm,层间距1.5 mm,矩阵224×182,层面内分辨率1.5 mm×1.5 mm,每心动周期25帧,采集9~12层平行短轴层面电影。相位对比流速编码梯度回波电影序列扫描参数:TR 50.40 ms,TE 2.27 ms,层厚5.5 mm,矩阵144×192,每心动周期30帧。
1.4 图像分析
1.4.1 左心功能分析 使用Argus软件(Siemens)对左心室短轴电影和血流电影进行分析,手动勾勒短轴电影的心内膜和心外膜轮廓,得出左心室容积-时间曲线以及左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室质量(left ventricle mass,LVM)、相对左心室壁厚(LV mass/LV end diastolic volume ratio,LVMVR)[4]。通过二尖瓣血流速度-时间曲线计算舒张早期和舒张晚期充盈速度比值(E/A)。
1.4.2 特征追踪分析(feature tracking analysis,FT)使用专用心脏性能分析软件(Circle,cvi42,Calgary,Canada)直接从电影图像获得心肌应变量化[5]。选择舒张末期的短轴及长轴电影视图手动勾画心内膜和心外膜轮廓,直接通过软件获得舒张功能指标,包括峰值舒张应变速率周向(peak diastolic strain rate circumferential,PDSRC)、峰值舒张应变速率径向(peak diastolic strain rate radial,PDSRR)及峰值舒张应变速率纵向(peak diastolic strain rate longitudinal,PDSRL)和收缩功能指标峰值收缩应变速率周向(peak systolic strain rate circumferential,PSSRC)、峰值收缩应变速率径向(peak systolic strain rate radial,PSSRR)及峰值收缩应变速率纵向(peak systolic strain rate longitudinal,PSSRL)。见图 1。
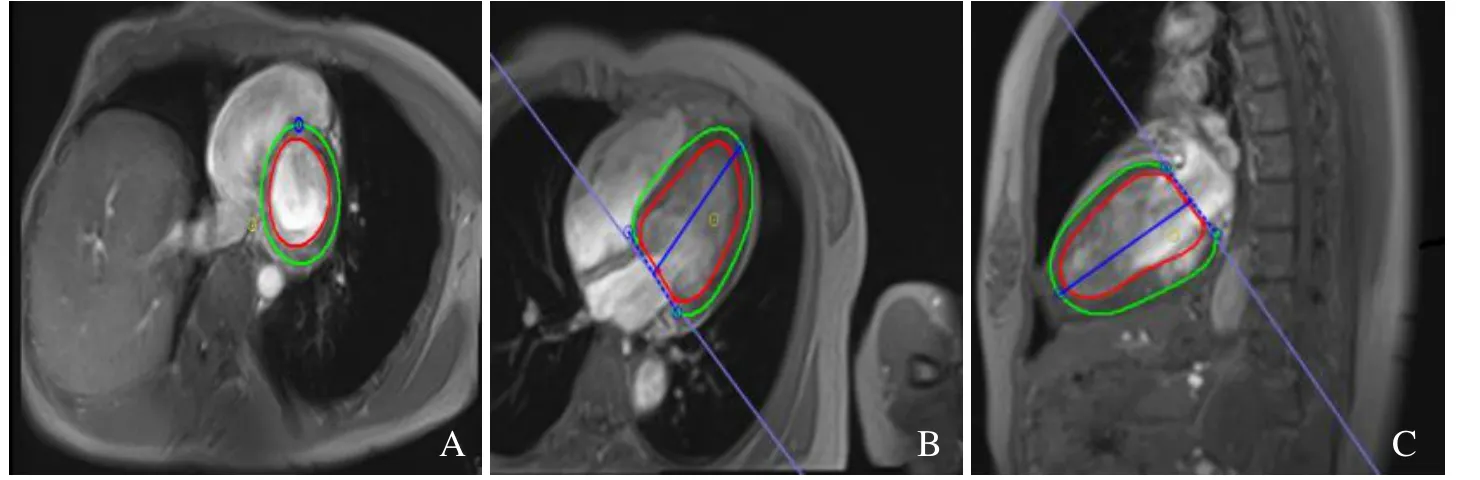
图1 女,46岁,健康志愿者。分别在舒张末期短轴电影、四腔心长轴电影及二腔心长轴电影手动勾画心内膜(红色)及心外膜轮廓(绿色),通过特征追踪分析软件(cvi42)分析得出心脏应变参数
1.5 统计学方法 采用SPSS 18.0软件,计量资料以±s表示,并对数据进行方差齐性检验,方差不齐时进行对数或排秩转化以达到方差齐性,不同因素比较采用两因素两水平析因设计方差分析,两两比较采用SNK法。P<0.05表示差异有统计学意义。
2 结果
2.1 左心室心功能指标及峰值应变速率比较 各组受检者的射血分数均在正常范围内,但疾病组的舒张功能不同程度减低,即E/A、PDSRR及PDSRC均减低。见表2、3。
表2 各组受检者左心功能MRI结果比较( ±s)
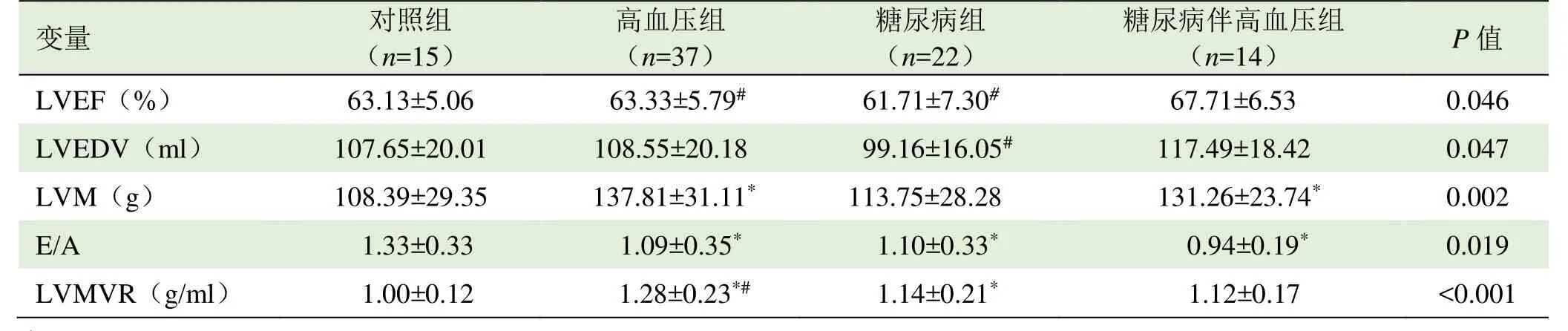
表2 各组受检者左心功能MRI结果比较( ±s)
注:LVEF:左心室射血分数;LVEDV:左心室舒张末期容积;LVM:左心室质量;E/A:二尖瓣血流舒张早期与晚期最大充盈速度比值;LVMVR:相对室壁厚度(LVM/LVEDV);与对照组比较,*P<0.05;与糖尿病伴高血压组比较,#P<0.05
变量对照组高血压组糖尿病组糖尿病伴高血压组(n=15)(n=37)(n=22)(n=14)P值LVEF(%) 63.13±5.06 63.33±5.79# 61.71±7.30# 67.71±6.53 0.046 LVEDV(ml)107.65±20.01108.55±20.1899.16±16.05#117.49±18.420.047 LVM(g) 108.39±29.35 137.81±31.11* 113.75±28.28 131.26±23.74* 0.002 E/A 1.33±0.331.09±0.35*1.10±0.33*0.94±0.19*0.019 LVMVR(g/ml) 1.00±0.12 1.28±0.23*# 1.14±0.21* 1.12±0.17 <0.001
表3 各组研究对象峰值心肌应变速率( ±s,/s)
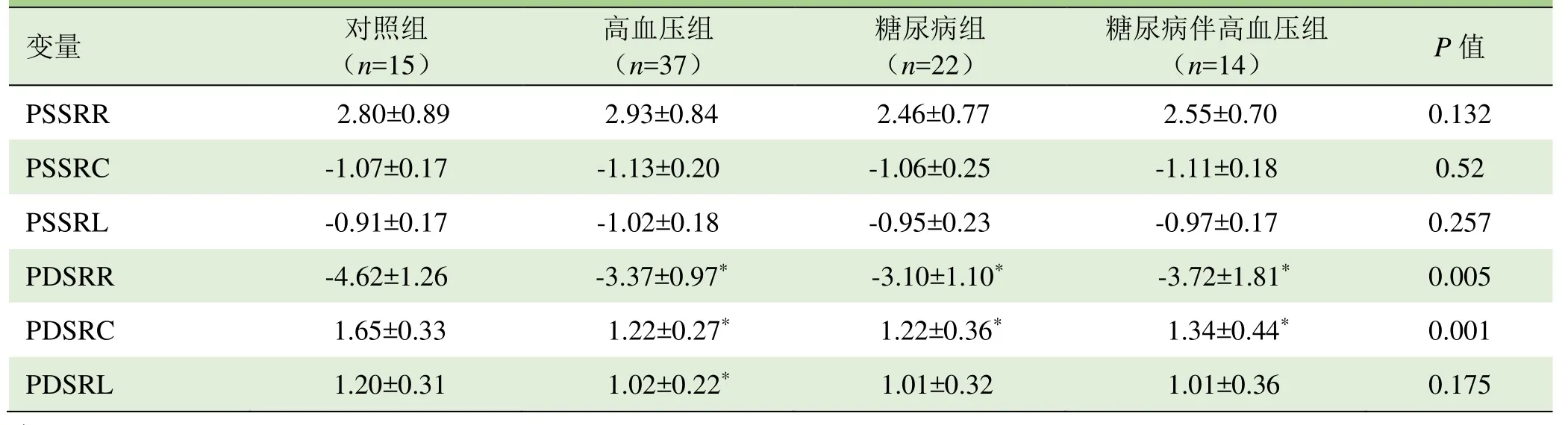
表3 各组研究对象峰值心肌应变速率( ±s,/s)
注:PSSRR:峰值收缩应变速率径向;PSSRC:峰值收缩应变速率周向;PSSRL:峰值收缩应变速率纵向;PDSRR:峰值舒张应变速率径向;PDSRC:峰值舒张应变速率周向;PDSRL:峰值舒张应变速率纵向;与对照组比较,*P<0.05
PSSRL -0.91±0.17 -1.02±0.18 -0.95±0.23 -0.97±0.17 0.257 PDSRR -4.62±1.26-3.37±0.97*-3.10±1.10*-3.72±1.81*0.005 PDSRC 1.65±0.33 1.22±0.27* 1.22±0.36* 1.34±0.44* 0.001 PDSRL 1.20±0.311.02±0.22*1.01±0.321.01±0.360.175
2.2 高血压与糖尿病双因素双水平析因分析
2.2.1 高血压与糖尿病对峰值收缩应变速率交互作用 PSSRR、PSSRC及PSSRL糖尿病与高血压交互作用均无统计学意义(F=0.000,P>0.05;F=0.005,P>0.05;F=1.023,P>0.05)。见图2A。
2.2.2 高血压与糖尿病对峰值舒张应变速率交互作用对于 PDSRR,糖尿病与高血压交互作用有统计学意义(F=8.166,P<0.01)。单独存在糖尿病可能使PDSRR减低(单纯糖尿病与对照组相比,P<0.05),单独存在高血压可能使PDSRR减低(单纯高血压与对照组相比,P<0.05);而糖尿病存在时,高血压对PDSRR的作用程度减低(糖尿病伴高血压与单纯高血压组相比,P>0.05),即糖尿病和高血压对PDSRR的影响存在拮抗作用。见图2B。
对于 PDSRC,糖尿病与高血压交互作用有统计学意义(F=10.422,P<0.01)。单独存在糖尿病可能使PDSRC减低(单纯糖尿病与对照组相比,P<0.05),单独存在高血压可能使PDSRC减低(单纯高血压与对照组相比,P<0.05);而糖尿病存在时,高血压对PDSRC的作用程度减低(糖尿病伴高血压与单纯高血压组相比,P>0.05),即糖尿病和高血压对PDSRC的影响存在拮抗作用。见图2C。
对于 PDSRL,糖尿病与高血压交互作用无统计学意义(F=1.760,P>0.05)。
2.2.3 高血压与糖尿病对LVMVR交互作用 糖尿病与高血压交互作用有统计学意义(F=11.080,P<0.01)。糖尿病对LVMVR作用不显著(单纯糖尿病与对照组相比,P>0.05),高血压可以使LVMVR增高(单纯高血压与对照组相比,P<0.05);而糖尿病存在时,高血压对LVMVR的作用程度降低(糖尿病伴高血压与单纯高血压组相比,P<0.05),即糖尿病和高血压对LVMVR的影响存在拮抗作用。见图2D。
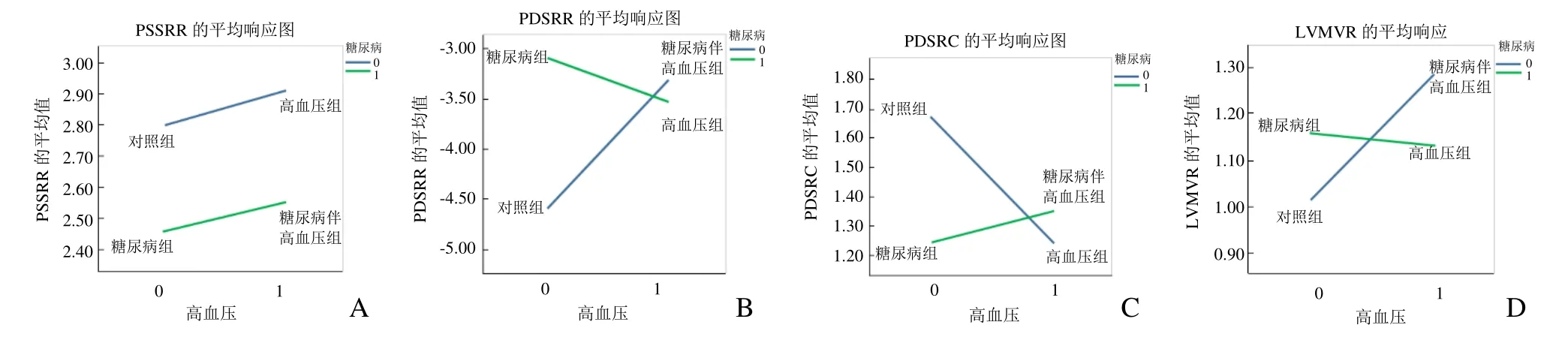
图2 高血压与糖尿病的交互作用。对于峰值收缩应变速率径向,高血压与糖尿病之间不存在交互作用(A);B、C:对于峰值舒张应变速率径向、峰值舒张应变速率周向,高血压与糖尿病之间存在拮抗作用;对于相对左心室壁厚,高血压与糖尿病存在拮抗作用(D)。PSSRR:峰值收缩应变速率径向;PDSRR:峰值舒张应变速率径向;PDSRC:峰值舒张应变速率周向;LVMVR:相对室壁厚度(LVM/LVEDV)
3 讨论
心肌应变是心肌早期功能改变更敏感的指标。心脏磁共振特征追踪分析技术(CMR-FT)已用于正常及多种疾病的全心和区域心肌应变测量,但对高血压和糖尿病患者的心肌应变交互作用未见报道。本研究所纳入的患者均处于患病早期阶段,患者均未发生明显的临床心脏功能损害,对此阶段的心脏功能监测有利于在疾病早期进行及时干预、逆转心肌功能障碍。本研究结果显示,尽管对于收缩功能指标 PSSRR、PSSRC和PSSRL,糖尿病与高血压之间无交互作用,但对于早期舒张功能指标PDSRR、PDSRC和左心室向心性重塑指标LVMVR,糖尿病与高血压之间存在相互拮抗的交互作用。上述结果表明,与单纯性高血压患者相比,同时罹患糖尿病时,所引起的心肌应变改变存在一定的拮抗效应。
另外,本研究结果提示心肌早期舒张功能的3项指标(PDSRR、PDSRC、PDSRL)中,仅PDSRR、PDSRC在糖尿病与高血压有交互作用,而PDSRL在糖尿病与高血压之间不存在明显的交互作用。左心室心肌大部分由沿纵向和周向取向的纤维组成。在这些纤维中,周向纤维最主要。心肌的周向缩短是心输出量的主要决定因素,局部周向心肌功能减低可能代表对心肌壁应力增加的反应和(或)反映心肌特性的局部改变,如大血管或微血管疾病所致纤维化或局部缺血[6]。Augustine等[7]比较了FT技术与tagging技术,结果显示 CMR-FT在周向而非纵向或径向全心应变的测量结果与tagging技术具有较好的一致性和可重复性。Claus等[8]和Pedrizzetti等[9]总结了超声心动图和CMR-FT技术,指出纵向应变是超声心动图中最稳定的应变参数,也是指南中推荐的参数;而对于CMRFT,周向应变的可重复性比纵向应变好,其价值类似于纵向应变在超声心动图中的价值。故CMR-FT技术在纵向应变的可重复性欠佳可能是导致本试验中PDSRL在糖尿病与高血压之间无明显交互作用的重要原因。
值得注意的是,本研究中单纯高血压组和单纯糖尿病组收缩功能LVEF均在正常范围内,而舒张功能E/A及向心性重塑指标LVMVR较对照组均有不同程度减低,提示早期亚临床心脏功能损害。左心室向心性重塑的特点是LVMVR(左心室质量和舒张末期容积比)增加[4]。左心室的舒张功能取决于其被动弹性及主动放松的属性,舒张功能减低的特点是左心室的舒张和被动充盈功能受损[10]。而在患者出现明显的收缩功能障碍之前,心脏会发生改变,出现早期舒张功能减低和左心室向心性重塑。但在此阶段,由于患者临床症状不明显而常被忽视,进而错过早期治疗的最佳时期。因此,对此阶段早期识别及干预具有重要临床意义。
前期研究表明,长期高血压的病理状态可导致患者心脏压力负荷增加。为适应这一变化,心肌细胞弥漫性代偿性肥大,出现结构重塑(左心室向心性重塑),导致舒张末期容积正常或接近正常,左心室质量及相对左心室壁厚增加,而出现早期亚临床舒张功能减低[4,11]。在2型糖尿病患者发展至心力衰竭前也会出现向心性重塑和舒张功能减低,并且是心血管不良事件发生的强烈预测因子[12]。在无高血压存在的情况下,糖尿病患者的心肌向心性重塑和舒张功能减低的原因是糖尿病心肌病[13]。然而糖尿病心肌病的发病机制尚未阐明,目前认为其发生是由于微血管病变、自主神经功能紊乱、细胞钙转运缺陷以及心肌收缩蛋白结构变化和胶原蛋白积聚,导致室壁硬度增加,左心室顺应性降低,出现早期舒张功能减低[14]。上述机制导致单纯高血压组和单纯糖尿病组患者早期舒张功能减低及左心室向心性重塑。有学者认为,这种心脏早期舒张功能减低及左心室向心性重塑的改变可能是由于心脏为维持正常射血分数而出现的心肌代偿作用[15-16]。
当糖尿病伴压力负荷增加时,以上两种作用机制相互影响,心肌舒张功能减低及左心室向心性肥厚程度较单纯高血压减低,提示心肌的代偿能力可能减低。本研究可能存在的机制包括:①糖尿病患者糖代谢受到抑制,继而能量依赖的心肌蛋白合成受到一定的抑制,导致心肌细胞在压力负荷增加的刺激下肥大反应受限[17-18]。②高血糖状态使胶原糖基化,心内膜下胶原沉积,逐渐替代凋亡的心肌细胞[19]。当糖尿病伴高血压时,心肌细胞部分凋亡,部分肥大,压力负荷增加所致额外的心肌做功仅由部分肥大的心肌细胞分担,因此糖尿病伴高血压患者左心室向心性重塑程度低于单纯高血压。③心肌中部分肥大或不充分肥大的心肌细胞比肥大的心肌细胞能够更快地完成舒张过程,因此当糖尿病伴高血压时,舒张功能减低程度低于单纯高血压。
本研究尚存在一些不足:首先样本量较小,还需要进一步扩大样本量加以验证;本研究仅涉及起病的早期阶段,未对疾病的不同阶段进行分层研究,将在后续研究中补充。
总之,在单纯糖尿病和单纯高血压患者中,心肌运动方式发生一定程度的改变以维持正常的射血能力,可能为一种代偿机制,表现为早期亚临床舒张功能减低。糖尿病与并发高血压所致心肌运动模式改变存在一定的拮抗效应,提示糖尿病患者合并高血压时,心肌的代偿能力可能减低。上述初步结果尚需进一步研究以明确改变的心肌代偿方式是否使心脏更容易出现失代偿性心力衰竭。
