纳米金刚石的分散、修饰及载药应用研究∗
2018-09-11秦世荣赵琪程振国苏丽霞单崇新
秦世荣 赵琪† 程振国 苏丽霞 单崇新‡
1)(郑州大学物理工程学院,材料物理教育部重点实验室,郑州 450000)
2)(郑州大学基础医学院,分子肿瘤学研究中心,郑州 450052)
1 引 言
近年来,随着纳米医学的发展,纳米材料在生物医学领域的应用研究受到了越来越多的关注[1−4].如半导体量子点、碳量子点、稀土上转换纳米粒子等具有良好的荧光特性,可用作荧光探针对癌细胞进行标记,以实现肿瘤的定位和癌细胞扩散的追踪[5−7].此外,纳米粒子独特的尺寸和表面结构特性使其可以负载药物并将药物输运至癌症部位,实现靶向治疗[8,9].因此,纳米材料在纳米医学领域具有广泛的应用前景.传统的纳米药物载体包括碳纳米管、脂质体、聚合物纳米粒子、金属纳米粒子等,可以通过化学连接,物理包覆等方式进行药物装载[10−14],取得了良好的药物治疗效果.然而,由于这些材料具有化学性质不够稳定、制备过程较为复杂、成本较高等缺点,从而限制了其大规模的应用.纳米金刚石(nanodiamond,ND)是一种新颖的碳纳米材料,化学稳定性良好、生物毒性极低且具有良好的生物相容性,是目前已知毒性最低的纳米材料[15−17],因此受到了越来越多的关注.此外,ND可通过成熟的爆轰法合成,方法简单,且可大批量生产.爆轰法合成的纳米金刚石的尺寸可小至3—5 nm,拥有较大的比表面积和丰富的表面官能团,通过对纳米金刚石进行特定的表面修饰可以实现表面功能化,功能化的ND可以通过物理吸附或化学嫁接的方式装载小分子物质或核酸,用于药物运输或组织支架等[18−22],这使爆轰法ND展现出良好的应用前景.然而,爆轰法纳米金刚石尺寸较小,表面官能团复杂,颗粒间可通过的范德瓦尔斯力、氢键等相互吸引,形成团聚体,导致其在溶液中的分散性较差,从而限制了其在生物医学上的应用[23−25].虽然有研究人员对纳米金刚石的分散进行了一些探究[26],然而对分散后的ND的药物装载和释放性能以及生物毒性的探究还未见报道.
基于以上考虑,本文选取爆轰法纳米金刚石作为碳纳米材料,通过机械研磨和超声分散的方法对其进行了分散,然后通过酸洗使纳米金刚石表面具有均一的化学官能团,改善了ND在溶液中的分散性;探究了表面功能化的ND对阿霉素的吸附和释放特性以及功能化ND和载药ND对SGC-7901胃癌细胞系的生物毒性(图1).整体上,本文对纳米金刚石作为药物运输载体的性质进行了系统的研究,这对于促进其在药物运输领域的应用具有重要的借鉴意义.

图1 纳米金刚石的分散、修饰及药物装载与释放机理Fig.1.The disintegration,functionalization,drug loading and release of nanodiamond.
2 实 验
2.1 实验试剂与仪器
主要化学药品包括:盐酸阿霉素(上海阿拉丁生化科技有限公司)、纳米金刚石粉末(郑州华晶微钻股份有限公司),浓盐酸(A.R.)、浓硫酸(A.R.)、浓硝酸(A.R.)(洛阳化学试剂厂)、氢氧化钠(A.R.)(上海阿拉丁生化科技有限公司).
主要仪器:傅里叶变换红外谱仪 (FTR,Thermol Nicolet iz10,美国),Zetasizer Nano ZS90(Malvern,英国)、透射电子显微镜 (TEM,FEOL-2010,日本),X射线粉末衍射仪 (XRD,D/MAX-3B,日本)、分光光度计 (UH-4150,Hitachi日本)、酶标仪(Thermo Fisher,美国).
2.2 纳米金刚石的分散
本文采用氯化钠机械研磨和超声破碎法对ND进行分散.具体步骤为:首先将10 g氯化钠晶体与0.25 g ND粉末置于玛瑙研钵中混合并研磨30 min,随后将混合物溶于20 mL去离子水中并转移至50 mL烧杯中.使用超声波发生器在60%输出功率下对烧杯中的液体超声破碎100 min(频率60 kHz).超声结束后,将溶液配置成100 mL去离子水溶液,分别装入两个50 mL eppendorf离心管中,以8000 r/min离心10 min,得到纳米金刚石沉淀.然后将沉淀物重新分散于100 mL去离子水中并再次离心处理,在12000 r/min转速下离心1 h.最后,倒掉上清液并将沉淀置于真空干燥箱中干燥48 h得到分散的纳米金刚石.
2.3 纳米金刚石的表面修饰
首先,将0.25 g的爆轰法纳米金刚石置于马弗炉中,在425◦C下退火4 h.随后,将退火的纳米金刚石粉末分散于68 mL强氧化性的混合酸液中(H2SO4:HNO3=3:1)并在200 W的功率下超声分散1 h,然后将其转移到100 mL圆底烧瓶中于80◦C恒温搅拌48 h.搅拌结束后,待混合液冷却至室温,以8000 r/min离心5 min得到ND沉淀,先用RO水洗涤两次后,再分别用0.1 M NaOH和HCl溶液对纳米金刚石沉淀在100◦C下各搅拌洗涤2 h,将沉淀离心干燥得到羧基化的纳米金刚石粉末ND-COOH.
2.4 盐酸阿霉素吸收标准曲线的测定
根据Lambert-Beer定律,物质对某一波长的吸收度与物质的浓度呈线性关系.因此,利用Lambert-Beer定律,在一定浓度范围内可以根据溶液中阿霉素的吸收度计算得到溶液中阿霉素的浓度.而这需要首先得到浓度与吸收度的标准曲线.为了绘制标准曲线,将盐酸阿霉素配置成0.2,0.1,0.05,0.025,0.0125 mg/mL等一系列不同浓度的水溶液,然后使用紫外可见分光光度计分别测量不同浓度阿霉素溶液的吸收谱,从而得到500 nm处的吸光度值随浓度的变化关系,通过origin线性拟合,得到阿霉素的吸收度-浓度标准曲线.
2.5 纳米金刚石的药物负载与药物释放性能测试
将10 mg羧基化的纳米金刚石分散于50 mL去离子水中超声振荡10 min使纳米金刚石得到充分分散,随后向溶液中加入5 mg盐酸阿霉素并持续搅拌.随后,以特定的时间间隔取2 mL溶液进行离心得到上清液,并使用分光光度计测上清液中阿霉素的吸光度,根据标准曲线计算得到阿霉素的含量.然后将不同时间点阿霉素含量的数据进行线性拟合,得到阿霉素的装载量随时间变化的标准曲线.负载药物后得到的ND-药物复合体记为ND-dox.
在药物释放实验中,将5 mg ND-dox药物复合体溶于12 mL去离子水中分散均匀,然后分别装入三个透析袋中.将透析袋放入100 mL pH 5.0,6.5,7.4的磷酸盐缓冲液(PBS)中,在37◦C恒温搅拌(300 r/min).在特定的时间点取PBS溶液进行吸光度测量,持续20 h.最后,根据吸收度标准曲线计算阿霉素的释放量,进而得到阿霉素的累积释放量随时间的变化曲线.
2.6 细胞毒性和细胞杀伤性能检测
将SGC-7901胃癌细胞系培植于96孔板中,每孔密度为8000,然后在37◦C,5%CO2环境中培养48 h.随后,用新鲜的DMEM培养液冲洗细胞,向每孔加入100µL新鲜的DMEM培养液并加入不同浓度的羧基化纳米金刚石ND-COOH以及ND-dox,在37◦C,5%CO2环境下培养24 h.最后,向细胞板的每个孔中加入10µL MTS[3-(4,5-diethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-etrazolium,培养2 h.最后,使用酶标仪测量每孔细胞在490 nm处的吸光度,计算出每孔细胞的活性.
3 结果与讨论
3.1 ND的形貌和结构
如图2(a)所示,从TEM图中可以看到ND由于颗粒之间的范德瓦耳斯力和氢键等相互作用而形成了团聚体.虽然爆ND单晶粒的尺寸为5 nm左右(图2(a)插图),然而其团聚体的尺寸则达到了几百纳米,这不利于其进一步的应用.从图2(b)中高分辨率透射电镜图可以看到明显的衍射条纹,条纹间距为0.206 nm,与金刚石(111)面的晶格衍射相符合[19].图2(c)所示为ND粉末的XRD谱,在2θ =43.57◦和2θ =75.15◦处出现了明显的衍射峰.与金刚石标准pdf卡片对比,ND的衍射峰与pdf卡片中金刚石的衍射峰符合得较好,表明43.57◦和75.15◦的衍射峰分别来自纳米金刚石(111)面和(022)面的晶格衍射.以上结果表明,虽然爆轰法ND单晶的粒径为3—5 nm,但是其形成了较大尺寸的团聚体(<200 nm),因此对其进行进一步的分散是必要的.

图2 (a)ND的透射电镜图;(b)ND的高分辨率透射电镜图;(c)ND的X射线衍射谱图Fig.2.(a)TEM;(b)HRTEM;(c)XRD spectrum of ND.
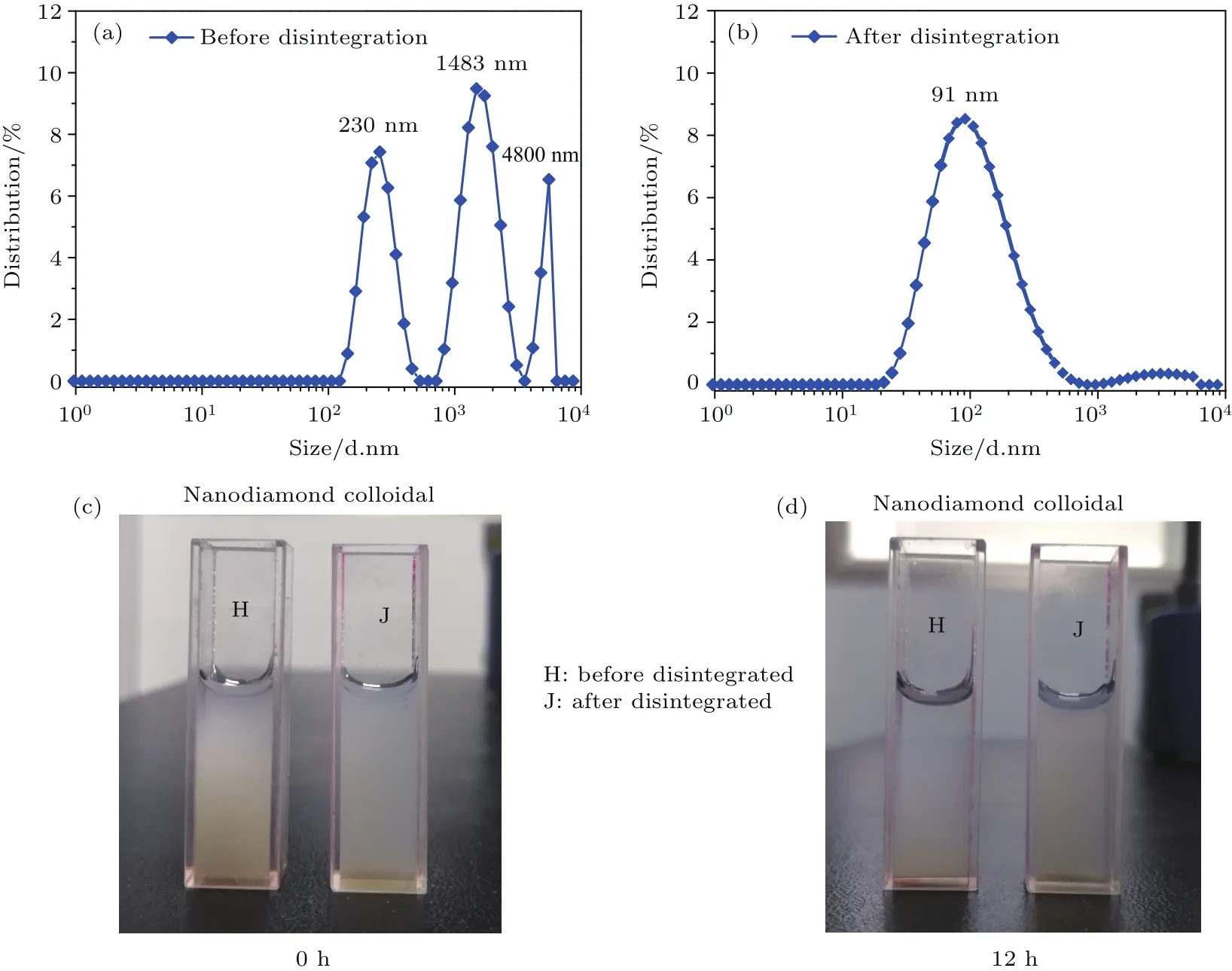
图3 纳米金刚石的粒径分布和胶体 (a)研磨分散前的粒径分布;(b)研磨分散后的粒径分布;(c)0 h时纳米金刚石胶体照片;(d)12 h时纳米金刚石胶体图片Fig.3.Size distribution and colloidal of nanodiamond:(a)Before deaggregation and(b)after deaggregation;(c)the colloidal of nanodiamond at 0 h;(d)the colloidal of nanodiamond at 12 h.
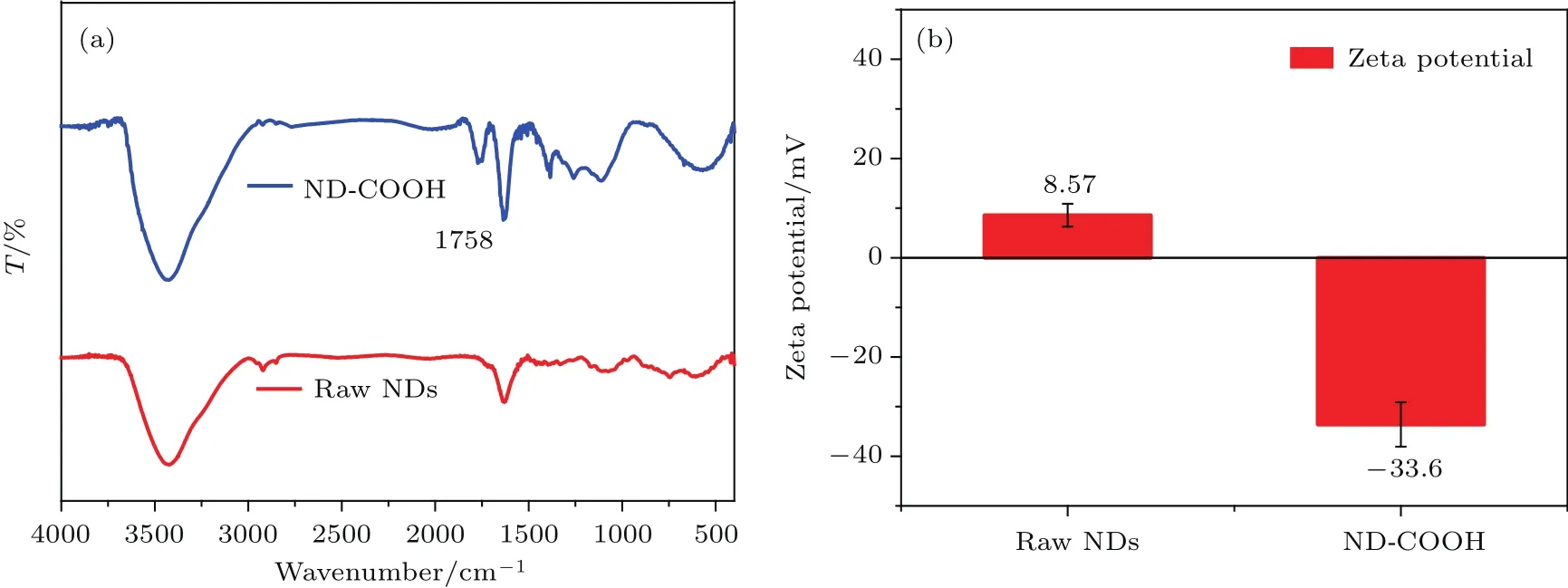
图4(a)ND的FTIR谱;(b)溶液中ND与ND-COOH的zeta电势Fig.4.(a)FTIR spectra of nanodiamond;(b)zeta potential of ND and ND-COOH in solution.
ND颗粒之间由于相互吸引作用形成的大尺寸团聚体使其在水溶液中的分散性较差.为了提高ND在水溶液中分散性,我们采用NaCl机械研磨与超声破碎相结合的方法对其团聚体进行解离.将10 g NaCl晶体与0.25 g ND混合后,ND团聚体被均匀地分散在NaCl中,在机械研磨的外力作用下,ND团聚体受到周围NaCl晶体持续的碰撞和碾压,在碰撞和碾压过程中提供的能量足以破坏ND颗粒之间的范德瓦耳斯、氢键等相互作用能,从而对ND团聚体进行解离.最后再使用超声破碎仪对解离后的ND进行进一步的破碎,并用动态光散射法测量纳米金刚石分散前后的粒径分布.结果如图3所示,分散之前ND的粒径集中分布在230,1483以及4800nm处,平均粒径为1525 nm(图3(a)).而研磨超声分散之后,ND的粒径集中分布在91 nm附近,平均粒径为215 nm,与分散之前相比减小了6倍(图3(b)).图3(c)和图3(d)分别展示了ND分散前后其胶体溶液分散状态随静置时间的变化.分散之前的ND胶体(标记为H)在0 h呈均匀的胶体分散状态(图3(c)),而12 h之后溶液上半部分逐渐变澄清,这是因为大颗粒的ND团聚体迅速沉降在了样品池底部(图3(d)).相比之下,经过机械分散后的ND由于具有更小的粒径,其胶体(标记为J)在12 h内的状态没有发生明显变化,表现出良好的胶体稳定性.这说明通过研磨和超声破碎对ND进行分散,有效减小了纳米金刚石团聚体的粒径,从而明显提升了ND胶体的稳定性,改善了ND的分散效果.
ND表面具有丰富的化学结构如sp2碳,C—H,C—O等,为了使ND可以应用于生物医学领域,对其表面进行功能化得到均一的表面官能团具有重要意义.本文通过混合酸氧化的方法在ND表面修饰了均一的羧基官能团(—COOH),得到了羧基修饰的纳米金刚石(ND-COOH).ND-COOH在水溶液中电离出H+从而具有负的表面电势,可以吸引带正电的小分子[19].如图4(a)红外谱所示,与未经修饰的ND相比,酸洗处理后的纳米金刚石FTIR谱中2930 cm−1附近C—Hx的伸缩振动峰消失,同时在1758 cm−1出现了明显的C=O吸收峰,这来自—COOH中C=O伸缩振动,表明酸洗后ND表面C—Hx等化学结构被氧化并生成了—COOH.图4(b)界面电势结果显示,酸洗后的ND-COOH具有负的表面zeta电位,这是因为NDCOOH表面羧基—COOH水解出H+后,转变成带负电的—COO−使ND-COOH表面呈现出负电性.未修饰的ND表面官能团种类较为繁杂不均一,因此未修饰的ND显示出微弱的正电性.因此,通过对ND进行表面功能化修饰,得到了表面官能团均一的羧基化纳米金刚石ND-COOH,其表面的羧基官能团在水溶液中呈现出负电性.
3.2 药物的负载与释放性能
本文采用盐酸阿霉素(dox)作为模型药物来探究纳米金刚石的药物负载与释放性能,并采用吸光光度法对阿霉素的装载和释放进行定量探究.根据Lambert-Beer定律,溶质的吸光度与浓度在一定范围内呈线性关系:
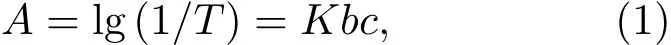
(1)式中A为吸光度;T为透射比,是出射光强度与入射光强度的比值;K为摩尔吸收系数,与物质的性质及入射光波长有关;c为物质的浓度(mol/L);b为吸收层厚度(cm).
在吸光度检测中,定义样品池厚度b0,则样品吸收层厚度也为b0,当选定入射光波长为500 nm后,阿霉素的摩尔吸收系数K0也为常数,此时吸光度A0与阿霉素浓度c0呈线性关系,因此有
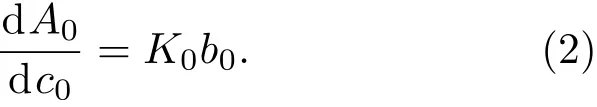
由于实验条件等外界因素会对仪器测量结果造成误差,从而使A0与c0之间不成严格的正比关系,所以实际上
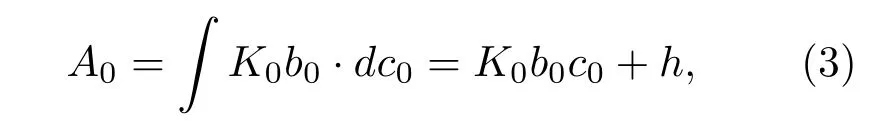
式中K0b0和h均为常数.
在本实验中,如图5(a)所示,阿霉素的吸光度随浓度的减小而不断下降.取阿霉素吸收谱中500 nm处的吸光度A0与浓度c0的数据点进行拟合得到:
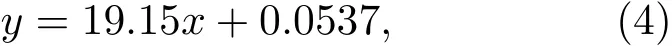
与(3)式比较得到
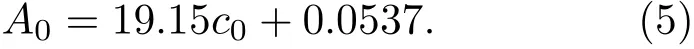
(5)式表明阿霉素的吸光度与浓度呈线性关系,符合Lambert-Beer定律(图5(b)).利用(5)式,可以根据吸光度计算溶液中阿霉素的含量.
为了探究ND-COOH对药物的负载能力并得到药物复合体,将ND-COOH与盐酸阿霉素混合溶于水中搅拌进行药物装载.在药物负载过程中,ND-COOH在水溶液中电离出H+后转变为负电性的ND-COO−(如图4(b)),这使其能够吸附带正电的小分子物质.盐酸阿霉素分子链端的氨基在水溶液中质子化后转变为带正电的NH+3使阿霉素分子带正电,因此盐酸阿霉素可以通过静电相互作用吸附在ND-COOH表面.如图6(a)所示,ND对阿霉素的累积吸附量随时间而缓慢增加,在24 h左右趋于稳定,此时阿霉素在纳米金刚石表面的吸附与脱附过程达到平衡,平衡时药物吸附量为325µg/mg(Dox:ND),远高于目前已报道的ND的药物装载量[27].这是因为纳米金刚石团聚体被分散后增大了总体的表面积,提高了表面的吸附位点,从而增加了对阿霉素的吸附量[28].所得到的负载药物后的纳米金刚石即为药物复合体ND-dox.
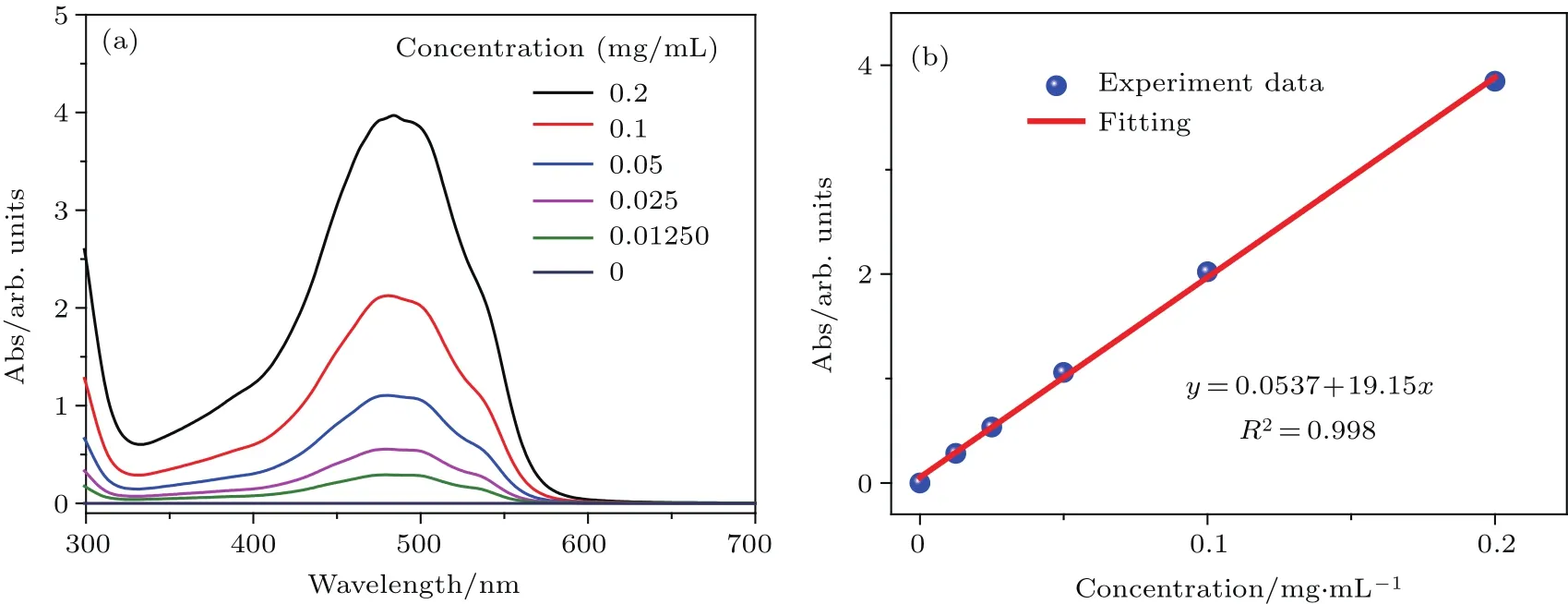
图5 阿霉素的标准曲线 (a)不同浓度阿霉素溶液的吸收谱;(b)吸收度与浓度关系的拟合曲线Fig.5.Standard curve of dox:(a)Absorbance of dox aqueous solution with different concentration;(b) fitting curve of absorbance versus concentration of dox.

图6 (a)ND-COOH对阿霉素的吸附量随时间的变化;(b)阿霉素与纳米金刚石药物复合体(ND-dox)的FTIR谱Fig.6.(a)The variation of loading quantity of dox versus time;(b)FTIR spectra of ND-dox compound.
为了进一步验证药物复合体ND-dox的化学成分,采用FTIR分别对dox和ND-dox进行了检测.结果如图6(b)所示,在盐酸阿霉素的FTIR谱中出现了特定化学结构的特征峰,其中1727 cm−1处的吸收峰来自N—H弯曲振动,而1576,1005 cm−1处的吸收峰分别来自—CHx和C—OH键的弯曲振动[29],这些峰位与阿霉素的分子结构特征峰相符.在ND-dox的FTIR谱中,在1766 cm−1处出现了羧基的C=O伸缩振动,这来自于ND表面的羧基官能团,此外在1727,1576以及1005 cm−1附近也同时出现了阿霉素分子的特征吸收峰,进一步说明了药物复合体中ND与阿霉素同时存在.
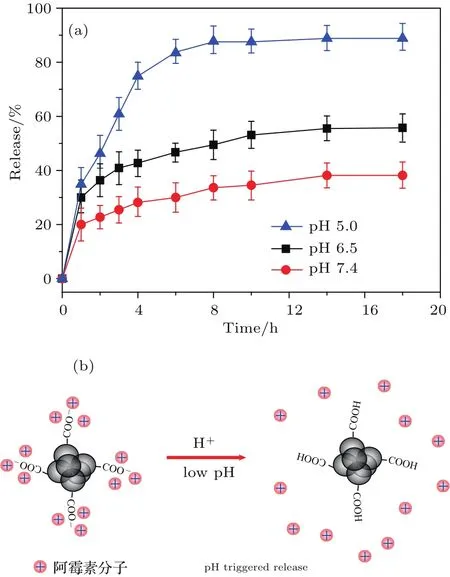
图7 (a)在pH 5.0,6.5以及7.4的PBS中阿霉素的累积释放量随时间的变化;(b)阿霉素的脱吸附与环境pH的关系示意图Fig.7.(a)The variation of cumulative release of dox in pH 5.0,6.5 and 7.4 PBS solutions;(b)schematic illustration of the desorption/adsorption process of dox.
纳米粒子装载抗肿瘤药物在体内循环过程中会经历不同pH的生理环境.一般情况下,肿瘤组织部位pH为5.5左右呈酸性,明显低于正常血液的pH 7.4,因此可以利用不同pH的PBS溶液模拟人体内不同pH的生理环境.将装有等量ND-dox药物复合体的透析袋分别置于pH 5.0,6.5和7.4的PBS溶液中搅拌,并定时检测溶液中阿霉素吸光度变化,然后利用标准曲线将溶液吸光度的变化转变为阿霉素浓度的变化,得到盐酸阿霉素的累积释放量.如图7(a)所示,整体上,ND-dox在不同pH环境中的累积释放量均随时间的增加而缓慢增加,并在18 h之后趋于平稳,此时阿霉素的脱附与吸附达到动态平衡.其中,在pH 5.0的PBS中阿霉素的累积释放达到85%,而在pH 6.5和7.4的PBS中,阿霉素的累积释放则分别为58%和37%,表明溶液酸性越强越有利于阿霉素的释放,从而表现出pH依赖药物释放特性.前面提到,ND-dox中,ND-COOH与dox之间通过羧酸根和氨基的静电相互作用结合在一起(图6),因此ND-dox的pH响应依赖释放行为来自于纳米金刚石羧基与阿霉素分子之间的静电相互作用强度随环境pH值的变化.如图7(b)所示,在低pH溶液中,H+浓度较高,此时ND-COOH表面的—COO−被还原为—COOH,减弱了ND-COOH与阿霉素分子之间的静电相互作用,从而促进了阿霉素的释放,且H+浓度越高,ND-COOH表面的—COO−越少,平衡状态下阿霉素的释放量越大,从而呈现出pH依赖药物施放特性.一般情况下,人体肿瘤组织的pH为5.5左右,比正常组织的pH低[30,31],因此利用ND-COOH对阿霉素的pH响应释放特性,可用ND-COOH作为纳米载体实现药物输运和pH触发靶向释放,这将有助于提高药物的利用率并降低药物对正常组织的毒副作用.
3.3 细胞毒性
纳米粒子的生物毒性及其载药治疗效果是纳米粒子在生物医学领域应用的重要指标,因此本文采用四甲基偶氮唑盐微量酶反应比色法(MTT)检验了ND的生物毒性及其药物复合体ND-dox对细胞的杀伤力.MTT检测结果如图8所示,在0—150µg/mL浓度范围内,虽然SGC-7901细胞活性随浓度增加有所下降,但整体上均大于85%,说明ND-COOH具有较低的生物毒性.而药物复合体ND-dox对肿瘤细胞的体外杀伤实验结果(如图8)表明,在0—80µg/mL浓度范围内,SGC-7901细胞的活性没有明显变化,而当浓度大于80µg/mL时,ND-dox对SGC-7901细胞产生了明显的抑制作用,这是因为随着DMEM中ND-dox含量的增加,dox的累积释放量也不断上升,从而增强了对肿瘤细胞的杀伤.因此,综合以上结果,经过分散和表面功能化的ND对SGC-7901细胞的活性没有显著影响,具有较低的生物毒性,而其负载药物后可实现药物的体外释放和细胞有效杀伤.
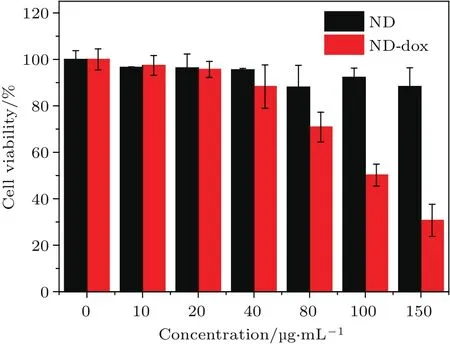
图8 ND与ND-dox对SGC-7901细胞活性的影响(n=3,p<0.05)Fig.8.In fluence of ND and ND-dox on the viability of SGC-7901(n=3,p<0.05).
4 结 论
本文对ND的分散、功能化修饰、药物装载与释放特性以及细胞毒性进行了系统的探究和讨论.通过氯化钠研磨和超声破碎法对爆轰法纳米金刚石进行解离,使其团聚体粒径减小了6倍.通过强酸氧化处理得到了表面羧基化的纳米金刚石NDCOOH,其在水溶液中由于羧基电离后呈现出较高的负Zeta电位−30.6 mV,这使其可以与阿霉素分子之间通过静电相互作用相结合,从而实现阿霉素的负载得到ND-dox.由于纳米金刚石的有效分散提高了纳米金刚石表面吸附位点数量,因此纳米金刚石对盐酸阿霉素的装载率达到了325µg/mL.此外,由于高浓度H+会导致ND-COOH与dox分子之间静电相互作用减弱,因此ND-dox药物复合体在低pH的PBS溶液中具有较高的药物释放速率,表现出显著的pH依赖药物释放特性,这个特点使其有望用于pH触发靶向药物输运.最后,ND-COOH的细胞毒性和ND-dox对SGC-7901细胞系的杀伤实验结果初步表明,羧基功能化后的ND具有较低的细胞毒性,而载药后的ND-dox则可以对SGC-7901细胞系产生显著的治疗效果,表明ND作为药物载体可以装载药物后进行有效的肿瘤细胞杀伤.这些结果表明了纳米金刚石在生物医学领域具有一定的发展潜力,此外,本工作为纳米金刚石在药物运输载体方面的应用提供了借鉴.
感谢郑州大学物理工程学院“金刚石光电材料与器件”课题组所有老师和同学在材料表征、理论分析等方面提供的帮助;感谢郑州大学医学科学院王尧河老师和郑州大学第一附属医院樊慧杰老师在生物医学实验上提供的支持.
