原发性肝癌合并肝性脑病患者肝移植术后生存率的回顾性分析
2018-09-10丁艺洁盛明薇张楠蒋文涛高伟张雅敏杜洪印天津医科大学第一中心临床学院天津009天津市第一中心医院麻醉科天津009天津市第一中心医院移植外科天津009天津市第一中心院肝胆外科天津009
丁艺洁,盛明薇 ,张楠,蒋文涛,高伟,张雅敏,杜洪印,(.天津医科大学第一中心临床学院,天津 009;.天津市第一中心医院麻醉科,天津 009;.天津市第一中心医院移植外科,天津 009;.天津市第一中心院肝胆外科,天津009)
在中国,80%的原发性肝细胞癌(hepatocellular carcinoma,HCC)系肝硬化长期发展的结果[1-2]。肝性脑病(hepatic encephalopathy,HE)是终末期肝硬化的主要并发症之一[3]。对于终末期肝硬化和HCC患者,肝移植手术是重要的根治手段[4-6]。已有研究表明,在单纯肝硬化患者中,HE的发生是影响肝移植术后生存率的独立危险因素[7]。而HCC伴HE行肝移植患者的预后在临床上评价较少,相关数据仍有待完善。本研究对292例成人肝硬化并发HCC患者的临床资料进行分析,探讨HE与HCC患者肝移植术后存活率的相关性,为临床诊断与治疗决策提供参考。
1 资料与方法
1.1 受者选择:选取2008年1月-2010年12月天津市第一中心医院肝胆外科成人肝硬化合并HCC行肝移植受者292例,其中伴发肝性脑病组52例,无肝性脑病组240例。供肝来源于公民尸体捐献或亲属活体供者。研究符合医学伦理学规定,研究方案获得审查委员会批准。
1.2 资料收集与记录:随访统计单中心因肝硬化并发肝癌行肝移植的292例成人受体资料,所有受体均采用同种异体原位全肝移植。术前收集患者基本资料(年龄、性别、血型、身高、体重等),术前评估患者的各脏器功能,收集实验室检查指标,并行肝功能相应的评分,如终末期肝病模型(model for end-stage liver disease,MELD)评分等。术中收集供者的基本资料,同时记录术中供肝冷热缺血时间、手术时间、失血量以及术后肝动脉和门静脉血栓形成等基本信息。术后定期门诊随访,详细记录受者的生存状况。
1.3 研究方法:选取可能影响患者预后的临床指标,如是否存在肝性脑病、术前治疗及甲胎蛋白(alpha fetoprotein,AFP)水平等,以及病理指标,如肿瘤直径大小、肿瘤结节数量、肿瘤分化程度、是否存在门静脉主干或分支癌栓(portal vein tumor thrombi,PVTT)及TNM分期等。应用Kaplan-Meier方法进行单因素生存分析,并绘制相应生存曲线;应用 Cox比例风险模型进行多因素分析。
1.4 统计学分析:应用SPSS(22.0版)统计软件进行统计学分析。数据以均数±标准差(x±s)或频数 (频率)表示,数据正态性使用Q-Q plot检验,组间两两比较用t检验,样本率的比较采用χ2检验,采用Kaplan-Meier法计算累积生存率,各组生存率差异的比较采用Log-Rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 基本情况:术前资料及术中资料在HCC伴HE组及非HE组中的分布情况如表1所示。基线资料显示,两组患者的身高、体重等基本信息无明显差异,而血清实验室检查,肿瘤预后高危指标的水平以及终末期肝病模型MELD评分在两组间呈现显著差异。术中资料在HCC伴HE组及非HE组中的分布情况如表2所示。两组患者的供肝基本数据无明显差异,移植术中失血量及补液量无明显差异(表1~2)。
2.2 单因素生存分析:292例患者均随访5年,失访率为11.9%。将可能影响患者预后的临床指标对肝移植术后预后的影响分别进行单因素分析及Log-Rank检验,HE、术前介入治疗、AFP水平、肿瘤直径、结节数量、分化程度、PVTT、TNM分期9项指标差异有统计学意义,与肝移植术后较低存活率相关。(图1 ~ 6,表3)

表1 肝硬化合并肝癌患者移植前基本资料

表2 肝硬化合并肝癌患者移植术中基本资料

图1 有无HE患者术后存活率对比

图2 不同MELD评分的肝癌患者肝移植术后存活率对比
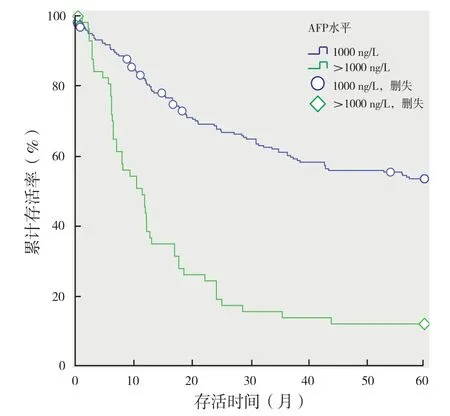
图3 不同AFP水平患者术后存活率对比

图4 有无门静脉栓塞患者术后存活率对比

图5 不同分化程度患者术后存活率对比

图6 不同TNM分期患者术后存活率对比

表3 临床病理因素对移植后生存率的单因素分析
2.3 多因素Cox风险比例模型(表4):将单因素分析存在差异的临床病理指标同肝性脑病共同建立多因素Cox风险比例模型。结果显示影响患者术后累积生存率的独立危险因素有:术前AFP水平>1000 μg/L(HR=1.52,P=0.047)、肿瘤直径>5 cm(HR=1.759,P=0.013),肿瘤中度分化(HR=1.497,P=0.053),肿瘤低度分化(HR=1.177,P=0.027),门静脉癌栓 PVTT(HR=2.352,P=0.000),TNM分期Ⅲ期(HR=1.834,P=0.033),Ⅳ期(HR=3.596,P=0.003)。
3 讨 论
3.1 HE是影响HCC患者移植的非主要危险因素,其由急性或慢性肝细胞功能衰竭引发,是以代谢紊乱为基础的中枢神经系统功能失调综合征,是终末期肝硬化的主要并发症之一[8]。肝硬化晚期,由于肝细胞功能衰竭,代谢失调,常常并发肝性脑病,被视作肝硬化严重程度的指示灯。肝硬化本身是肝细胞癌的独立危险因素,80%以上的肝细胞性肝癌由肝硬化发展而来,在肝硬化所致的肝纤维化,肝小叶结构破坏,肝细胞不断坏死与修复的过程中,原癌基因被激活,因肝病而免疫功能无法清除变异细胞,最终导致癌灶的形成[9-10]。HE是终末期肝病重要的并发症, Wong 等[7,11]以及 Brandman 等[12]通过多中心,大样本临床资料进行了回顾性研究,通过Cox回归模型(HR=1.27)以及Logistic(OR=3.68)回归模型,证实HE为单纯肝硬化患者行肝移植术后病死率的独立危险因素。此外,MELD评分是单纯肝硬化患者肝移植术后病死率的重要预测指标[13-16],MELD评分越高,患者术后死亡风险越高。

表4 临床病理因素对移植后生存率的多因素Cox风险比例模型
本研究Kaplan-Meier生存曲线显示, HE组患者的五年累积存活率并不低于无HE患者(图1,表3),相反,前者存活率出现高于后者的趋势;同时,MELD≤25分与MELD>25分生存率无明显差异(图2,表3)。而其他肿瘤相关指标则对术后生存率有显著指示作用(图3 ~ 6,表3)。研究发现,术后10个月内,HE组患者累计存活率低于无HE组患者,10~12个月后生存曲线交叉,至随访终点无HE组总存活率低于HE组(图1)。对单纯肝硬化行移植术的患者,并发HE者术后较低存活率的原因与神经系统功能障碍有关,主要表现为星状细胞水肿、颅内压增高等[17-18]。呼吸道误吸性肺炎及机会性感染密切相关,死亡高峰出现在术后1年内[19]。HE对预后的长期影响主要由于部分严重患者神经功能的不可逆性损伤[20]。对于HCC行移植术患者,伴发HE所致的术后短期高病死率在本研究中有所体现,而肿瘤学因子是影响HCC移植患者术后远期生存率的主要因素。Cox风险比例模型分析最终证实影响HCC患者肝移植术后存活率的独立危险因子包括:术前AFP水平>1000 μg/L(HR=1.52,P=0.047),肿瘤直径>5 cm(HR=1.759,P=0.013),肿瘤中度低度分化(HR=1.777,P=0.027),门静脉癌栓PVTT(HR=2.352,P=0.000),TNM分期Ⅲ期(HR=1.834,P=0.033),Ⅳ期(HR=3.596,P=0.003),与文献报道相符(表4)[21]。对于肝硬化合并HCC的肝移植患者,HE与MELD评分对预后的影响被肝癌相关指标的影响所掩盖,并不被考虑为影响预后的主要危险因素。
3.2 以HE为主要临床表现的患者可提高HCC早期检出率:肝癌早期临床表现多不典型,起病隐匿,不伴明显肝硬化的患者发现肝癌时多已到达中晚期,错过治疗机会。HE是肝硬化的重要并发症之一,轻度包括人格、智力改变,重度患者则出现扑翼样震颤等典型神经系统表现。以HE为主要表现的肝病患者临床上较易被重视,因此,增加了早期肝癌检出的概率。本研究发现,伴有HE的HCC患者AFP水平、肿瘤大小、分化程度及TNM分期等指标都表现出好于不伴HE的HCC患者组 (表1)。肝性脑病可视作肝癌发生的前哨症状,提高肝癌早期检出率,增加患者及时治疗机会。
综上所述,HE是影响HCC患者肝移植术后生存率的非主要因素。并发HE患者的HCC患者移植术后存活率不低于不伴发HE组患者,其原因与前者群体中独立危险因素肿瘤分化程度普遍较好、TNM分期较早、AFP增高程度及门静脉癌栓程度较轻有关。肝癌并发HE的患者,早期肝癌的检出率可提高。围术期积极防控HE,及早采取肝移植术治疗可获得较理想的中、长期结果。
