植物花青素生物合成代谢途径及调控因子研究
2018-09-09吴雪霞张爱冬朱宗文查丁石
吴雪霞,张爱冬,朱宗文,姚 静,查丁石,李 贤∗
(1上海市农业科学院设施园艺研究所;2上海市设施园艺技术重点实验室,上海201403;3临沂市农业局,临沂276001)
花青素(Anthocyanins)是一类水溶性天然色素,基本结构为3,5,7-羟基-2-苯基苯并吡喃,属于类黄酮化合物,在细胞质中合成,但在液泡中积累[1-2]。花青素在植物的花瓣、果实、叶和茎等中广泛分布,使植物呈现红、蓝、紫等颜色[3-4]。
植物中常见6种花青素:天竺葵色素(Pelargonidin,Pg)、矢车菊色素(Cyanidin,Cy)、飞燕草色素(Delphinidin,Dp)、芍药花色素(Peonidin,Pn)、牵牛花色素(Petunidin,Pt)和锦葵色素(Malvidin,Mv)[2,5-7]。
研究表明,花青素与植物抗逆性相关,能提高植物抗低温、干旱和强光等逆境的能力,降低植物紫外辐射和病害的程度,保护植物,减轻损伤[7-8]。同时,因其具有清除自由基、提高抗氧化性、保护血管、降低血脂、抗肿瘤等一系列生理功能,被广泛应用于药品、保健品、化妆品以及动物生产等多个领域[9-10]。因此,花青素的研究越来越受到人们的重视,花青素作为一种次生代谢产物,其合成代谢受多种调控因子及酶影响,研究花青素生物合成过程及代谢过程中的关键酶、调控基因及环境因子对花青素的调控,有利于深入理解花青素的合成机理,对于进一步开发利用花青素具有重要意义。
1 植物花青素生物合成途径及碳骨架修饰
1.1 植物花青素生物合成途径
植物花青素生物合成属于次生代谢产物黄酮类的分支途径,关于花青素合成过程及关键酶类均已研究的比较清楚。虽然不同物种在花青素组成及积累模式上存在差异,但花青素合成的主要反应是类似的[3,10]。花青素合成路径主要分为以下三个阶段(图1)。
第一阶段,类黄酮代谢的初始反应。前体物质苯丙氨酸经苯丙氨酸裂解酶(Phenylalanine ammonialyase,PAL)、肉桂酸羟化酶(Cinnamate 4-hydroxylase,C4H)和4-香豆酰CoA连接酶(4-coumarate CoA ligase,4CL)合成4-香豆酰CoA[11-12]。
第二阶段,类黄酮代谢的重要反应。4-香豆酰 CoA和丙二酰 CoA经查尔酮合成酶(Chalcone synthase,CHS)催化合成四羟基查尔酮,查尔酮经查尔酮异构酶(Chalcone isomerase,CHI)的异构化作用形成无色化合物三羟基黄烷酮,随后进一步经黄烷酮-3-羟化酶(Flavanone 3-hydroxylase,F3H)催化合成黄烷酮和二氢黄酮醇[2,5]。
第三阶段,各种花青素的合成阶段。黄烷酮和二氢黄烷酮经二氢黄酮醇还原酶(Dihydroflavonol 4-reductase,DFR)催化作用,还原C环4位生成不同的无色花色素。随后,这些无色花色素经花青素合成酶(Anthocyanidin synthase,ANS)催化作用产生有色花色素;类黄酮3-葡糖基转移酶(Flavonoid 3-O-glucosyltransferase,3GT∕UFGT)催化有色花色素与糖苷结合转化成有色的花色苷[2,5,11]。
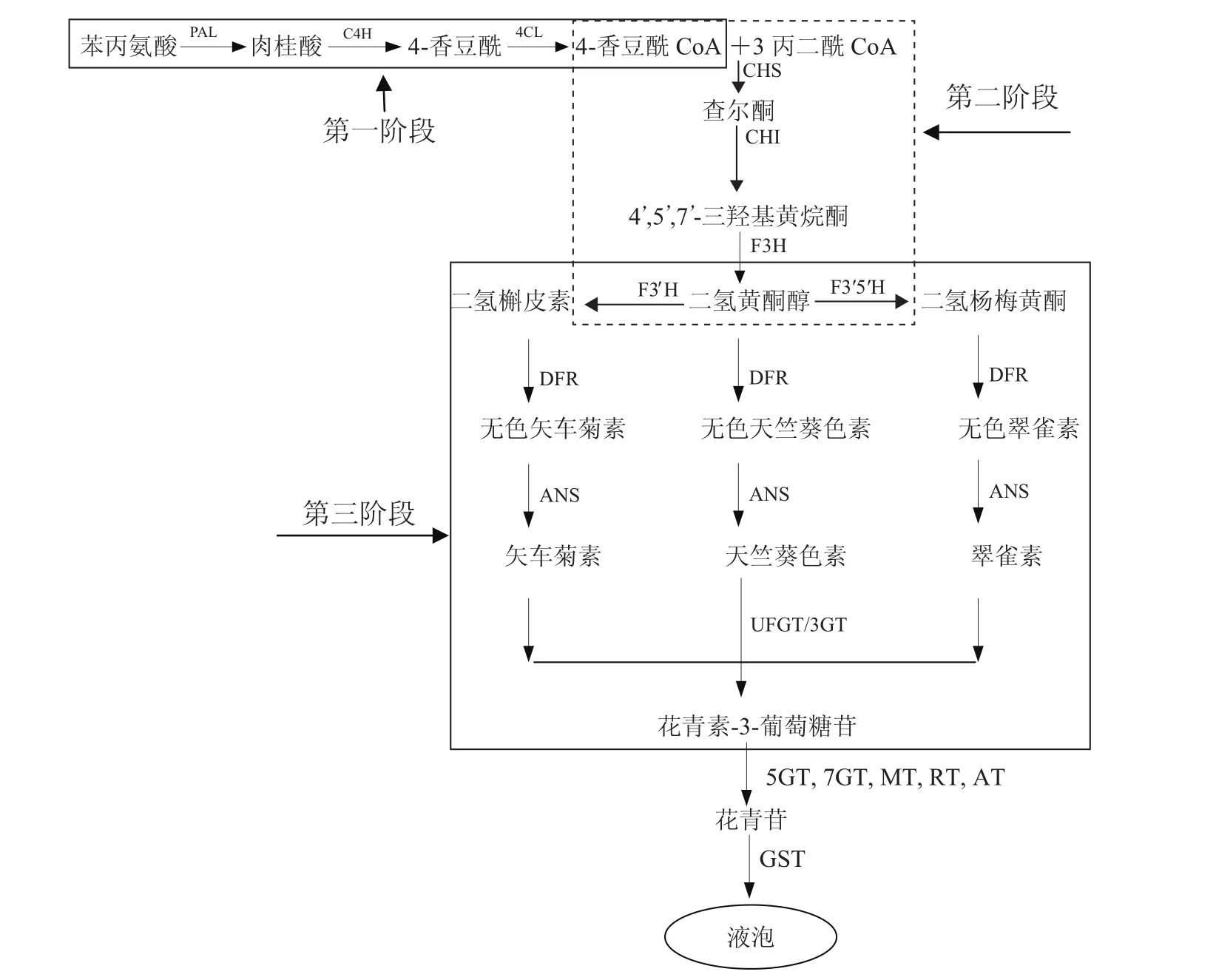
图1 植物花青素生物合成途径Fig.1 Biosynthesis pathway of plant anthocyanin
1.2 花青素碳骨架修饰
花青素碳骨架修饰主要包括糖基化、酰基化和甲基化,不同的修饰形成了不同的花青素[5,12],目前关于这方面的研究才刚刚起步。花青素糖基化主要通过3GT实现,也存在第5位或第7位的鼠李糖及其他糖类的修饰。矮牵牛花、金鱼草的花青素修饰是通过鼠李糖糖基化产生花青素-3-芸香糖苷,非酿酒葡萄品种发生在C3和C5位,形成3,5-O-二糖苷花青素。花青素酰基化增强花青素的稳定性,阻止花青素水解为无色的查尔酮;甲基化使得花青素的结构、颜色具有多样性。花青素酰基化和甲基化过程涉及甲基转移酶和酰基转移酶的参与[7]。例如,有多种底物特异性的酰基转移酶BAHD家族,依赖于S-腺苷蛋氨酸的花青素甲基转移酶。
2 植物花青素生物合成途径中关键酶基因
植物花青素生物合成途径主要包括编码花青素代谢生物合成过程中的关键酶CHS、CHI、F3H、DFR、ANS和UF3GT等结构基因,这些结构基因的表达不仅受转录因子MYB、bHLH和WD40的调控,还受外在环境因子的影响[13-15]。克隆鉴定与花青素合成相关的结构基因和调控基因,进而分析出它们的功能,成为近年来花青素相关基因研究的热点。外在环境因子通过对花青素苷合成途径中的结构基因和调控基因进行调节来影响花青素苷合成。
2.1 植物花青素生物合成途径中主要结构基因
2.1.1 查尔酮合成酶基因
CHS是花青素生物合成途径中的第1个关键酶,CHS基因已从多种植物中分离克隆出来[16]。CHS基因的表达影响着植物花色的变化,将CHS基因在矮牵牛中过量表达,导致CHS基因和内源基因发生共抑制,产生白色或斑点状的花[17];CHS基因表达量减少,矮牵牛花色由紫色变为白色[18]。Schijlen等[19]利用RNAi技术抑制番茄CHS的表达,发现转基因番茄花青素含量、Chs1和Chs2转录水平及CHS酶活性均比野生型的低,果实颜色比野生型的浅,且果实无籽,说明番茄CHS不仅参与花青素生物合成,还有其他生物功能,需要后续试验验证。
2.1.2 查尔酮异构酶基因
CHI是花青素生物合成途径中的第2个关键酶,CHI基因最早从豌豆中分离出来,目前,该基因已从矮牵牛、菜豆和豌豆等植物中分离并克隆[14-15]。CHI酶能催化4’,5’,7’-三羟基黄烷酮转化为无色柚皮素,4’,5’,7’-三羟基黄烷酮是合成黄色花色素的重要底物,因此黄色的形成与CHI基因表达有关。Nishihara等[20]利用RNAi技术使烟草的CHI基因受到抑制,烟草花瓣中的4’,5’,7’-三羟基黄烷酮含量降低,查尔酮含量增加,花瓣变成黄色。祝钦泷[21]在深红色的矮牵牛中导入水母雪莲(Saussurea medusa)的CHI基因,发现矮牵牛花色变浅粉红并出现深色网状纹路。
2.1.3 黄烷酮3-羟化酶基因
F3H是花青素生物合成早期途径中的关键酶之一,F3H基因最先从金鱼草中克隆得到,目前已从多种植物中分离得到[21]。F3H调控黄酮与花青素苷产物的合成,Jiang等[22]运用RNAi技术,用含有F3HRNAi载体的农杆菌GV3101侵染授粉14 d的草莓果实,发现侵染果实中F3H基因的表达水平与对照相比下调约70%,同时花青素和黄酮醇含量均显著减少。姜伊娜[23]、柳青等[24]利用RNAi技术,抑制大豆F3H基因表达,发现转化生成的大豆黄烷酮的含量明显高于对照。
2.1.4 二羟基黄酮醇还原酶基因
DFR是花青素生物合成途径中把二羟基黄酮醇转变为花色素反应的第一个酶,决定着花色素苷的形成。O'Reilly等[25]采用转座子标签技术首次从玉米和金鱼草中分离DFR基因。DFR有3种底物DHK,DHQ和DHM,底物不同,合成花色不同。Meyer等[26]、Johnson等[27]分别将还原DHK的DFR基因导入矮牵牛,矮牵牛花色均变为砖红色。李军等[28]利用农杆菌介导的遗传转化技术,将MaDFR基因转入栽培烟草中,发现转基因烟草花冠颜色加深,但花青素的种类没有改变。因此,认为通过生物技术调节DFR基因改造花色也是未来主要的研究方向之一。
2.1.5 花色素苷合成酶基因
ANS是植物花青素生物合成途径末端的关键酶,主要作用是将无色花青素转化为有色花青素,是花卉色彩形成的基础物质[29-30]。ANS基因最初从玉米的A2突变体中克隆得到,目前已从紫苏、玉米、金鱼草等植物中分离出来[31]。王丽辉等[32]通过VIGS方法构建ANS基因载体并转染‘红星’苹果,发现转染的苹果组织中ANS基因表达量下调98.1%,同时花色苷和类黄酮合成受阻。亓希武等[33]报道在结紫色果的桑品种‘粤椹’中ANS基因表达具有组织特异性,且随着果色加深其表达水平呈上升趋势;结白色果的桑品种‘珍珠白’各个组织部位和各个成熟时期ANS基因均不表达。Ahn等[34]报道紫色品种‘结缕草’ANS基因在穗尖及匍匐茎中表达水平较高,绿色品种中表达量明显较低。
2.1.6 类黄酮3-O-糖基转移酶基因
3GT是花青素生物合成途径的最后一个关键酶,主要负责将不稳定的花色素转变为稳定的花色苷。王惠聪等[35]研究表明,荔枝花青素的积累与3GT基因活性呈显著正相关。Kobayashi等[36]认为葡萄表现型由白色向红色的转变是因为3GT基因表达活性变化的结果。韦青[37]通过组培技术向马铃薯中导入3GT基因,发现转基因植株的块茎和匍匐茎中该基因表达量明显高于对照。
2.2 花青素生物合成过程中主要调控基因
花青素生物合成过程中主要调控基因有3类:MYB、bHLH和WD40转录因子,这些转录因子可形成复合体,激活或者抑制结构基因的时空表达,调控花青素在植物中的积累。
2.2.1 MYB转录因子
MYB转录因子包含一段保守的MYB结构域,为51—52个氨基酸的肽段。根据MYB结构域的个数可分为3类:含有1个结构域的R3-MYB,含有2个结构域的R2R3-MYB和含有3个结构域的R1R2R3-MYB。MYB转录因子在调控花青素合成过程中起着重要的作用,尤其是R2R3-MYB[38]。杜海等[39]报道将编码R2R3-MYB转录因子的大豆GmMYB042基因在烟草中过表达,使类黄酮代谢途径中PAL、CHS和FLS基因的表达上调,总黄酮含量明显高于对照。Deluc等[40]在烟草中过表达葡萄VvMYB5a基因,影响烟草中花青素、黄酮醇、单宁酸和木质素的代谢。而李军等[41]研究发现,与花青素合成相关的MnMYBJ和MnMYB4基因表达量随着桑树果实发育呈下调趋势,基因MnMYB330显著上调,表明前者在花青素合成过程中起负调控作用,后者起正调控作用。
2.2.2 bHLH转录因子
bHLH转录因子包含一段保守的bHLH结构域,约60个氨基酸残基组成。bHLH转录因子是调节类黄酮和花青素合成的一类重要基因。Park等[42]研究表明,将bHLH2基因插入转座子形成的圆叶牵牛ivs(ivory seed)突变体,突变体花色变为白色,种子颜色深棕色变为乳白色。Butelli等[43]研究发现,转基因MYB类转录因子Ros1、bHLH转录因子Del的番茄花青素合成关键酶PAL和CHI活性增加,花青素含量提高。金万梅等[44]研究表明,转Ros1和Del基因草莓花青素合成途径中的结构基因表达量上调,其中CHI上调幅度最大,根和叶的颜色变成红紫色。
2.2.3 WD40转录因子
WD40转录因子一般有4—16个WD重复基元组成,每个WD基元约由40个高度保守的氨基酸残基组成。目前,已经从矮牵牛、拟南芥、紫苏、玉米和苹果克隆出编码WD40蛋白的基因AN11、TTG1、PFWD、PAC1和MdTTG1[45]。Selinger等[46]研究表明,编码WD40蛋白的玉米PAC1基因与矮牵牛AN11、拟南芥TTG1类似,可以调节整个花色苷合成途径中的不同结构基因;该基因调节玉米糊粉层颜色,不影响营养组织中的含量。罗遵喜等[47]研究发现,马铃薯基因STWD40和矮牵牛花青素转录调控基因AN11相似性达86%,且在马铃薯的不同组织部位均表达,该基因在紫色马铃薯中的表达量均高于白色马铃薯相同部位的表达量。
2.3 环境因子
影响花青素苷生物合成过程的外界环境因子主要指光、温度和糖等[17,35]。光主要包括光强与光质,是影响花青素积累的主要环境因子之一。李运丽等[48]研究表明,强光促进紫罗勒单位叶面积叶绿素和花青素含量。李国良等[49]研究发现,与白光相比,蓝光有利于甘薯新生叶片花青素的积累,红光则有抑制作用。Zoratti等[50]研究表明,与白光相比,红光促进了覆盆子果实的黄酮类物质合成,黑暗和远红光相反;红光对原花青素含量影响不大,黑暗和远红光则使之提高。Wang等[37]研究发现,UV-A和UV-B均能促进萝卜块根花青素合成。
温度是影响花青素积累的另一个主要环境因子。前人报道低温能诱导花青素合成相关基因的表达,提高花青素含量;高温抑制相关基因的表达,降低花青素苷的含量[51]。李国良等[49]研究表明,高温处理下,甘薯叶片DFR和F3H的表达受到抑制,花青素含量降低。Mori等[52]报道夜间高温会抑制葡萄转色期前CHS、F3H、DFR、LDOX、UFGT基因表达,转色期后UFGT活性增加。
糖作为一种信号分子,通过信号转导途径,可以调节花青素合成相关酶基因的表达而影响植物花青素的积累。研究表明,糖可以显著诱导拟南芥和葡萄花青素苷的积累[53]。Minakuchi等[54]发现,增加保鲜液中蔗糖含量,可以使切花香石竹花瓣的颜色加深。
3 展望
通过植物突变体、RNA干涉技术和转基因技术,筛选、克隆和鉴定植物花青素生物合成过程中相关的基因,了解植物的花青素合成代谢过程与调控机制,目前在许多模式植物中研究的已较为深入。但是花青素的生物合成过程是非常复杂的,不同的基因调控不同的花青素合成阶段,不同基因之间也相互影响。随着分子生物技术(转录组学、蛋白质组学和代谢组学等)的进一步发展,鉴定花青素生物合成过程中的结构基因和调控因子,深入了解植物花青素合成调控机制,对理解以及利用基因工程开展作物遗传改良具有理论指导作用。
植物花青素积累除受到内在基因的控制外,还受到各种环境因素光、温度、糖、激素、病原激发子等刺激因子的影响。目前外界因素对花青素的生物合成主要集中于单一因素,而多种外界因素的交叉、协同调控花青素苷呈色的分子机制研究的较少,因此,研究各种环境因素对花青素生物合成的综合效应和分子机制,环境外在因子和内在因子的互相影响,是今后的研究方向之一。
