拟南芥ABI3基因缺失突变体的鉴定及对盐胁迫的响应
2018-09-09赵彦敏高海琴瓮巧云
赵彦敏,高海琴,瓮巧云
(1张家口广播电视大学,张家口075000;2河北北方学院农林科技学院,张家口075000)
植物在生长发育过程中,不可避免地会受到各种非生物因素如干旱、低温、高盐及高温等的胁迫,导致农作物的生长品质及产量下降。作为植物体内重要的逆境响应激素之一,脱落酸(Abscisic acid,ABA)既是胁迫的诱导产物,又是胁迫信号的传导者,通过级联放大反应,能迅速参与到植物抗胁迫的反应中。此外,脱落酸还参与植物生长的其他环节,如能促使马铃薯形成块茎、抑制种子的萌发等。早期通过正向遗传学方法筛选到一些在萌发率上对 ABA不敏感的拟南芥基因,如ABI1-1、ABI2-1、ABI3、ABI4和ABI5[1-4];作为ABA信号的正调控转录因子ABI3基因,在植物的抗旱性和耐盐性功能中起重要的作用[5],主要在种子里表达[2]。尽管在玉米、拟南芥、水稻等多种植物中已经发现了ABI3基因的存在,但ABI3在ABA介导的信号通路中的作用并不清楚。为了研究ABI3基因在拟南芥抗NaCl胁迫中的作用,本试验检测野生型拟南芥和ABI3基因突变体在NaCl胁迫下种子萌发率、籽苗根长及其生物量的差异,以期为研究拟南芥ABI3基因的功能提供参考。
1 材料与方法
1.1 材料
拟南芥(Arabidopsis thaliana)野生型Col-0和ABI3基因T-DNA插入突变体abi3种子购买于美国拟南芥种质资源中心(TheArabidopsisBiological Resource Center,ABRC),MS培养基干粉购于北京石木易生公司,植物DNA提取试剂盒、RNA提取试剂盒、反转录试剂盒等购于天根生化科技(北京)有限公司。
1.2 拟南芥的培养
分别取拟南芥野生型(Col-0)及ABI3基因突变体(abi3)种子,在10%NaClO3中消毒5 min后,用灭菌的去离子水冲洗2遍,播种于固体MS培养基上。在4℃下春化3 d,转移至光照培养箱再培养7 d,分别将野生型Col-0和abi3突变体的籽苗移植于蛭石与石英砂混匀(1∶1)的花盆中,于光照培养箱中继续培养2周。光照培养箱的培养条件为22℃、相对湿度60%、光周期8 h光照∕16 h黑暗、光照强度3 000 lx。
1.3 纯合突变体abi3的筛选和鉴定
收集上述种植的拟南芥叶片,利用植物基因组DNA提取试剂盒提取拟南芥基因组DNA。以基因组DNA为模板,利用三引物法筛选和鉴定abi3纯合突变体。根据http:∕∕signal.salk.edu∕网站上提供的TDNA 插入位点信息,设计鉴定引物。 引物分别为 LBb1.3:5’-ATTTTGCCGATTTCGGAAC-3’、LP:5’-TCGGTCCATGGTAGGTAACTG-3’和 RP:5’-GAGAAGATCCGACTCCAAACC-3’。 LP∕RP 和 LBb1.3∕RP 的PCR产物预期大小分别为1 220 bp和559—859 bp。25 μL PCR反应体系包括:1 μL DNA模板、上述3个引物各1 μL,2×PCR Mix 12.5 μL,用ddH2O补足至25 μL。扩增程序为:94℃预变性5 min;94℃变性40 s、60℃退火2 min、72℃延伸1 min,循环35次;最后72℃延伸10 min。
1.4 野生型Col-0和abi3突变体植株ABI3基因表达量测定
分别取上述拟南芥的叶片提取总RNA,并反转录为cDNA。以cDNA为模板,以拟南芥β-actin为内参基因,检测ABI3基因的表达情况。基因特异性正反引物分别为5’-TGAATCCGTACCAATATCCTTATG-3’和5’-TCTCGCCATCCGTTTCTTTC-3’;内参基因β-actin的特异性引物为5’-CTCCCGCTATGTATG TCGCC-3’和5’-CAGCAAGGTCAAGACGGAGG-3’。 PCR 反应体系:2 × dNTP mix 25 μL,正反引物(25 pmol∕μL)各1 μL,模板cDNA 2 μL,补水至50 μL。 扩增程序为:94℃ 预变性4 min;94℃变性20 s,60℃退火30 s,72℃延伸30 s,循环35次;最后72℃延伸10 min。扩增产物用1.0%的琼脂糖凝胶进行电泳分析。
1.5 NaCl胁迫对拟南芥植株的影响
拟南芥野生型Col-0和abi3突变体种子经表面消毒后,分别播种于含有不同浓度NaCl(0 mmol∕L、100 mmol∕L、125 mmol∕L、150 mmol∕L)的 MS 培养基上。 观察种子萌发情况,并于第 7 天统计各处理的萌芽率(以种子露白为准),于第9天测定各处理的生物量(30株∕处理)。为了检测NaCl胁迫对突变体根长的影响,种子消毒后点种于培养皿进行垂直培养,培养8 d后进行根长的测量。
2 结果与分析
2.1 突变体鉴定
根据http:∕∕signal.salk.edu∕网站所提供的信息,可知T-DNA插入到该基因的第1个内含子内(图1-A),由于T-DNA的片段较长,引物LP∕RP不能将其所包含的DNA序列扩增出来。如果是突变纯合子,只能借助T-DNA上的引物与基因上的引物LBb1.3∕RP才能扩出条带,条带大小约为500 bp;如果是突变杂合子,利用LBb1.3∕RP和LP∕RP两对引物在DNA水平上可扩增出2个条带,分别约为500 bp和1 000 bp。由图1-B可知,所检测的突变体均为纯合突变体。对初步鉴定出的纯合突变体进行RT-PCR,如图1-C所显示,拟南芥野生型Col-0扩增出一条带,约500 bp,7株突变体中只有第5株没有扩增产物。由此可见,所检测的7株突变体中只有1株中的ABI3基因因为T-DNA的插入而完全沉默。收集该植株的种子,用于后续ABI3基因功能的研究。
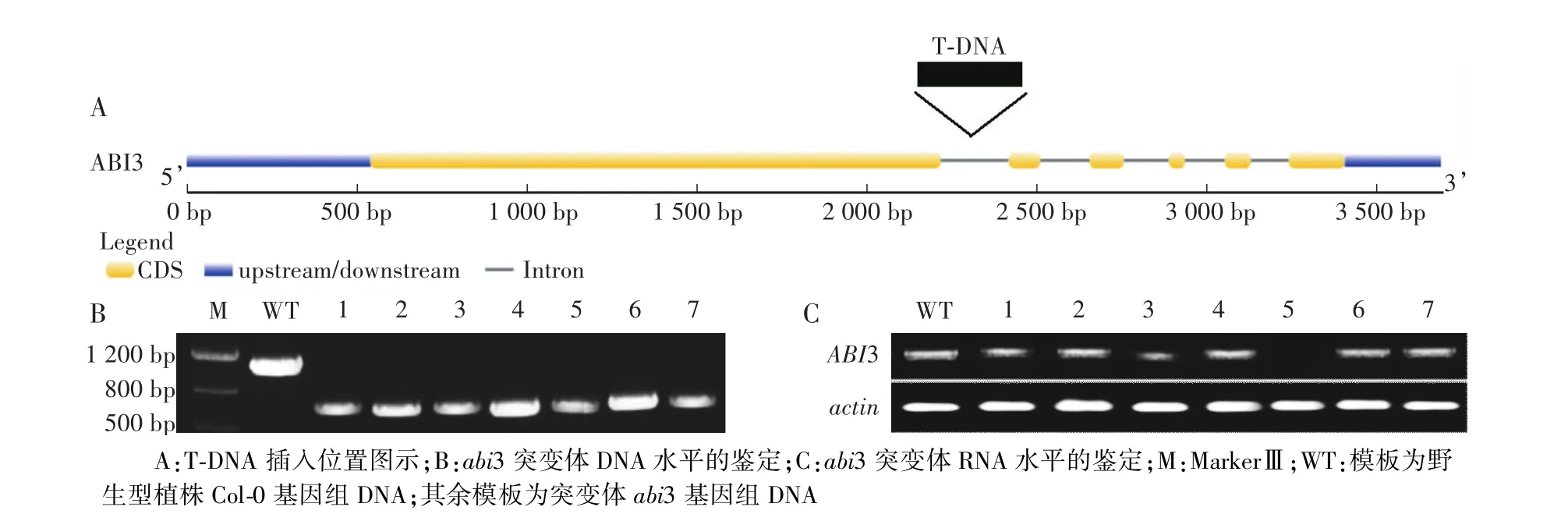
图1 拟南芥abi3突变体的鉴定和基因表达分析Fig.1 Identification and gene expression analysis of Arabidopsis thaliana mutant abi3
由图2可知,在无胁迫条件下,野生型Col-0及abi3突变体植株表型差异不明显。
2.2 NaCl胁迫对abi3突变体的影响
2.2.1 NaCl胁迫对突变体种子萌发率的影响
由图3可知,在不含NaCl的培养基上,拟南芥野生型Col-0和abi3突变体种子的萌发率并无显著差异,且长势基本一致;随着NaCl浓度的升高,abi3突变体种子的萌发率明显受到抑制,当NaCl浓度达到150 mmol∕L时,abi3突变体种子的萌发率仅为44%,与野生型Col-0种子的萌发率存在极显著差异。

图2 野生型Col-0(左)和abi3突变体(右)的表型Fig.2 Phenotypes of wild type Col-0(left)and abi3 mutant(right)

图3 不同浓度NaCl胁迫下拟南芥种子的萌发率Fig.3 Germination rate of Arabidopsis thaliana seeds under NaCl stress of different concentrations
2.2.2 NaCl胁迫对突变体生物量的影响

图4 不同浓度NaCl胁迫下拟南芥的生物量Fig.4 Biomass of Arabidopsis thaliana plants under NaCl stress of different concentrations
如图4所示,在不含NaCl的培养基上,拟南芥野生型Col-0的生物量高于abi3突变体,但二者之间的差异并不显著;随着NaCl浓度的升高,野生型Col-0与abi3突变体的生物量均明显下降,但突变体下降的幅度更为显著,当NaCl浓度达到125 mmol∕L和150 mmol∕L时,abi3突变体与野生型Col-0的生物量之间存在极显著差异。
2.2.3 NaCl胁迫对突变体根长的影响
如图5所示,野生型Col-0与abi3突变体的根长在不含NaCl的培养基上尽管有所不同,但二者之间的差异并不显著;随着NaCl浓度的升高,野生型Col-0与abi3突变体根长的生长均受到了抑制,突变体受抑制的程度更为显著,当NaCl浓度达到125 mmol∕L和150 mmol∕L时,野生型Col-0与abi3突变体的根长之间存在极显著差异。
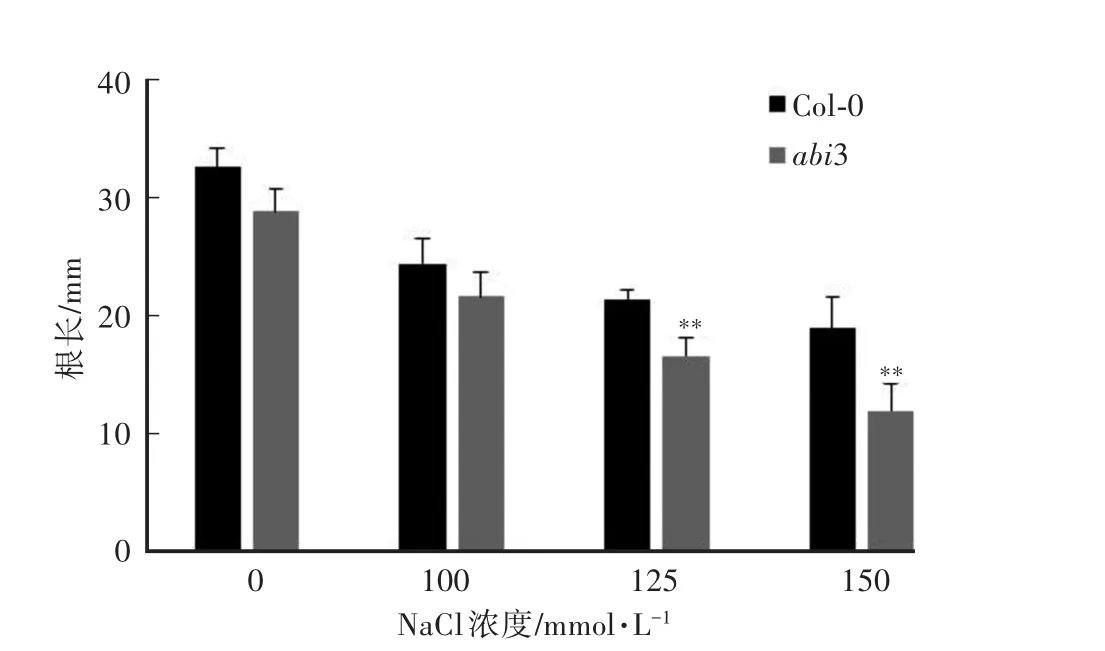
图5 不同浓度NaCl胁迫下拟南芥植株的根长Fig.5 Root length of Arabidopsis thaliana plants under NaCl stress of different concentrations
3 讨论
ABA是保卫细胞信号转导的关键信号因子,不仅参与生物胁迫,而且在低温、干旱、高盐等非生物胁迫条件下也起着重要作用。普遍认为ABA通过促进开放的气孔关闭或抑制关闭的气孔开放,控制植物与外界进行水分与气体的交换,从而调节植物的代谢与生理活动[6]。如给番茄喷施外源ABA时,miR159的表达量会下调,从而上调其对应的靶基因MYB[7],而MYB基因的上调对提高植物抗逆境能力有促进作用[8]。种子休眠的建立和维持与ABA有着密切的相关性,ABA的累积可诱导野生型拟南芥种子进入休眠,并维持休眠状态,而ABA不敏感突变体(abi1和abi2)种子表现为轻度休眠[9-10]。本研究中,当野生型Col-0与abi3突变体受到150 mmol∕LNaCl胁迫时,abi3突变体种子的萌发率、籽苗的生物量以及根长的受抑制程度显著高于野生型Col-0,初步表明ABI3基因在拟南芥抗NaCl胁迫中起着极其重要的作用。
